印楝素对大型溞生存、生长和繁殖的毒性效应
2013-02-08刘青李扬何芳张清靖倪健邵森林
刘青,李扬,何芳,张清靖,倪健,邵森林
(1.大连海洋大学辽宁省水生生物学重点实验室,辽宁大连116023;2.北京水产科学研究所,北京100068;3.新疆赛湖渔业科技开发有限公司,新疆博乐 833400)
印楝素对大型溞生存、生长和繁殖的毒性效应
刘青1,李扬1,何芳1,张清靖2,倪健3,邵森林1
(1.大连海洋大学辽宁省水生生物学重点实验室,辽宁大连116023;2.北京水产科学研究所,北京100068;3.新疆赛湖渔业科技开发有限公司,新疆博乐 833400)
通过急性、慢性毒性试验,研究了质量分数为0.32%的印楝素乳油对大型溞Daphnia magna生存、生长和繁殖的影响。急性毒性试验结果表明:印楝素对大型溞24 h和48 h的半致死浓度LC50分别为39、17 μg/L,安全浓度为1.12 μg/L,属于剧毒物质。慢性毒性试验结果表明:在试验浓度范围内,随着印楝素浓度的增加,大型溞的内禀增长率(rm)、产幼次数、总繁殖量、平均世代周期(T)、净生殖率(R0)和存活时间均呈现降低趋势;低浓度组 (0.432、0.768、1.120 μg/L)大型溞的rm与对照组 (空白对照和丙酮对照)差异不明显(P>0.05),当印楝素浓度升高至1.340、2.400 μg/L时,大型溞的rm逐渐下降,从0.347 6 d-1降至最低值0.306 3 d-1;而最高印楝素浓度组 (2.400 μg/L)大型溞的存活时间、R0、T、产幼次数和总繁殖量均为最低,分别为13.60 d、24.696 1、11.439 9 d、2.47次、26.87个。本研究表明,高浓度印楝素显著缩短了大型溞的存活时间,降低了净生殖率R0、平均世代时间T、产幼次数和总繁殖量。关键词:印楝素;大型溞;毒性;内禀增长率;存活;繁殖
印楝素是印楝Azadirachta indica种仁中所含的次生代谢产物,属于四环三萜类物质,在结构上类似于昆虫的蜕皮激素。在昆虫防治上,主要通过破坏昆虫口器的化学感受器使昆虫产生拒食作用,扰乱昆虫内分泌激素的平衡,进而影响昆虫的生长发育和繁殖[1-2]。印楝素对非靶标的鱼类、鸟类、哺乳动物具有低毒、易分解、无残留等特性,是理想的植物源杀虫剂[3-4],现已在全球范围内广泛应用于农业和森林病虫害的防治[5-6]。在大量使用的过程中,印楝素会随着雨水冲刷、人工喷洒等过程进入到天然水环境[7],进而通过食物链的富集进入生物体内,并对低等水生生物产生一定的影响。因此,评价印楝素对低等水生生物的影响具有重要意义。
大型溞Daphnia magna在水生态系统中处于重要位置,具有生活周期短、繁殖快、易于培养、对毒物敏感、经济实惠、使用简便等优点,已广泛应用于各种有毒有害物质的毒性评价中[8-9]。目前关于印楝素对低等水生生物影响的报道很少,仅见Kreutzweiser[7]报道了印楝素对几种底栖动物的毒性以及联合国粮食与农业组织 (FAO)报告中公布了印楝素对几种水生无脊椎动物的毒性[10],而国内关于印楝素对低等水生生物影响的研究尚未见报道。本研究中,作者以大型溞为试验动物,通过急性、慢性毒性试验,研究了质量分数为0.32%的印楝素乳油对大型溞生存、生长和繁殖的影响,旨在对印楝素的安全性评价提供基础依据。
1 材料与方法
1.1 材料
大型溞由大连海洋大学水生生物实验室提供,从人工气候箱 (RTOP-500D)中挑选健康个体,用同一母体繁殖的后代进行克隆培养,连续培养达到试验所需幼溞数量。大型溞的饵料为四尾栅藻Scenedesmus quadricanda,由大连海洋大学水生生物实验室提供。
试验用0.32%(质量分数,下同)印楝素乳油由沈阳东大迪克化工药业有限公司生产,采用丙酮助溶。使用时先配制浓度为1 000 mg/L的母液,再按试验浓度逐级稀释,母液现配现用。
试验用水为曝气除氯24 h以上的自来水,pH为8.7,溶解氧为6~8mg/L,试验容器均用体积分数为4%的硝酸浸泡24 h后使用。
1.2 方法
1.2.1 急性毒性试验 采用静态试验方法,在人工气候箱中进行。设置1个空白对照组和1个丙酮对照组 (丙酮含量为18 mg/L),并根据预试验结果,按等对数间距分别设置5个印楝素浓度水平:24 h急性毒性试验中浓度设置为18、24、32、43、58 μg/L,48 h急性毒性试验中浓度设置为10、13、18、24、32 μg/L,每个浓度梯度设3个平行。试验容器为100 mL的烧杯,每个烧杯中放入80 mL试验溶液和20只出生6~24 h的大型溞幼溞。以受试溞心脏停止跳动为死亡标志,判断方法详见《水生生物毒性试验方法》[11]。应用SPSS 16.0软件中的Probit命令对死亡率进行计算,得到印楝素对大型溞的24 h LC50和48 h LC50及其相应的95%置信区间,并按照下式计算安全浓度 (Sc)[12]:
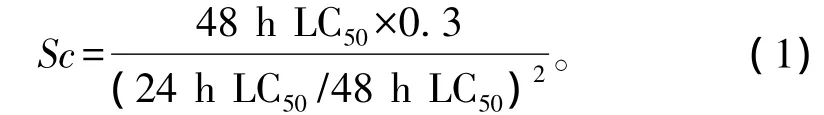
1.2.2 慢性毒性试验 以24 h和48 h的LC50计算得出的印楝素对大型溞安全浓度 (1.12 μg/L)为基础,设置 5个印楝素浓度水平 (0.432、0.768、1.120、1.340、2.400 μg/L),同时设置空白对照和丙酮对照组,每个浓度梯度设15个平行。试验容器为50 mL的玻璃瓶,每瓶放入40 mL试验溶液和1只出生6~24 h的幼溞。试验在人工气候箱中进行,温度为 (23±1)℃,光周期为12L∶12D,湿度为50%。每24 h更换1次试验溶液,试验期间用新鲜四尾栅藻投喂,投饵密度为2.0×105~3.0×105个/mL。同时取出新生幼溞,并记录母溞第1次产幼时间、第1次产幼数、产幼总数、总胎数和死亡数,时间持续到所有受试个体全部死亡为止,最后测量母溞的体长。
大型溞的内禀增长率 (rm)采用文献 [13]中的Euler方程计算:rm的精确值是在粗略计算的基础上采用逐步逼近法得出。
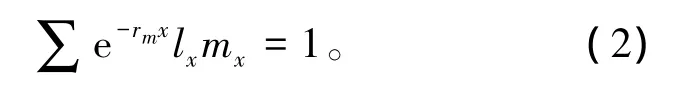
大型溞的净生殖率 (R0)、平均世代时间 (T)和周限增长率 (λ)根据下式进行计算:
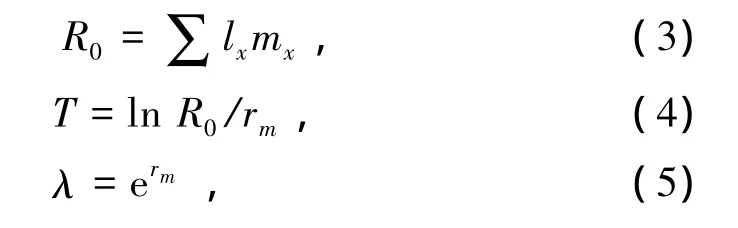
其中:x为日龄;lx为第x天大型溞的存活率;mx为每只母溞在第x天的产幼数。
1.3 数据处理
试验数据用Excel 2007软件进行处理,采用SPSS 16.0进行单因素方差分析和Duncan多重比较。显著性水平设为0.05。
2 结果与分析
2.1 印楝素对大型溞的急性毒性
从表1可见,急性毒性试验中,大型溞的死亡率随着印楝素浓度的增加而升高。24 h急性毒性试验中,除两个较低浓度组 (18 μg/L和24 μg/L)外,其他3个浓度组大型溞的死亡数与对照组均有显著性差异 (P<0.05);48 h急性毒性试验中,各浓度组与对照组均有显著性差异 (P<0.05)。经计算得到印楝素对大型溞的24 h LC50和48 h LC50分别为 39 μg/L 和 17 μg/L,95% 置信区间分 别为34 ~46 μg/L 和15 ~20 μg/L,印楝素对大型溞的安全浓度为1.12 μg/L。

表1 印楝素对大型溞的急性毒性试验结果Tab.1 Acute toxicity of azadirachtin to water fleas Daphnia magna
2.2 印楝素对大型溞的慢性毒性
从表2可见:当印楝素浓度为0.432 μg/L时,大型溞的存活时间与对照组没有显著性差异 (P>0.05);当浓度升高到0.768 μg/L时,对大型溞的存活时间产生明显影响 (P<0.05),且浓度越高大型溞的存活时间越短。
印楝素对大型溞的繁殖有明显影响,虽然各试验组间母溞的第1次产幼数无显著性差异 (P>0.05),但母溞的第1次产幼时间随印楝素浓度的变化而变化。当印楝素浓度大于或等于1.120 μg/L时,母溞的第1次产幼时间比对照组显著提前 (P<0.05)。母溞的产幼总数和产幼总胎数均随药物浓度的升高而减少,除最低浓度 (0.432 μg/L)组外,其他浓度组中母溞的产幼总胎数和产幼总数均比对照组显著降低 (P<0.05);当印楝素浓度为2.400 μg/L时,母溞产幼溞总数仅为26.87个,远低于空白对照组 (249.93个)和丙酮对照组 (203.06个),产幼胎数也仅有2.47次,远低于空白对照组 (18.71次)和丙酮对照组(18.55次)。
印楝素对大型溞生长的影响不明显,只有当浓度增大到2.400 μg/L时,才对大型溞的体长产生显著影响 (P<0.05)。
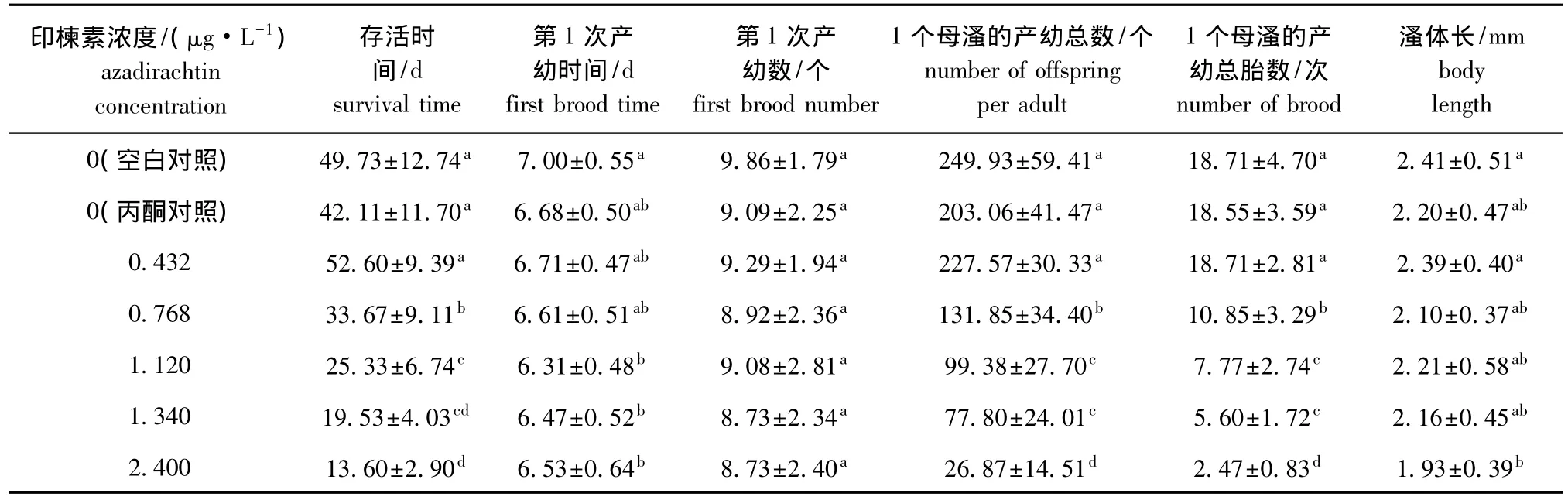
表2 不同浓度的印楝素对大型溞存活、生长和繁殖的影响Tab.2 Effect of azadirachtin on growth and reproduction of water fleas Daphnia magna
从图1可见:试验初期 (10 d内),各浓度组中大型溞的存活数与对照组相差不大 (P>0.05);随着试验时间的延长,大型溞的存活数随着印楝素浓度的升高有明显变化。最低浓度组 (0.432 μg/L)大型溞的存活数随时间下降的变化趋势与对照组始终相差不明显 (P>0.05),而最高浓度组(2.400 μg/L)溞的存活数随试验时间的延长明显急剧下降。即印楝素浓度越高,大型溞的存活数随时间下降越快。
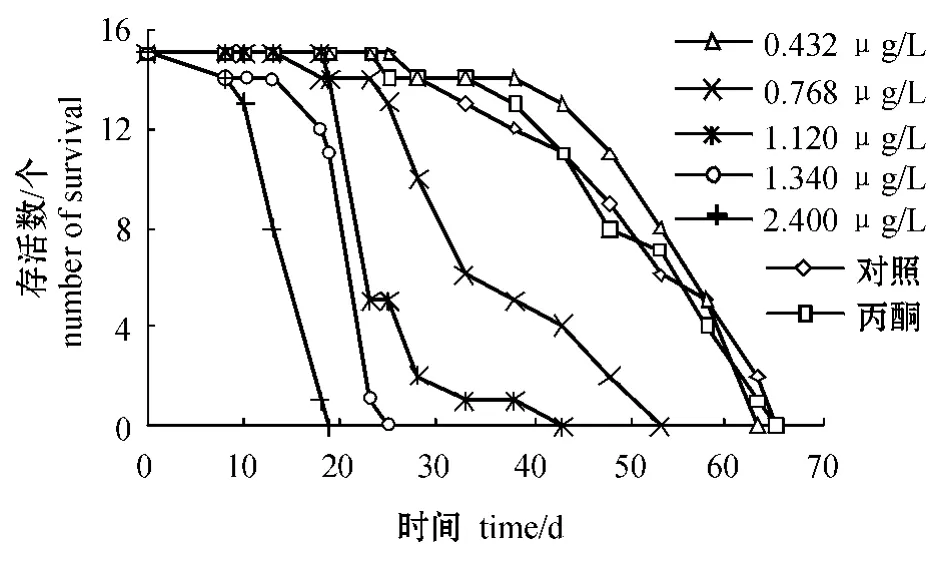
图1 各组大型溞的存活数随时间的变化Fig.1 Changes in survivorship of Daphnia magna in different experimental groups over time
从表3可见:除高浓度组 (2.400 μg/L)大型溞的内禀增长率 (rm)和周限增长率 (λ)较低外,其他各药物浓度组大型溞的rm和λ与对照组变化不大;印楝素浓度对大型溞的平均世代时间(T)和净生殖率 (R0)影响十分明显,均随着印楝素浓度的增加而降低。当印楝素浓度为0.432 μg/L时,大型溞的T和R0分别为28.723 9 d和226.489 7,与对照组大型溞的T和R0的比值分别为1.004和0.922 3;但当浓度增加到2.400 μg/L时,大型溞的 T和 R0分别为 11.439 9d和24.696 1,与对照组大型溞的T和R0的比值却分别降为0.400 0和0.100 6。
3 讨论
3.1 印楝素对水生生物的毒性
水生生物毒性试验是预测化学物质进入水生态系统后可能产生效应的方法之一,参考一些国家的分级标准中国将毒物分为剧毒、高毒、中等毒、低毒和微毒5个级别[12]。对溞类而言,当48 h LC50<0.1 mg/L时属于剧毒物质。本试验中0.32%印楝素乳油对大型溞的24 h LC50和48 h LC50值分别为0.039 mg/L和 0.017 mg/L,按毒物分级标准,0.32%印楝素乳油对大型溞属于剧毒物质。印楝素对水生生物的影响报道不多见,吴伟等[3]研究了印楝素对斑马鱼Danio rerio的急性毒性,得出印楝素对斑马鱼的48 h LC50和96 h LC50分别为41.9 mg/L和23.3 mg/L,属中低毒农药。如把 Margosan-O混入水中,鳟的96 h LC50为88 mg/L,翻车鱼的 96 h LC50为 37 mg/L[14],表明 Margosan-O对鱼类低毒。Kreutzweiser[7]报道了印楝素对Hydatophylax argus等几种底栖生物无明显急性毒性。联合国粮食与农业组织 (FAO)[10]的报告显示,印楝素对几种低等水生生物的影响也较小,对藻类栅藻Scenedesmus subspicatus的72 h EC50为530 mg/L,对大型溞Daphnia magna的48 h EC50为23.63 mg/L。陈小军等[15]研究表明,印楝素对水生生物无明显毒性或毒性较小。而本试验中得到的大型溞毒性试验数据与FAO公布的数据相差很大,导致这种结果的差异有多方面的原因,可能与使用的助溶剂和药物的产地、季节、剂型、试验环境条件及受试生物的不同品系等有关。
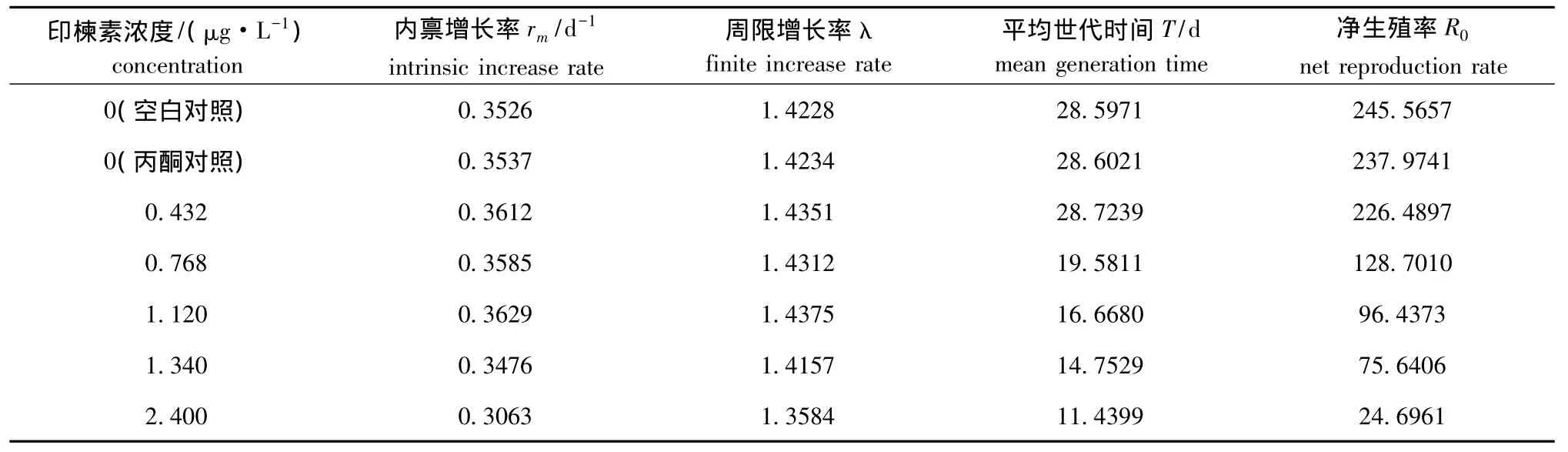
表3 不同浓度的印楝素对大型溞生命周期的影响Tab.3 Effect of different concentrations of azadirachtin on life cycle of water fleas Daphnia magna
印楝素不溶于水,本试验中用丙酮作助溶剂,丙酮为微毒或无毒物质[16],符合毒性试验要求。FAO的数据没有助溶剂类型,对此作者不好判定。
印楝素是印楝种仁中所含的次生代谢产物,为柠檬素类化合物[1-2]。试验证实,不同地区的印楝种仁中印楝素含量差别很大,印度、缅甸和泰国的印楝素含量较高,而夏季气温高的苏丹、索马里、马里和尼泊尔等国家的印楝素含量较低[17]。
除了不同的地理种源外,不同季节收获的印楝种仁中,印楝素的含量也有较大差别。印楝素杀虫剂中的主要活性成分有印楝素A和印楝素B,通常印楝素B的含量为印楝素A的1/3~1/2[18]。Sidhu等[19]认为,印楝素A是雨季所结果实种子中的主要代谢物,在雨季含量较高,而干季胁迫明显有利于印楝素B的合成,在干季所结果实种子中两者含量的比例几乎相等。可见,收获季节不同,是影响印楝素A和B含量的主要因素。
印楝素A和B的稳定性和致毒作用也各不同。二者在甲醇、甲醇+水及直接热贮中均易降解,且印楝素A降解率高于印楝素B,即印楝素B的稳定性高于印楝素A[20]。在活体拒食和生长发育抑制试验中,印楝素A的活性显著高于印楝素B,但对细胞核的影响中,印楝素B的影响显著高于印楝素A,经印楝素B处理后的细胞核破损率更大,破损程度也更严重[18]。
印楝素含量及其稳定性除受遗传因素控制外也会因受环境因素的影响而发生变化。印楝素对光敏感,暴露在光下会逐渐失去活性;温度对印楝素的稳定性也有影响,通常需在低于20℃的温度下贮藏,高温会加速印楝素的降解;印楝素在中性条件下比较稳定,但在碱性和强酸溶液中不稳定[17]。
由此可见,作为植物源药物的印楝素,其产地、出产季节和保存方式等都是影响药性的重要因素,会直接导致各试验结果的差异。
此外,药物的不同剂型对药效也有很大影响。印楝素有多种剂型,目前在美国登记的印楝杀虫剂产品有:Neem oil 15种、Neem oil rtu 14种、Neem oil tgai 1种、Trilogy xl 4种和Trilogy xl rtu 4种。中国批准登记的印楝素杀虫剂主要有40%、32.8%、20%、12%和10%印楝原药及0.3%、0.32%、0.5%、0.7%、0.8%、0.9%、1.0%和2.0%的印楝素单剂等[15]。Abou-Tarboush 等[21]以印楝杀虫剂Neemix-4.5处理SWR/J鼠,其研究结果与之前纯印楝素对鼠的影响结果不一致。张欣等[22]研究发现,脂溶性的乳剂类除草剂丁草胺比粉剂的毒性大得多。本试验中使用的印楝素属于脂溶性,这也可能加大了印楝素对大型溞的毒性。当然,不同溶剂、不同产地、不同剂型的印楝素对大型溞的毒性需要进一步试验证实。
3.2 印楝素对大型溞内禀增长率和繁殖的影响
一种生物的内禀增长能力决定了该种生物的生育力、寿命和发育速率,是种群增殖能力的一个重要综合指标,可以灵敏地反映出环境对一种群的影响[13]。本试验中,低浓度组 (0.432、0.768、1.120 μg/L)大型溞的内禀增长率与对照组 (空白对照和丙酮对照)差别不大,甚至略有提高,这与一些研究结果相似。如Chu等[23]研究表明,5 μg/L和50 μg/L的S-烯虫酯促进了多刺裸腹溞的种群增长。杨冬青等[24]也发现,低浓度 (0.1 μg/L和1.0 μg/L)的β-六六六对多刺裸腹溞的种群增长也有明显的促进作用。黄国兰等[25]发现,4.0、2.0、1.0 mg/L的DBP对大型溞繁殖有抑制作用,而0.5 mg/L的DBP显著提高了大型溞的净生殖率。以上研究均表明,在被低浓度药物刺激后,溞类等生物受到轻度逆境胁迫,可促使其瞬时增长率增大,以此来抵御外部不良的环境条件。本试验中随着印楝素浓度升高至2.400 μg/L,大型溞内禀增长率逐渐下降为最低值0.306 3 d-1。Fernndez 等[26]与 Ferrando 等[27]研究认为,种群内禀增长率的降低是杀虫剂对溞类的慢性毒性所致。
本试验中,与对照组相比,高浓度组(1.340、2.400 μg/L)大型溞的初次产幼时间早,产幼总数和产幼次数少,存活时间短,大型溞的内禀增长率、净生殖率和世代时间均减少。有研究表明,100、1 000 μg/L的β-六六六能显著缩短多刺裸腹溞的世代时间,且1 000 μg/L的β-六六六还能显著减小多刺裸腹溞出生时的生命期望值和净生殖率[24]。Chuah 等[28]研究也表明,0.002 mg/L的硫丹能显著降低多刺裸腹溞的平均寿命、首次生殖年龄和种群内禀增长率。高浓度、亚致死剂量的杀虫剂使浮游动物母体中毒加深,影响了母体的机能、生存和繁殖,即对浮游动物的种群增长产生抑制作用[29-30],这已是不争的事实。
有研究报道,在药物作用或生存环境改变的条件下,枝角类能改变生殖方式,产生休眠卵[31-33]。本试验中,随着印楝素浓度的增加,产生休眠卵的个体及每个个体产休眠卵的数量也增加,并且是在没有雄性个体的情况下由雌体直接产生。这种情况在蚤状溞种群中出现过,即在没有雄体时也能进行有性生殖,雌体直接产生卵鞍,并在未受精的情况下孵出幼溞[34-35]。本试验中,除 0.432 μg/L 浓度组外,其他浓度组的大型溞均有几次在生殖高峰后产生休眠卵,这可能与印楝素的药性以及没有迅速移除幼溞、试验水体较小有关,造成母溞一段时间处于劣质的环境中而产生了休眠卵。
[1] 王瑞波,党承林,张燕平.一种新型生物农药——印楝素的性质和功效[C]//2002-2003年教育科研文荟(二).昆明:云南科技出版社,2003:146-150.
[2] Shmutterer H.Properties and potential of natural pesticides from the neem tree[J].Annu Rev Entomol,1990,35(5):271-297.
[3] 吴伟,朱小惠.印楝素对鱼的毒性及在鱼类寄生虫病防治上的应用[J].农药学学报,2003,5(2):85-88.
[4] Aerts R J,Mordue A.Feeding deterrence and toxicity of neem triterpenoids[J].Journal of Ecology,1997,23:2117-2132.
[5] Boonsoong B,Bullangpoti V.Toxicity of neem-based insecticides on non-target aquatic invertebrates:a mini review[J].Biopesticides International,2009,5(2):100-105.
[6] 戴建青,黄志伟,杜家纬.印楝素乳油对斜纹夜蛾的生物活性及田间防效研究[J].应用生态学报,2005,16(6):1095-1098.
[7] Kreutzweiser D P.Nontarget effects of neem-based insecticides on aquatic invertebrates[J].Ecotoxinology and Environmental Safety,1997,36:109-117.
[8] Sanchez M,Ferrando M,Sancho E,et al.Assessment of the toxicity of a pesticide with a two-generation reproduction test using Daphnia magna[J].Comparative Biochemistry and Physiology Part C:Pharmacology,Toxicology and Endocrinology,1999,124(3):247-252.
[9] Villarroel M J,Sancho E,Ferrando M D,et al.Acute,chronic and sublethal effects of the herbicide propanil on Daphnia magna[J].Chemosphere,2003,53(8):857-864.
[10] Food and Agriculture Organization.FAO Specifications and evaluations for agricultural pesticides[R].Rome,2003:21.
[11] 周永欣,章宗涉.水生生物毒性试验方法[M].北京:农业出版社,1989.
[12] 国家环境保护局.水生生物监测手册[M].南京:东南大学出版社,1993.
[13] 董双林,赵文.养殖水域生态学[M].北京:中国农业出版社,2004:45-52.
[14] 张志祥,程东美,田永清,等.印楝、印楝杀虫剂与生态环境[J].科技导报,2004(2):56-59.
[15] 陈小军,杨益众,张志祥,等.印楝素及印楝杀虫剂的安全性评价研究进展[J].生态环境学报,2010,19(6):1478-1484.
[16] Canton J H,Adema D M M.Reprodicibility of short-term and reproduction toxicity experiments with Daphnia magna and comparison of the sensitivity of Daphnia magna with Daphnia pulex and Daphnia cucullata in short-term experiments[J].Hydrobiologia,1978,59(2):135-143.
[17] 王瑞波,刘新龙,张燕平.影响印楝素稳定性及其含量的主要因素[J].西部林业科学,2004,33(1):59-61.
[18] 黄星艳,李文欧,张志祥,等.印楝素A与印楝素B对粉纹夜蛾 BTI-Tn-5B1-4 的细胞毒性[J].昆虫学报,2010,53(6):664-669.
[19] Sidhu O P,Behl H M.Seasonal variation in azadirachtins in seeds ofAzadirachta indica[J].Current Science(Bangalore),1996,70(12):1084-1086.
[20] 张志祥,田永清,程东美,等.印楝素A和印楝素B的稳定性比较[J].南京农业大学学报,2005,28(1):125-127.
[21] Abou-Tarboush F M,El-Ashmaoui H M,Hussein H I,et al.Effect of azadirachtin of neemix-4.5 on SWR/J mice[J].Saudi Journal of Biological Sciences,2009,16:69-76.
[22] 张欣,赵文,徐峰.三种除草剂对大型溞Daphnia magna存活、生长和繁殖的影响[J].农药学学报,2009,11(1):121- 125.
[23] Chu K H,Wong C K,Chiu K C.Effect of the insect growth regulator(s)-methoprene on survival and reproduction of the freshwater cladoceranMoina macrocopa[J].Environmental Pollution,1997,96(2):173-178.
[24] 杨冬青,席贻龙,姚胜,等.β-六六六对多刺裸腹溞生命表统计学参数的影响[J].动物学杂志,2007,42(5):157-160.
[25] 黄国兰,孙洪文,高娟,等.邻苯二甲酸二丁酯对大型溞的毒性作用研究[J].环境化学,1993,17(5):428-433.
[26] Fernndez A,Ferrando M D,Andreu E.Chronic toxicity of diazinon toDaphnia magna:effects on survival,reproduction and growth[J].Toxicological and Environmental Chemistry,1995,49(1-2):25-32.
[27] Ferrando M D,Sancho E,Andreu-Moliner E.Effects of lindane onDaphnia magnaduring chronic exposure[J].Environmental Science and Health,Part B,1995,30(6):815-825.
[28] Chuah T S,Loh J Y,Hii Y S.Acute and chronic effects of the insecticide-endosulfan on freshwater cladoceran,Moina macrocopa[J].Straus Bulletin of Environmental Contamination and Toxicology,2007,79(5):557-561.
[29] Wong C K,Chu K H,Shum F F.Acute and chronic toxicity of malathion to the freshwater cladoceranMoina macrocopa[J].Water,Air,and Soil Pollution,1995,84(3-4):4399-4051.
[30] Wong C K.Effects of diazinon on some population parameters ofMoina macrocopa(Cladocera)[J].Water,Air,and Soil Pollution,1997,94(3-4):393-399.
[31] 陈艳,席贻龙,何忠文.艾氏剂对连续三个世代多刺裸腹溞生命表统计学参数的影响[J].生态学报,2009,29(10):58-65.
[32] Lurling M,Roozen F.Response ofDaphniato substances released from crowed congeners and conspecifics[J].Journal of Plankton Research,2003,23(8):967-978.
[33] 邓道贵,孟琼,殷四涛,等.温度和食物浓度对大型溞Daphnia magna种群动态和两性生殖的影响[J].生态学报,2008,28(9):68-75.
[34] Spaak P.Sexual reproduction inDaphnia:interspecific differences in a hybrid species complex[J].Oecologia,1995,104:501-507.
[35] Innes D J,Singleton D R.Variation in allocation to sexual and asexual reproduction among clones of cyclically parthenogeneticDaphnia pulex(Crustacea Cladocera)[J].Biological Journal of the Linnean Society,2000,71:771-787.
The toxicity of azadirachtin to survival,growth and reproduction of water fleas Daphnia magna
LIU Qing1,LI Yang1,HE Fang1,ZHANG Qing-jing2,NI Jian3,SHAO Sen-lin1
(1.Key Laboratory of Hydrobiology in Liaoning Province,Dalian Ocean University,Dalian 116023,China;2.Beijing Fisheries Research Institute,Beijing 100068,China;3.Xinjiang Saihu Fishery Technology Development Co.,Ltd.,Bole 833400,China)
The toxic effects of 0.32%azadirachtin EC on survival,growth and reproduction of water fleas Daphnia magna were studied by acute and chronic toxicity tests.The acute toxicity test showed that azadirachtin as a highly toxic substance had the 24 h LC50of 39 μg/L,48 h LC50of 17 μg/L and the safety concentration of 1.12 μg/L for the water fleas.The Chronic toxicity test revealed that the water fleas showed decrease in intrinsic rate of population increase(rm),number of clutches per female,total offspring per female,generation time(T),net reproductive rate(R0),and survival time with the increasing azadirachtin concentration.There was no significant difference in the rmin the water fleas between the control group and low concentration groups(0.432,0.768 and 1.120 μg/L)(P>0.05).The rmwas decreased from 0.347 6 d-1at insecticide concentration of 1.340 to 0.306 3 d-1at insecticide concentration of 2.400 μg/L.The minimal number of clutches per female(2.47 times)and total offspring per female(26.87 ind.),the minimal survival time(13.60 d),the minimal R0(24.696 1),and T(11.439 9 d)were observed at the maximal concentration of 2.400 μg/L.In conclusion,the findings show that high concentrations of azadirachtin leads to short survival time,and T,and to reduce in R0number of clutches per female and total offspring per female significantly.
azadirachtin;Daphnia magna;toxicity;intrinsic rate of population increase;survival;reproduction
Q959.223
A
2095-1388(2013)02-0121-06
2013-02-28
国家大宗淡水鱼类产业技术体系项目 (CAR-46-26)
刘青 (1966-),女,副教授。E-mail:liuqing@dlou.edu.cn
