地面模拟失重实验方法概况
2013-02-05董丽王琼刘新民杨思进
董丽,王琼,刘新民,杨思进
(1.泸州医学院,四川 泸州 646000;2.中国医学科学院 北京协和医学院 药用植物研究所,北京 100193;3.中国航天员科研训练中心,北京 100094)
在航天飞行中,失重可导致骨骼肌肉运动系统、心血管系统及神经内分泌免疫等系统功能的改变[1],表现出一系列的生理效应:如血液头向分布、心血管系统和支持系统去载荷、重力的感受器刺激缺乏等,对由此而产生的航天飞行综合征的发生机制及对抗措施是亟待解决的航天医学难点问题。受科学技术、经费等限制,航天飞行难以长期、重复进行,地面模拟失重的实验方法的建立就显得尤为重要,但是地面模拟并不能创造真实的失重环境,只能用人体实验和动物实验模拟失重对机体所产生的部分生理效应加以模拟,故本文对地面模拟失重实验方法作综述报道,以期为地面模拟失重条件下相关发生机制及防护措施提供实验参考。
1 人体实验
人体实验是最早的地面模拟失重的实验方法,起初为人体浸水实验[2,3]—苏联科学家发明的干浸水(dry immersion)实验[4]。在特制的水槽中进行,水槽温度控制在33 ~34℃,含盐量1% ~2%,被试者或坐或卧的浮在水面,利用水的浮力和静压强模拟航天失重状态下流体静压力消失的生理学效应,如体液再分配、立位性低血压、肌肉活动减少、代谢紊乱等,但因被试者处于“负压呼吸状态”,自由活动受到限制(这种被迫性低动态在失重条件下是不存在的),不能进行各种功能的负荷试验,限制了干浸水实验的长期进行。随着实验方法的改进,王金华[5]参考国外的报道,则采用了一种新的方法—着服浸水法,类似于“干浸水法”的失重模拟原理,除了允许被试者活动,可以使支撑-运动减荷,造成前庭运动障碍,还能评估在水平姿势和垂直姿势下体液的再分布情况,评定皮肤和肾在维持机体的水、电解质平衡中各自的作用,为进行空间运动病和体液再分布相关的研究深度和广度创造了新的可能性,但也受到皮肤不耐受,不能进行长期实验以及实验操作技术不成熟等因素限制。
随后还相继建立了多种模拟方法[6],如卧床(bed rest)、座椅休息(chair rest)、抗G 服(anti-G suit,向飞行员腹部和下肢加压以提高抗正过载能力的个体防护装备,又称抗荷裤)、禁锢(immobilization)等。其中,平卧或头低位卧床[7](head-down tilt,HDT)实验是国内外应用最为广泛的。要求被试者平卧或头低位卧床,这样体内血液流体静压力部分或全部消失,与失重状态生理效应相似。与浸水人体实验相比,避免了浸水的实验环境,受试者容易配合和接受,实验条件相对成熟,实验因素也更容易控制,但实验中发现,卧床实验身体重量只存在作用方向的改变,对前庭系统的改变无法进行研究,且肺循环在胸-背部向流体静压梯度大幅度升高,这是与真正的失重环境存在差异的。
失重环境可导致流体静压消失,体液头向转移,约有1.5 ~2 L 的血液从下肢转移到上半身,其中约有20%汇集到头部,引起脑循环的改变[8]。那么,平卧或头低位卧床并非真正的失重,只是对失重状态下血液系统发生的血液头向分布的生理效应加以模拟。为了寻求更真实的模拟失重时的血液动力学的改变,对平卧或头低位卧床的角度,进行了比较研究。1970年苏联学者首次采用头低位-4°头低位卧床后,又进行了0°、-4°、-8°、-12°头低位卧床生理反应的比较研究,还多次进行了0°、-6°卧床结果的比较,结果表明-6°头低位卧床能更好地模拟失重环境下血流动力学和脑循环方面的改变[9-12]。Satake 等[13]利用单光子发射计算机断层摄影(SPECT)、Kawai 等[14]利用TCD 证实了-6°头低位卧床实验中脑血流循环改变与失重环境相类似,顾正章等[15]在30 d 的-6°头低位模拟微重力卧床实验中发现,受试者双侧丘脑、枕叶及右侧顶下小叶的灰质密度减少,而这可能与脑血流与灌注的变化有关。通过大量的实验表明,-6°头低位卧床引起的多个系统(包括循环系统、内分泌系统、神经系统等)和器官(如心脏、大脑、骨骼肌肉等)的生理病理反应,与微重力导致的影响相似。因此,此方法简单、易行,是目前应用最为广泛的人模拟失重效应的方法。
2 动物实验
在航天医学问题的研究中,实验动物作为研究材料最先进入太空。在地面模拟失重的研究中,实验动物得到了更为广泛的应用。在动物实验中,起初是采用全身或局部限动的方法模拟失重状态下的低活动度,逐渐发展到采用头低位的方法模拟失重环境下的血液头向分布生理学效应,而后者更为科学。根据物种的不同,具体的实验方法也不同。
2.1 大鼠
大量研究结果表明,大鼠的心血管、骨骼肌肉等系统的变化与太空失重下有许多相似之处,并积累了大量的资料,因此,大鼠是地面模拟失重实验中最常用的动物。
大鼠的限动方法有贴身笼具法(tight-fitted cage)、背部悬吊法和尾部悬吊法(partial body support system)。如前苏联研究者Meyerson 和Markova采用贴身笼具以全身禁动的方法,但大鼠处于全身禁动状态,其健康所需的基本活动也受到了限制,因此,美国国家航空航天局与重力生物学会联合发展了头低位悬吊的方法:即大鼠穿着马甲、取头低位背部悬吊,前肢着地支持部分躯体重量,后肢离地不荷重,并使其在一定范围内自由活动不受限制。但因固定不方便,马甲不易合体,引起的不舒服和皮肤损伤等应激,限制了背部悬吊法的应用。19 世纪80年代,Morey-Holton 等率先建立了尾部悬吊的方法,1993年经陈杰等[16]进一步完善(见图1),使尾部悬吊法简单易行,操作性强,最重要的是将引起大鼠应激反应损伤降低到最低程度,是目前应用最为广泛的动物模拟失重效应模型。
尾吊大鼠模型角度的选择因不同的实验方案而不同。在模拟失重血液头向分布研究中,身体轴与地面成30°被广泛公认。这一角度由Morey-Holton等[17]研究提出,保证头低位30°时,后肢离地不再负重,而由前肢承受躯体的部分重量(恰好为50%的体重)。陈杰[16]在30°尾吊大鼠实验中观察发现,最初几天动物头、面及颈部肿胀,眼结膜充血、眼眶周围水肿,表明体液发生明显的头向转移;沈羡云等[18]发现尾吊大鼠在30 d 模拟失重后出现了明显的血液流变性降低和红细胞变形能力下降,这与失重环境下血液瘀滞颅脑的“瘀血证”[19,20]相似。因此,30°是比较公认的,能够保证大鼠尾吊模型达到模拟航天失重飞行血液头向分布的最佳效果。但如果考虑大鼠不同姿态下所受载荷时,孙联文[21]发现30°这一角度并非是最为合适的,实验研究显示:自由活动大鼠在站立与休息状态下,前肢承重分别为体重的44.6%与23.9%。由于尾吊大鼠前肢承重与角度呈线性关系,若要使尾吊大鼠前肢承重占体重比例与自由活动大鼠站立与休息的状态相当,经计算,则尾吊角度应分别约为35°与63°。因此,基于大鼠前肢承重量的多少、尾吊持续时间的长短等因素,尾吊角度并不一致,至于如何选择,则需要深入研究、综合考虑,避免尾吊角度过大所致的应激反应。

图1 大鼠尾部悬吊法示意图Fig.1 Diagram of a rats tail-suspended experiment
2.2 兔
兔作为模拟失重动物,最先也是放入贴身笼具中,全身处于禁动状态,受到实验操作不方便、卫生难以及时清理等限制,目前多采用局部肢体限动的实验方法。因模拟方法不一样,结果存在差异。蒋程等[22]比较笼具头低位-20°、笼具头低位0°、全身悬吊头低位-20° 7 d(见图4)对家兔血液流变性的影响,实验结果表明:笼具-20°和笼具0°这两组家兔的血液粘滞度显著增高,以笼具-20°组较为明显,而全身悬吊-20°组家兔的血液粘滞度变化较小,至悬吊第7 天,血液粘滞度反而有所降低,表明不同的模拟失重方法所引起的家兔血液流变性的变化是不同的。同时,肌电分析表明,在3 种模拟失重方法中,笼具-20°状态的肌电波幅是最高的,笼具0°次之,全身悬吊-20°最低,可见因实验角度的不同,产生的肌肉负荷以及全身应激水平也是不一致的。

图2 笼具头低位-20°Fig.2 Cage head down -20
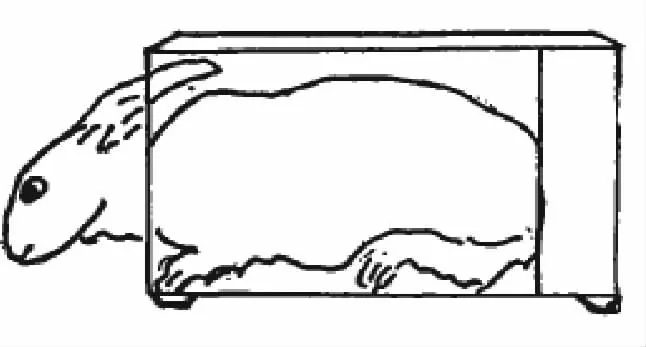
图3 笼具头低位0°Fig.3 Cage head down 0

图4 全身悬吊头低位-20°Fig.4 Body-tail hanging head down -20°
2.3 豚鼠
因豚鼠体积小,尾巴短小,用大鼠尾部悬吊的方法进行实验研究是不可取的,但因豚鼠具有耳壳比例比较大,因此是听觉器官研究中最常用的实验动物。韩浩伦等[23]发现豚鼠后肢结构的特点,膝部关节较大,皮肤和皮下组织活动灵活,用薄层棉片包裹豚鼠后肢踝部关节以上部位,再用胶布围绕棉片缠绕数圈,保证30°的头低位角度。所以,在模拟失重实验中涉及前庭器官、听觉等研究方案时,豚鼠则是首选动物。
2.4 犬、猴类
多用铸模固定法、座椅法减少流体静压对心血管系统的影响和肌肉-骨骼系统的载荷。但因犬、猴类体积较大,性情比较暴躁,铸模固定法、座椅法不舒服,不适合长时间的实验,实验费用高、实验重复性低等缺点限制,它们并非最常用的实验动物,国内报道文献亦少。
3 其他
在地面还可以采用多种方式模拟失重环境或失重生物效应,探索失重效应的生理病理发生机制。如回转器,利用持续的回转作用,使不同矢量方向的重力作用相互抵消,以致各个方向的矢量和为零,从而对失重的生物效应加以模拟和研究;再如利用超导磁体产生的强磁场(磁悬浮)模拟失重环境,保证长时间、稳定的失重环境,是目前地面上唯一能够实现较长失重时间(如晶体生长)的模拟技术,但受到技术难度高,研究费用昂贵等限制。
4 地面模拟失重的评判标准
地面处在大气重力环境,目前不可能实现对失重环境的真正模拟,只能基于某种机制或技术手段,对失重状态下产生的某些生理效应加以模拟。如头低位卧床或动物实验常用的动物尾吊,采用不同的模拟方法,加以模拟失重状态下血液头向分布的特点,从而探讨因血液重新分布,瘀滞在颅脑,引起的神经系统改变(认知、学习记忆、空间辨识等功能障碍)。因此,可以理解为,目前没有唯一的指标对失重成功与否进行判定,但是可以根据失重模拟状态下的生理效应加以反推,如心血管系统功能失调、失重性骨质疏松、免疫功能紊乱等,如何科学、规范、统一地评判失重状态地面模拟的成功与否,亟待更加深入的研究和验证。
5 结语
航天飞行中因失重引起的航天飞行综合征以及对抗措施是目前载人航天医学领域关注的重要课题之一。在地面模拟失重实验中,人体实验与动物实验相比较,人体实验是最早、最直接,方法相对简单,受试者容易配合及接受,可长期进行的实验,能更真实地模拟飞行员在航天飞行失重环境中的生理学效应。但是,人体实验不能进行有创的监测手段,从而限制对其进行更深入的生理病理机理研究,而动物实验的开展正好弥补了人体实验的这一缺陷。动物实验可从不同的研究角度制定不同的研究方案,从细胞、分子等微观水平,揭示失重生理病理发生机制。然而动物毕竟与人类属于不同的种属,有着最本质的区别。因此,利用四肢行走、身体尺寸较小的动物进行实验,结果只能是间接的,不能随意地将结果外延运用到人类,但两者可以相互佐证,使实验研究更为深入、科学。
在模拟失重的实验动物中,大鼠因其自身特质,且体积相对小,实验易操作,因此应用最为普遍,实验资料相对丰富,可以根据不同的研究方案,选择不同的尾吊角度,但是悬尾方法不当,引起的应激反应也大;家兔应用次之,目前多集中血液系统、耳、脑、球结膜微循环改变的观察,特别是失重下血瘀证模型的建立,是研究中医药对血瘀证影响的首选实验动物;豚鼠尾巴短小,限制了悬尾方法的应用,但因其耳壳较大,是听觉器官研究最常用的动物,也是失重研究前庭器官改变、听力改变的首选。
综上,无论是人体实验,还是动物实验,都是为了更好地研究航天飞行中因失重引起的飞行综合征和空间运动病的生理病理机制。航天失重存在多重机制假说,引起的机体功能紊乱则是一个多层次、多系统的综合医学问题。要解决载人航天医学问题,笔者认为,运用强调“整体观念”、“天人合一”、“辨证论治”的中医学理论,引入具备综合、整体调节优势和特点的中药复方或单体来应对航天失重条件下引起的机体的复杂多系统变化将是今后的研究趋势。
[1]沈羡云,王林杰.我国失重生理学研究进展[J].航天医学与医学工程,2008,21(3):182 -187.
[2]Epstein M.Renal effects of head-out water immersion in humans:a 15-year update[J].Physiol Rev.1992,72(3):563 -621.
[3]Greenleaf JE.Physiological responses to prolonged bed rest and fluid immersion in man.J Appl Physiol.1984,57(3):619 -633.
[4]张立藩,孟庆军.展望新世纪的重力生理学[J].生理科学进展,2002,33(3):276 -284.
[5]王金华.模拟失重对人体作用的新方法[J].航天医学与医学工程,1989,2(1):67 -68.
[6]Nicogossian AE,Mohler SR,Grigoriev AI,et al.Space biology and medicine[M].American Institute of Aeronautics and Astronautics,2009:454 -469.
[7]阎晓霞.长期失重的地面模拟—卧床及其生理研究[J].生物化学及生物物理进展,1990,17(3):181 -184.
[8]吴大蔚,沈羡云.失重或模拟失重时脑循环的改变[J].航天医学与医学工程,2000,13(5):386 -390.
[9]Savina EA.Antiorthostatic hypokinesia in monkey (experimental morphological study)[J].Physiologist,1983,26(6):S76.
[10]沈羡云,兰景全,向求鲁,等.模拟失重时兔脑微循环的变化[J].航天医学与医学工程,1989,2(2):89 -93.
[11]毛秦雯,张立藩,张乐宁.模拟失重大鼠不同部位动脉血管壁超微结构的变化[J].航天医学与医学工程,1999,12(4):249 -253.
[12]Hargens AR.Recent bed rest results and countermeasure development at NASA[J].Acta Physiol Scand Suppl.1994,616:103 -114.
[13]Satake H,Konishi T,Kawashima T,et al.Intracranial blood flow measured with single photon emission computer tomography(SPECT)during transient -6° head-down tilt[J].Avia Space Environ Med,1994,65(1):117 -122.
[14]Kawai Y,Murthy G,Watenpaugh DE,et al.Cerebral blood flow velocity increases with acute head-down tilt of humans [J].Physiologist,1992,35(1 suppl):s186 -187.
[15]顾正章,金真,曾亚伟,等.30 d 头低位卧床对人脑灰质密度的影响[J].航天医学与医学工程,2012,25(2):138 -140.
[16]陈杰,马进,丁兆平,等.一种模拟长期失重影响的大鼠尾部悬吊模型[J].空间科学学报,1993,13(2):159 -162.
[17]Morey-Holton ER,Globus RK.Hindlimb unloading of growing rats:a model for predicting skeletal changes during space flight[J].Bone,1998,22(5 suppl):83S-85S.
[18]沈羡云,崔伟.马永烈,等.30d 尾吊大鼠血循环、肌肉和骨骼系统的变化[J].航天医学与医学工程,1999,12(4):277-280.
[19]沈羡云,向求鲁,孟京瑞.4 小时头低位卧床期间脑阻抗图的变化[J].中国空间科学技术,1992,2(3):66 -71.
[20]Loeppky JA,Hirshfield DW,Eldridge MW.The effect of headdown tilt on carotid blood flow and pulmonary gas exchange[J].Aviat Space Enviro Med,1987,58(7):637 -644.
[21]孙联文,杨肖,谢添,等.尾吊模型中大鼠的前肢承重分布[J].医用生物力学,2009,S1,29.
[22]蒋程,王连贵,沈羡云,等.三种模拟失重方法对家兔血液流变性影响的初步观察[J].航天医学与医学工程,1990,3(2):91 -95.
[23]韩浩伦,吴玮,薄少军,等.豚鼠模拟失重的实验设计与应用[J].总装备部医学学报,2011,13(2):107 -108.
