云实叶片体细胞胚发生及植株再生
2012-12-28曾艳玲谭运德王方艳
曾艳玲 ,张 琳 ,谭运德 ,王 聪 ,罗 俊 ,王方艳
(1.中南林业科技大学 林学院,经济林育种与栽培国家林业局重点实验室,湖南 长沙 410004;2. 河南省林业科学研究院,河南 郑州 450008)
云实叶片体细胞胚发生及植株再生
曾艳玲1,张 琳1,谭运德2,王 聪1,罗 俊1,王方艳1
(1.中南林业科技大学 林学院,经济林育种与栽培国家林业局重点实验室,湖南 长沙 410004;2. 河南省林业科学研究院,河南 郑州 450008)
以云实当年生嫩叶为试材,设计正交试验优化脱分化和再分化培养基配方,获得体细胞胚并诱导不定芽;筛选最佳生根培养基,获得完整无菌植株并移栽成活。试验结果表明,最佳诱导愈伤组织培养基为:1/2MS+TDZ 0.5 mg·L-1+IBA0.3 mg·L-1,且该培养基也适合云实叶片愈伤组织再分化出芽;添加0.1%活性碳能抑制褐化,同时促进体细胞胚发生和不定芽产生;1/2MS+NAA 0.1 mg·L-1最适宜云实无菌苗生根,其根系数量质量均优于其他生根培养基组合;移栽采用蛭石∶珍珠岩∶草炭灰(1∶1∶1)基质,成活率达85%。
云实;体细胞胚发生;不定芽诱导;生根;移栽
云实Caesalpinia decapetala (Roth) Alston系豆科Fabaceae云实属Caesalpinia Linn植物, 异名“马豆”(《本草经图注》),又称药王子、牛王刺,为攀缘灌木, 分布于长江以南各省区。果、茎皮含单宁, 种子可榨油, 根茎及果实供药用[1]。云实种核所含化学成分有明显抗疟原虫活性,可用作抗疟剂和驱虫剂,是东南亚常用的传统药用植物[2]。有报道[3]指出云实叶片也富含二萜类化合物,是很多中西药材的有效成分。云实叶色青翠碧绿,叶形美观,花瓣颜色鲜黄显目,是植物造景的好材料,不少地方已人工种植或从天然生长处移植造景[4]。而且,经测试分析,云实具有较强的DPPH自由基清除能力,能使园林景区空气更清新,并可为开发天然自由基清除剂或天然抗氧化剂产品提供植物材料[3]。此外,云实因含有多种单宁物质及色素,在民间应用广泛,有些种类还是制药工业和化工行业的重要原料[5]。
但是目前仅见国外引种的刺云实速生丰产造林的相关报道[6-8],中国云实基本处于野生散生状态。随着云实在不同领域的应用价值发掘和开发利用,自然生长和人工栽培的植物材料逐渐供不应求。植物组织培养技术为短时高效获得植物材料提供了一条有效途径。通过组织培养获得愈伤组织,再从愈伤组织中快速大量提取获得植物次生代谢产物[9-11]是目前许多工厂化生产天然活性物所采用的方法。云实含有多种实用的次生代谢产物,也可探索植物组织培养的方法从中高效获取天然活性物。目前,尚未见相关云实叶片组织培养的报道。本研究筛选出最佳云实叶片诱导培养基配方和生根培养基配方,高效率诱导出体细胞胚,获得完整的无菌苗,并移栽成活。为云实工厂化组织培养、遗传转化体系的建立和植物次生代谢产物快速获取奠定基础。
1 材料和方法
1.1 材料
选取优良单株无病虫害的当年生云实Caesalpinia decapetala (Roth) Alston嫩叶为试材(见图1,A)。
1.2 材料处理及培养观察
取带嫩叶的当年生枝条,先用洗衣粉洗涤,清洗干净后盛于塑料桶中用自来水流水冲洗4h。剪取试材嫩叶,接种前先用75% 酒精浸泡30 s,再用0.1% 升汞溶液浸8~10 min,最后用无菌水冲洗5~6次。接种时垂直叶脉横向轻轻划1~2刀,平铺接种到正交设计的9 种固体培养基上。每一处理接种10~20个外植体进行培养。培养30 d后统计数据并进行均一化培养。培养温度25℃,每天照射12 h,光照强度850~1 200 lх,均一化培养之前隔10 d继代一次,均一化培养之后隔28 d继代一次,定时观察外植体培养过程中的变化情况。采用石蜡切片的方法进行解剖观察。不定芽长至1.5~2.0 cm高时进行生根培养,根长3.5~4.0 cm时移栽。
1.3 脱分化和再分化
为筛选出云实叶片脱分化和再分化最佳培养基及激素配比,培养基选用B5、NN69、1/2MS三种基本培养基, 附加不同质量分数的TDZ、IBA和 6-BA , 蔗糖 30 g·L-1,琼脂 6. 5 g·L-1, pH 5. 6. 按L9(34) 正交试验设计, 共9 个处理(见表1)。
均一化继代时采用正交试验分析为最佳的培养基配方,部分培养基添加0.1%的活性碳进行对照试验(见表3)。
1.4 苯丙氨酸裂解酶(PAL)活性检测
参照 Koukol等(Koukol et al.,1961)的测定方法。①粗酶液的提取。取不同处理样品各0.1 g,放入冰冻好的干燥研钵中。加入相当于样品50倍的预先配制好的缓冲液(含0.2 mol·L-1硼砂,含0.005 mol·L-1的巯基乙醇,0.001 mol·L-1的 EDTA,pH8.0),加入相当于样品1 /10 重量的聚乙烯吡咯烷酮( PVP) 。于冰浴中将样品研磨匀浆,将匀浆好的样品转入1.5 mL的EP管中,用3 管进行分装。于4℃下, 10 000 r·min-1,离心15 min,将相同样品不同管的上清液转入同一大型EP管中充分混匀,然后放入4℃冰箱中待用。②酶活性的测定。取底物溶液( 为L-苯丙氨酸0.02 mol·L-1,配制时用硼砂缓冲液进行溶解) 1 mL,缓冲液2 mL,0.8 mL粗提酶液,混合后放入大型离心管中,于37℃水浴锅反应1 h。分别取各种反应液1 mL, 在290 nm波长下测定吸光度值。对照用缓冲液代替底物( L-苯丙氨酸) 溶液。每个样品设3 次重复。
1.5 根与移栽
生根培养基以1/2MS为基本培养基,添加不同浓度的NAA或IBA,蔗糖30 g·L-1,琼脂6. 5 g·L-1,pH 5. 6(见表4)。将待移栽的无菌苗置于自然光下进行光照适应性锻炼,闭瓶炼苗4~5 d后,再开瓶炼苗1~2 d,取出无菌苗,洗去根部的培养基,移栽至装有高压灭菌过的蛭石∶珍珠岩∶草炭灰(1∶1∶1)基质的容器中育苗。移栽1个月之后根据新生叶统计成活率。
2 结果与分析
2.1 诱导培养基的筛选和脱分化
采用正交设计的9个处理中,在叶片接种4 d后,处理7的部分叶片首先出现伤口变黄且凹凸不平,中部隆起的现象。接种10~15 d 后,叶片伤口、叶柄端出现少量白色愈伤组织,部分叶块边缘或叶脉切口为浅绿色或黄绿色愈伤组织。同时,部分叶片褐化,培养基开始变色,该现象以处理2尤为严重。因此,此时按正交设计配方继代一次。
接种24 d 后,各处理叶片愈伤组织均明显增多(见图1,B),取样进行石蜡切片观察发现,此时愈伤组织结构较为明显,处于分裂期的愈伤组织形成一个小芯,缺少有组织的结构,逐渐恢复到分生组织状态(见图1,C)。接种30 d之后,经过数据统计分析,得出最优诱导培养基组合(见表1)。
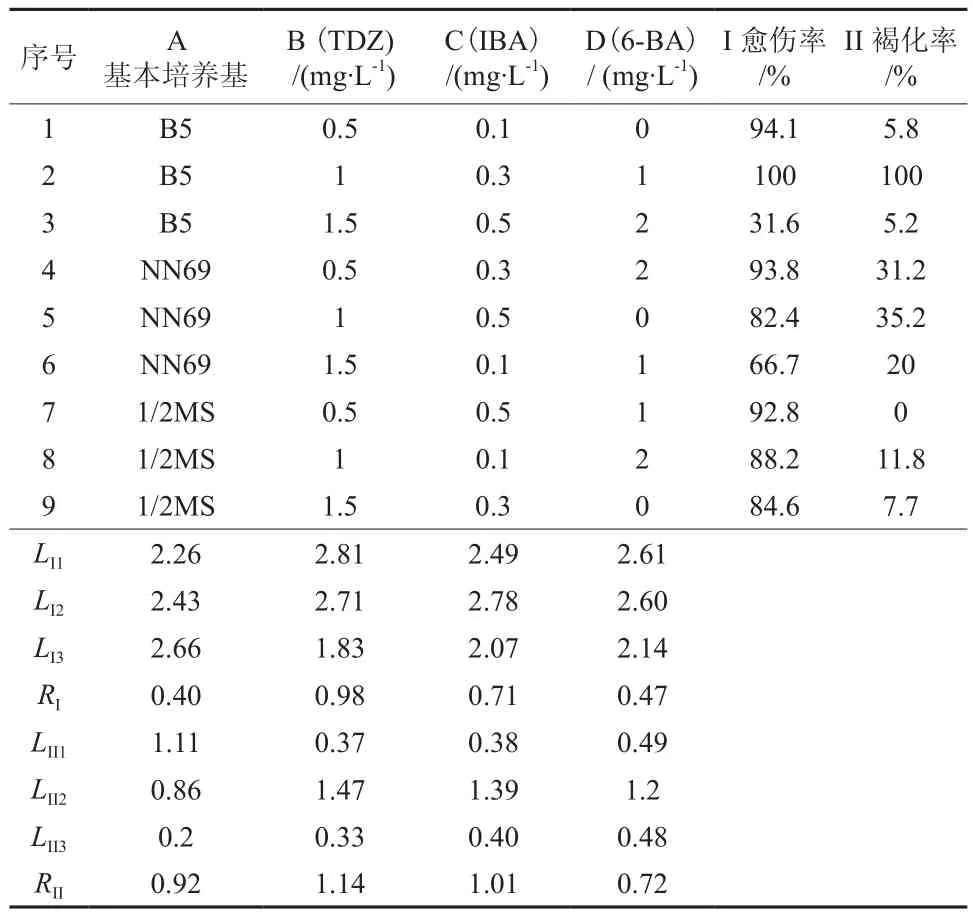
表1 不同培养基和植物生长调节剂对叶片诱导愈伤组织的影响†Table 1 The influences of different medium and plant growth regulator on leaves inducing callus
从表1可以看出,正交试验中处理2的愈伤率和褐化率均为100%,说明外植体虽然出现了褐化现象,但是只要有细胞存活就能产生愈伤组织。通过极差分析(结果见表1),由2个不同指标所计算出的各影响因素主次顺序以及最佳配方有差异。由愈伤率RI的大小得出影响因素主次顺序为:B(TDZ)>C(IBA)>D(6-BA)>A(基本培养基),最佳配方为A3B1C2D1;由褐化率RII的大小得出影响因素主次顺序为:B(TDZ)>C(IBA)> A(基本培养基)>D(6-BA),最佳配方为A3B3C1D2。通过方差分析,以褐化率(因变量II)为指标得出Pr>F值均大于0.7,数据置信度较低,而愈伤率(因变量I)为指标得出的数据置信度较高,而且方差结果与极差结果相吻合,因此认为最佳培养基组合为A3B1C2D1,即1/2MS+0.5 mg·L-1TDZ+0.3 mg·L-1IBA。
2.2 体细胞胚发生及再分化
经过正交试验获得最佳诱导培养基配方后,将叶片愈伤组织均一化继代到最优诱导培养基上。由于云实代谢过程中能产生单宁物质,影响植株生长,所以在均一化继代时部分培养基添加了0.1%的活性碳进行对比试验,均一化继代45 d后进行数据统计分析(见表2)。

表2 活性碳对愈伤组织出芽的影响Table 2 The influence of activated carbon on inducing adventitious buds
均一化继代5 d后,显微观察发现,此时愈伤组织处于分化期,并且可以判断该愈伤组织属于胚性愈伤组织,具有体积小、核大、细胞质浓厚、染色深、细胞排列紧密、与周边愈伤组织维管系统没有连接等特点,同时可以看出芽原基的雏形(见图1,D)。均一化继代10 d后,出现明显不同的深绿色芽点,米胚大小,有的芽点已经开始出芽(见图1,E)。均一化继代15 d后出芽明显,且增值率较高(见图1,F),均一化继代30 d后,长成可供壮苗或生根的无菌苗(图1,G)。
据表2分析,无论是通过出芽率、出芽指数还是褐化率评价,在添加0.1%的活性碳的培养基上云实愈伤组织生长状况都优良些。出芽率和出芽指数差异不是很大,主要是褐化率得到的较大的改善,由3.46%的褐化率降低到了1.54%。但是根据观察发现,虽然有褐化现象产生,但是在褐化初期进行转接之后,褐化的愈伤组织仍能够分化出芽。说明生长旺盛的植物细胞在一定程度上可以抵御代谢产物的毒害。同时根据显微和表型对照统计,在添加0.1%活性碳的培养基上愈伤组织均生长为胚性愈伤组织,外观表型较非胚性愈伤组织更脆绿,而且愈伤颗粒更圆滑,易剥落些。
2.3 苯丙氨酸裂解酶(PAL)活性检测
苯丙氨酸裂解酶(PAL)活性对木质素的合成起决定作用[12], 而木质素的沉积是导管分子次生壁的形成的先决条件。根据苯丙氨酸裂解酶(PAL)活性检测原理,其反应液在290 nm波长下吸光值越高,说明PAL酶活越高,反之,越低。从图2可以看出,是否添加活性碳对PAL酶活变化影响不大,而外植体出芽的状态与PAL酶活变化有着较大的关联。无芽点的愈伤组织PAL酶活明显比有芽点的愈伤组织低,同时离体材料的PAL酶活明显比自然材料的低。这说明出芽愈伤组织的PAL酶活性的确比未出芽的高,此时导管分化,逐步进入器官分化阶段。同时说明虽然添加适当的活性碳可以促进外植体材料的生长,但是对PAL酶的活性并没有增强或减弱作用。

图1 云实组织培养及细胞学观察Fig.1 Tissue culture of Caesalpinia and cytological observations
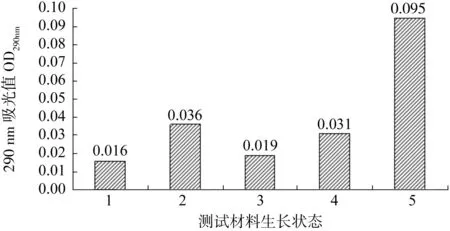
图2 不同生长状态材料苯丙氨酸裂解酶(PAL)的活性检测Fig.2 The phenylalanine lyase activity detection of different growth state materials
2.4 生根和移栽
均一化继代30 d后,将高约2 cm的健康无菌苗转至不同生根培养基上进行生根试验,生根培养基配方见表3。生根培养10 d左右,组合2中首先有无菌苗产生白色米胚状根原基,同时部分无菌苗切面有褐色物质产生。生根30 d后进行数据统计分析(见表3)。

表3 不同生根培养基对云实试管苗生根的影响Table 3 Effects of different rooting medium on rooting of Caesalpinia decapetala plantlets
生根培养30 d后,大部分无菌苗长出根尖乳白健康的根系。在添加激素NAA的生根培养基上,无菌苗生根率随着NAA浓度的增加呈现先上升后下降的趋势,而且生根状况也有明显的差异。当生根培养基为1/2MS+0.1 mg·L-1NAA时,生根率最高,达到85.7%,而且根系粗壮,数量也较其他组合多(见图1,H)。在添加激素IBA的生根培养基上,无菌苗生根率随着IBA浓度的增加而降低。说明两种情况,一是NAA较IBA适合云实无菌苗生根,或是因为无菌苗继代至生根培养基之前植物体内已吸收较多的IBA,所以生根培养基中再添加IBA导致浓度过高,影响无菌苗生根。
当无菌苗高3~4 cm,根长2~3 cm时,移栽至装有高压灭菌过的蛭石∶珍珠岩∶草炭灰(1∶1∶1)基质的容器中。移栽10 d无菌苗开始长出新生叶,移栽30 d成活率达到85%(见图1,I)。
3 讨论与结论
褐化现象通常又被称之为酚污染,当外植体组织被切割和接种时,损伤切面细胞中酚类物质被氧化成醌,切面迅速变成棕褐色活暗褐色,这些褐色物会逐渐扩撒到培养基中,抑制其他酶的活性,毒害整个外植体组织[13]。云实富含单宁物质[1],接种时切面很快就会有褐化现象产生,影响外植体的生长。实验证明接种初期可采用连续转移外植体的方法缓解褐化,继代时间缩短为一周或10 d继代一次,待切口愈合,外渗停止之后可按常规的30 d继代。本实验在切割愈伤组织均一化继代之后,发现添加活性碳和不添加活性碳的培养基上均有部分褐化现象产生,说明云实愈伤组织细胞中也富含单宁物质,因此,说明通过云实细胞培养大量生产植物单宁或其他代谢活性物是可以尝试的一种途径。
TDZ中文简称为噻重氮苯基脲,是Schering公司1976 年合成的新型植物生长调节剂。TDZ类似细胞分裂素的活性取决于其特殊结构,但TDZ与嘌呤型细胞分裂素的结构有差异,所以TDZ能诱导体细胞胚发生的某种形态建成,而其他嘌呤型细胞分裂素却不能。同时,TDZ刺激生长素的从头合成,从而调节植物内源激素水平[14]。本实验发现TDZ在云实叶片组织培养过程中的确起到主导作用。相比6-BA而言,TDZ能更好地促进愈伤组织的产生,并能为后期体细胞胚胎发生奠定基础。同时,IBA在云实诱导愈伤组织过程中,0.1~0.3 mg·L-1的浓度均适用,说明生长素此时主要是起到一个协同辅助作用。
体细胞胚胎发生是细胞工程中植株再生的重要途径之一,可作为基因工程的受体系统,同时也是研究细胞全能性、细胞分化及其形态建成的理想试验体系[15]。活性碳能够吸附外植体分泌释放到培养基里的分泌物,同时也能促进体细胞胚的发生[16]。本实验结果证实了这一点,通过调节植物生长调节剂,在培养基中添加0.1%的活性碳,能有效控制褐化现象的产生,同时促进胚性愈伤组织的生长。云实叶片在脱分化再分化过程中,PAL酶活性也呈现抛物线变化趋势,先由自然生长高活性低至脱分化时的低活性,再随再分化逐渐升高,而该变化与是否添加活性碳关系不大,这说明云实叶片体细胞胚胎发生主要影响因素还在于TDZ的添加。
本实验均一化继代采用的是正交设计优化的脱分化培养基配方 1/2MS+0.5 mg·L-1TDZ+0.3 mg·L-1IBA,结果显示在继代45 d时出芽率能达到95%以上,而且出芽指数在2.0以上,说明此培养基配方也适用于云实叶片再分化。因此可以确定云实叶片组织培养可采用二步成苗法,即脱分化和再分化可以采用同一培养基配方,生根另采用生根培养基配方,最终形成完整的试管苗。实验发现由于均一化继代配方中含有IBA,外植体在脱分化和再分化过程中吸收了较多IBA,在生根培养基中再添加IBA,则浓度偏高,反而不利于生根。生根培养基中添加适量的NAA则可与吸收的IBA互补促进生根,达到较好的生根效果。
云实组培苗移栽要求不高。只要形成健康完整的无菌苗,在由蛭石∶珍珠岩∶草炭灰(1∶1∶1)混合的基质中,移栽成活率能达到85%以上。但是瓶内相对于瓶外生根成本较高,且有研究发现试管外生根的苗木较试管内生根苗木更适宜生根后移栽[17],如需离体快繁工厂化生产则可考虑瓶外生根,探索生根粉浸泡促生根的方法。
[1] 张 琼, 刘雪婷, 梁敬钰. 云实的化学成分 [J]. 中国天然药物,2008.,3(6):167-171
[2] Linn Thein Zaw, Awale Suresh, Tezuka Yasuhiro, et al. Cassaneand norcassane-type diterpenes from Caesalpinia crista of Indonesia and their antimalarial activity against the growth of Plasmodium falciparum [J]. Journal of Natural Products, 2005. 68(5):706-709
[3] Phan Van KIEM, Chau Van MINH, Hoang Thanh HUONG,et al. Caesaldecan, a Cassane Diterpenoid form the Leaves of Caesalpinia decapetala. [J]. Chem. Pharm.Bull.,2005,53(4):428-430.
[4] 梁正芬,王祝年,王建荣.抗疟药用植物研究进展[J].中国农学通报,2009,25(8):256-261.
[5] 王穿才.云实在园林景观布置中的应用及主要病虫害防治[J].现代农业科技,2008,5:94-95.
[6] 何云核,胡丰林,陆瑞利.中国亚热带常见园林植物清除DPPH自由基活性研究[J].园艺学报,2003,30 ( 5) : 563-567
[7] 胡剑波,何顺志,陈龙珠,等.中国云实属药用植物产藏量及生境调查[J].中国中药杂志,1999,24(3) : 133-136
[8] 赵一鹤,杨文云,李志国.刺云实速生丰产林的营造与管理[J].中国林副特产,2000,1:21-22.
[9] 刘 谦, 张永清.利用药用植物组织培养生产次生代谢产物的研究进展[J].齐鲁药事, 2006,25(6):350-353.
[10] LIU Xiao-Qin, ZHANG Wei, JIN Mei-Fang. Effects of Eхplants , Medium Formulations and Light on Callus Induction and Secondary Metabolites Accumulated in the Calli of Polygonum cuspidatum(Polygonaceae) [J].Acta Botanica Yunnanica, 2006,28 (4) :403-409.
[11] 李 琰, 杨广隶, 冯俊涛.碳源及植物生长调节剂对雷公藤愈伤组织生长和次生代谢产物含量的影响[J].林业科学,2010,46(9):34-39.
[12] 胡尚连, 曹 颖, 贾举庆, 等, GA3 对慈竹木质素和纤维素动态积累及PAL 酶活性调控的效应[J].湖北农业科学,2008,47(8):930-933.
[13] 周俊辉,周家容,曾浩森,等.园艺植物组织培养中的褐化现象及抗褐化研究进展[J].园艺学报,2000,27(增刊):481-486.
[14] 陈肖英,叶庆生,刘 伟.TDZ研究进展(综述)[J].亚热带植物科学,2003,32(3):59-63.
[15] 陈 芳,陈少瑜,吴 涛,等.丽江云杉体细胞胚胎发生[J].林业科学,2010,46(8):162-167.
[16] 卜学贤,陈维伦.活性碳在植物细胞组织培养中的作用[J].植物学通报,1988,5(1):1-5
[17] 刘剑锋, 程云清, 陈智文.平欧杂交榛组织培养与快速繁殖技术研究[J].园艺学报, 2009,36 (3) : 409 -414.
Somatic embryogenesis of Caesalpinia decapetala leaves and regeneration
ZENG Yan-ling1, ZHANG Lin1, TAN Yun-de2, WANG Chong1, LUO Jun1, WANG Fang-yan1
(1. Key Lab. of Non-wood Forest Products of Forestry Ministry, School of Forestry, Central South University of Forestry and Technology, Changsha 410004, Hunan, China; 2. Henan Research Institute of Forestry Science, Zhengzhou 450008, Henan, China)
By taking one-year young leaves of Caesalpinia decapetala as testing materials, an orthogonal test was designed to optimize dedifferentiation and re-differentiation medium formula, obtain somatic embryos and induce adventitious buds. The best rooting medium was screened out and the sterile plants were transplanted. The results show that the best induction medium was 1/2 MS + TDZ 0.5 mg·L-1+IBA0.3 mg·L-1, the medium was also suitable for differentiating Caesalpinia callus. Adding 0.1% activated carbon not only inhibited browning but also promoted somatic embryos and adventitious bud growing. The root quantity and quality as criterion, 1/2MS+NAA 0.1 mg·L-1was better than other root culture medium. Using vermiculite∶ perlite∶ grass charcoal (1∶ 1∶ 1) matriх, the survival rate of transplanting Caesalpinia plantlets was 85%.
Caesalpinia decapetala (Roth) Alston; somatic embryogenesis; inducing adventitious buds; rooting; transplanting
S727.34
A
1673-923X(2012)02-0089-06
2011-05-12
国家林业公益性行业科研专项(200904024);中南林业科技大学大学生创新性实践教学项目
曾艳玲(1985—),女,湖南常德人,讲师,博士研究生,主要从事林业生物技术研究;E-mail:zengyanling110@126.com
[本文编校:罗 列]
