糙叶五加根皮化学成分研究
2012-12-26刘恒言金钟焕刘向前陆昌洙
刘恒言,金钟焕,刘向前*,陆昌洙
(1.湖南中医药大学药学院,湖南 长沙 410208;2.韩国食品医药品安全厅生药研究部,韩国 忠清北道 363-700;3.韩国庆熙大学药学院,韩国 首尔 130-701)
糙叶五加根皮化学成分研究
刘恒言1,金钟焕2,刘向前1*,陆昌洙3
(1.湖南中医药大学药学院,湖南 长沙 410208;2.韩国食品医药品安全厅生药研究部,韩国 忠清北道 363-700;3.韩国庆熙大学药学院,韩国 首尔 130-701)
目的 基于抗炎活性研究糙叶五加根皮的化学成分。方法 采用XAD-4、正相硅胶、ODS、Sephadex LH-20等常规柱色谱技术结合实时直接分析质谱技术(DART-MS)进行分离纯化,并根据其理化性质和波谱数据鉴定结构。结果 通过常规柱色谱从糙叶五加根皮中分离鉴定了7个化合物,分别为:豆甾醇(1)、β-谷甾醇(2)、海松酸(3)、(+)-芝麻素(4)、洒维宁(5)、丁香苷(6)和刺五加苷E(7);另外,通过实时直接分析质谱与标准图谱比较推测糙叶五加根皮中可能存在 taiwanin C、10-羟基-2,8-癸二烯-4,6-二炔酸、3,7,11-trimethyl-2,6,10-dodecatrienoic acid、咖啡酸和 stigmast-7-ene-3,6-diol。结论 化合物3,4,5,7为首次从该种植物中分离得到。
糙叶五加根皮;化学成分;结构鉴定;实时直接分析质谱
糙叶五加(Acanthopanax henryi(Oliv.)Harms)为五加科五加属植物,广泛分布于湖南、甘肃、四川等地。湖南省中药材地方标准收载的“五加皮”,就是以该植物的根皮入药,具有祛风湿、活血化瘀、壮筋骨等功效,主要用于治疗风湿痹痛、拘挛麻木、筋骨痞软、水肿、跌打损伤、疝气腹痛等症[1-2]。国内外学者对五加属植物的研究多集中在细柱五加、刺五加,并从中分离得到了许多具有良好抗炎、抗肿瘤、抗氧化活性的三萜类、黄酮类、木脂素类化合物[3-6]。而对糙叶五加中化学成分及活性研究报道较少,仅1994年张会昌等[7]在糙叶五加根皮中分离得到了紫丁香苷、紫丁香酚苷、紫丁香树脂醇、β-谷甾醇等成分。近年来陈勇等[8]建立了同时测定糙叶五加不同药用部位中槲皮素和山柰酚的方法;冯胜等[9]建立了同时测定糙叶五加不同部位中的刺五加苷B和刺五加苷E的方法。我们首次对糙叶五加根皮的甲醇提取物及其不同浓度甲醇洗脱部分进行了细胞毒试验和NO、PGE2、IL-1β、IL-6等抗炎因子的抗炎活性筛选试验,结果发现其具有良好的抗炎活性,活性研究结果将作另文报道。本论文报道基于抗炎活性导向下分离得到的化学成分。
1 仪器与材料
1.1 仪器
SGW X-4显微熔点仪(未校正,上海精密科学仪器有限公司);Autopol III自动偏振计 (美国鲁道夫公司);日立270-30红外分光光度计(日本日立公司);Bruker AMX-400超导核磁共振仪(TMS为内标,德国Bruker公司);Bruker AMX-500超导核磁共振仪(TMS为内标,德国Bruker公司);DART实时直接分析离子源 (日本东京);JMS-T100TD飞行时间质谱仪(日本电子株式会社)。
1.2 %材料
药材2008年采自于湖南省新化大熊山,经韩国庆熙大学药学院陆昌洙教授鉴定为五加科糙叶五加Acanthopanax henryi(Oliv.)Harm的根皮,标本存放于韩国庆熙大学药学院生药学实验室,标本号为KHUP-0714/A.henryi root barks/2008。 XAD-4(美国Sigma公司),正相柱层析硅胶 (230~400目,美国Merck公司);ODS(30~50μm,日本Fuji Silysia Chem.Ind.公司);Sephadex LH-20(美国Sigma公司)。氯仿、甲醇等试剂均为分析纯。
2 提取分离
糙叶五加根皮3 kg,阴干,粉碎过40目筛,甲醇回流提取3次,每次4 h,减压回收甲醇,浓缩得浸膏129 g。经XAD-4型树脂,依次用水、30%甲醇、50%甲醇、80%甲醇、100%甲醇、丙酮洗脱。收集50%甲醇洗脱部分,浓缩,经正相硅胶柱色谱分离,氯仿-甲醇-水(7∶3∶0.1)洗脱,纯化,得到化合物1(15mg)、化合物2 (19mg)、 化合物3 (25mg)、 化合物4(56mg)、化合物5(35mg)。收集100%甲醇和丙酮两个洗脱部分,浓缩,经正相硅胶柱色谱分离,正己烷-丙酮(100∶1→1∶5)梯度洗脱,得到Fr.A(6.7g)、Fr.B(1.2 g)、Fr.C(2.1 g)、Fr.D(0.5g)、Fr.E(2.5g),合 并 Fr.C、Fr.D 两个部分,经ODS、Sephadex LH-20反复分离纯化,得到化合物6(24mg)、化合物7(233mg)。
3 结构鉴定
化合物1:C29H48O,白色粉末,mp 170~172 ℃,Liebermann-Burchard反应和Salkowski反应呈阳性,1H-NMR(400 MHz,CD3OD) δ:5.40(1H,m,H-6),5.14(1H,dd,J=14.6,8.0 Hz,H-22),4.98(1H,dd,J=14.5,7.8 Hz,H-23),3.30(1H,m,H-3a),0.97(3H,s,H-19),0.9(3H,d,J=6.5 Hz,H-21),0.82(3H,d,J=6.2 Hz,H-26),0.82(3H,t,J=7.5 Hz,H-29),0.77(3H,d,J=6.0 Hz,H-27),0.65(3H,s,H-18)。13C-NMR(100 MHz,CD3OD)δ:142.2(C-5),140.0(C-22),130.6(C-23),122.4(C-6),72.4(C-3),58.2(C-14),57.4(C-17),52.2(C-24),49.4(C-9),43.0(C-4),41.9(C-13),41.1(C-20),41.0(C-12),38.5(C-1),37.4(C-10),35.1(C-25),33.2(C-2),33.2(C-7),32.3(C-8),29.3(C-16),27.1(C-28),23.1(C-15),21.7(C-21),21.6(C-26),21.1(C-11),19.8(C-19),19.3(C-27),12.6(C-29),12.3(C-18)。以上数据与参考文献一致[10],故鉴定为豆甾醇。
化合物2:C29H50O,白色粉末,mp139~141 ℃,Liebermann-Burchard反应和Salkowski反应呈阳性,EI-MS m/z:414[M]+,1H-NMR(400 MHz,CD3OD)δ:5.37(1H,d,J=4.97 Hz,H-6),3.51(1H,m,H-3),1.00(3H,s,H-19),0.92(3H,d,J=6.5 Hz,H-21),0.88(3H,d,J=1.86 Hz,H-29),0.85(3H,d,J=3.71 Hz,H-26),0.82(3H,s,H-27),0.70(3H,s,H-18)。以上数据与参考文献一致[10],故鉴定为β-谷甾醇。
化合物3:C20H30O2,白色针晶,mp 217~219 ℃,EI-MS m/z:302[M]+,257,234,167,135,123,121,68.IR(KBr)cm-1:3430,3040,2930,2850,1710,1460,1220,910,780.1H-NMR(500 MHz,CD3OD)δ:12.30(1H,s,H-18),5.65(1H,dd,J=17.5,10.5 Hz,H-15),5.15(1H,d,J=1.0 Hz,H-14),4.90(1H,dd,J=10.5,1.5 Hz,Ha-16),4.85(1H,dd,J=17.5,1.5 Hz,Hb-16),1.20(3H,s,H-17),1.00(3H,s,H-20),0.65(3H,s,H-19).13CNMR(125 MHz,CDCl3)δ:183.6(C-18),147.2(C-15),137.9(C-8),127.9(C-14),112.8(C-16),56.1(C-9),50.4(C-5),43.9(C-4),39.2(C-13),38.5(C-1),37.9(C-10),36.4(C-3),35.7(C-7),34.1(C-12),29.7(C-17),24.0(C-6),19.5(C-11),19.1(C-2),14.1(C-19),29.3(C-16),13.7(C-20)。以上数据与参考文献一致[11],故鉴定为海松酸。
化合物4:C20H18O6,白色粉末,mp 122~123 ℃,[a]D=12.2(c 0.11,MeOH),EI-MS m/z:354[M]+。1HNMR(400 MHz,CD3OD)δ:6.90(2H,d,J=1.4 Hz,H-2',H-2''),6.86(2H,dd,J=8.2,1.5 Hz,H-6',H-6''),6.81(2H,d,J=7.9 Hz,H-5',H-5''),5.97(4H,s,2×-OCH2O-),4.75(2H,d,J=4.3 Hz,H-2β,H-6β),4.27(2H,dd,J=9.1,2.1 Hz,H-4α,H-8α),3.89(2H,dd,J=9.2,3.5 Hz,H-4β,H-8β),3.13~3.15(2H,m,H-1α,H-5α)。13C-NMR(100 MHz,CD3OD)δ:149.2(C-3',C-3''),148.4(C-4',C-4''),136.1(C-1',C-1''),120.5(C-6',C-6''),108.9(C-5',C-5''),107.4(C-2',C-2''),102.2(-OCH2O-),87.1(C-2,C-6),72.5(C-4,C-8),55.3(C-1,C-5)。以上数据与参考文献一致[12],故鉴定为(+)-芝麻素。
化合物5:C20H16O6,白色粉末,mp 140~141 ℃,EI-MS m/z:353[M+1]+.IR(KBr)cm-1:3012,2913,2852,1735,1645,1500,1444,1182,919。1HNMR(400 MHz,CDCl3)δ:7.50(1H,d,J=2.0 Hz,H-7),7.08(1H,m,H-2’),7.04(1H,s,H-6’),6.88(1H,d,J=7.9 Hz,H-3’),6.73(1H,d,J=7.9 Hz,H-3’’),6.66(1H,s,H-6’’),6.63(1H,d,J=7.3 Hz,H-2’’),6.04(2H,s,3-OCH2O-),5.93(2H,d,J=4.3 Hz,3’-OCH2O-),4.25(2H,m,H-5),3.74(1H,m,H-3),2.99(1H,m,Hb-4),2.59(1H,m,Ha-4)。13CNMR(100 MHz,CDCl3) δ:173.0(C-6),149.6(C-5’),148.5(C-4’),148.0(C-5’’),146.5(C-4’’),137.5(C-1),131.7(C-1’’),128.4(C-1’),126.3(C-2’),126.3(C-2),122.0(C-2”),109.3(C-6”),109.0(C-3’),108.8(C-3”),102(3-OCH2O),101.8(3’-OCH2O),69.8(C-5),40.0(C-3),38.0(C-4)。以上数据与参考文献一致[13],故鉴定为洒维宁。
化合物6:C17H24O9,白色针晶,mp 189~190 ℃,α-萘酚-浓硫酸试验呈阳性,1H-NMR(400 MHz,CD3OD)δ:6.74(2H,s,H-3,H-5),6.55(1H,d,J=15 Hz,H-7),6.35(1H,dd,J=15,5 Hz,H-8),4.85(1H,d,J=9.0 Hz,H-1’),3.84(6H,s,2×OCH3),3.78(1H,m,H-6’),3.76(1H,m,H-2’),3.55(1H,m,H-3’),3.48(1H,m,H-4’),3.20(1H,m,H-5’)。13C-NMR(100 MHz,CD3OD) δ:154.3(C-2),154.3(C-6),135.8(C-1),135.2(C-4),131.2(C-7),130.0(C-8),105.4(C-3),105.4(C-5),105.3(C-1’),78.3(C-9),77.8(C-5’),75.7(C-3’),71.3(C-2’),63.4(C-4’),62.5(C-6’),57.0(OCH3)。 以上数据与参考文献一致[14],故鉴定为丁香苷。
化合物7:C34H46O18,白色针晶,mp 257~259 ℃,IR(KBr)cm-1:3400,3030,2960,1600,1530,1150,1020,600。1H-NMR(400 MHz,CD3OD) δ:6.80(4H,s,H-2,6,2’,6’),4.86(2H,d,J=5.0 Hz,glc-H-1,glc-H-1’),4.60(2H,d,J=4.0 Hz,H-7,7’),3.70(12H,s,4×-OCH3),3.10(2H,m,H-8,8’),13C-NMR(100 MHz,CD3OD) δ:152.9(C-3,3’,5,5’),137.1(C-4,4’),134.3(C-1,1’),104.5(C-2,2’),104.5(C-6,6’),103.3(glc-1,1’),85.4(C-7,7’),79.3(glc-3,3’),77.5(glc-5,5’),76.8(glc-2,2’),74.6(C-9,9’),71.8 (glc-4,4’),70.3(glc-6,6’),56.9(-OCH3),56.8(-OCH3),54.1(C-8,8’)。以上数据与参考文献一致[15],故鉴定为刺五加苷E。
另外,通过DART-MS图谱数据结合Dictionary of Natural Product数据库[16]图谱分析推测在100%甲醇洗脱流份中检测到的化合物(8)和化合物(9),可能为taiwanin C(C20H12O6,m/z:348.06490,intensity 16971.45)和10-羟基-2,8-癸二烯-4,6-二炔酸(C13H13O4,m/z:233.08252,intensity 46196.00);在80%甲醇洗脱流份中检测到的化合物(10),可能为3,7,11-trimethyl-2,6,10-dodecatrienoic acid (C15H24O2,m/z:237.18348,intensity 9086.78);在50%甲醇洗脱流份中检测到的化合物(11),可能为咖啡酸(C11H13O4,m/z:209.08184,intensity 22645.86);在30%甲醇洗脱流份中检测到的化合物(12),可能为stigmast-7-ene-3,6-diol(C29H50O2,m/z:430.37843,intensity 9051.51),如图1~4所示。

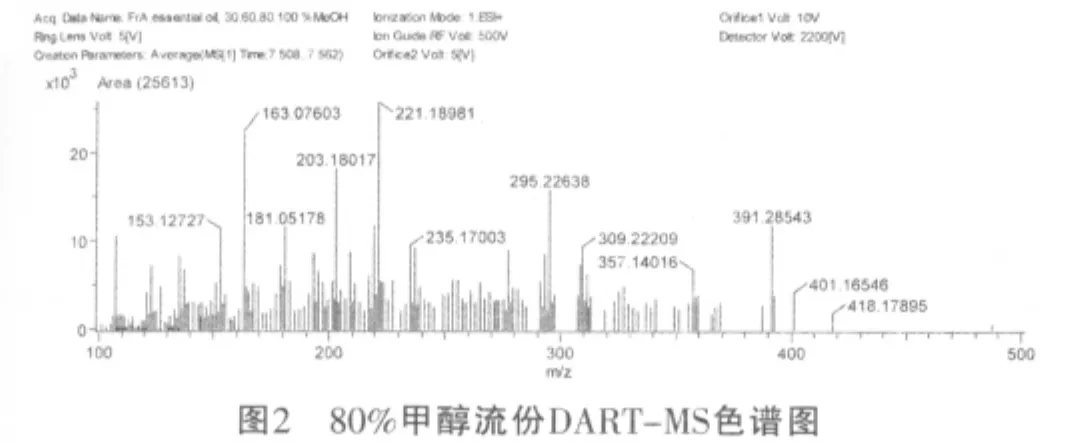

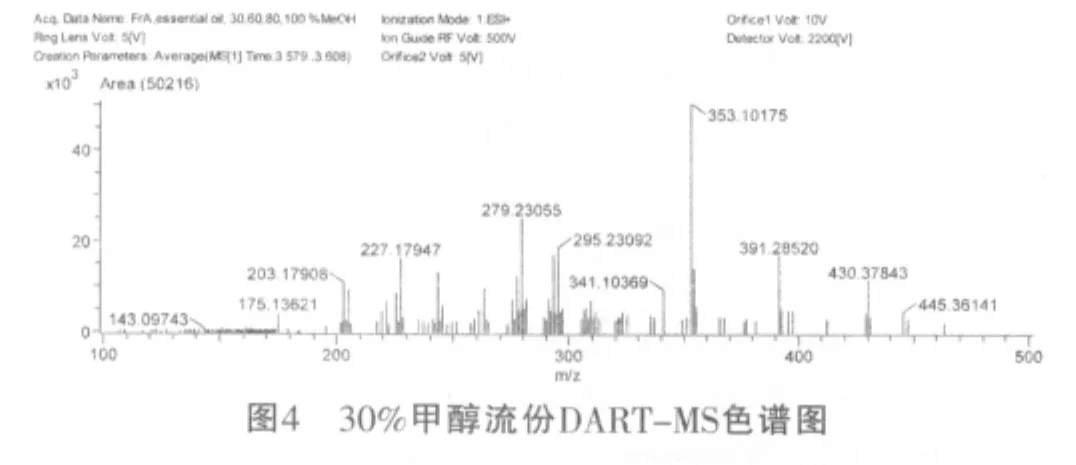
4 结论
本文报道抗炎导向下糙叶五加根皮的化学成分研究,通过常规柱色谱共分离鉴定出7个化合物,分别为:豆甾醇、β-谷甾醇、海松酸、(+)-芝麻素、洒维宁、丁香苷和刺五加苷E;通过实时直接分析质谱技术分析推测糙叶五加根皮中可能存在taiwanin C、10-羟基-2,8-癸二烯-4,6-二炔酸、3,7,11-trimethyl-2,6,10-dodecatrienoic acid、咖啡酸和stigmast-7-ene-3,6-diol。其中,调控炎症因子PGE2的木脂素类化合物taiwanin C对COX-1和COX-2呈现出很强的剂量依赖性抑制作用[17-18];另外,在对糙叶五加根皮的活性研究中发现,80%甲醇流份中的化学成分也对NO、PGE2等炎症前因子表现出明显的抑制作用,提示该部分中可能存在具有良好抗炎作用物质,可进一步实验研究。本研究结果将为系统研究五加属植物和开发具有抗炎活性药物提供一定的理论和实验依据。
[1]湖南省食品药品监督管理局.湖南省中药材标准[S].长沙:湖南科学技术出版社,2009:300.
[2]倪 娜,刘向前.五加科五加属植物的研究进展 [J].中草药,2006,37(12):1895-1900.
[3]Liu X Q, Chang S Y, Yook C S.Lupane triterpenoids from the leaves of Acanthopanax gracilistylus[J].Journal of Lanzhou University(NaturalSciences), 2006, 42(4):86-92.
[4]Zou Q P, Liu X Q, Lee H K, et al.Lupane triterpenoids from the methanol extracts of leaves of Acanthopanax gracilistylus W.W.Smith[J].Journal of Lanzhou University(Natural Sciences), 2011, 47(6):120-126.
[5]邹亲朋.两种五加属植物叶中抗HMGB1三萜活性成分研究[D].长沙:中南大学,2012.
[6]涂正伟,周渭渭,单 淇,等.刺五加的研究进展[J].药物评价研究,2011,34(3):213-216.
[7]张会昌,贾忠建.糙叶五加皮化学成分研究[J].兰州大学学报(自然科学版), 1993,29(1):76-79.
[8]陈 勇,邹亲朋,刘向前,等.RP-HPLC测定糙叶五加不同药用部位中槲皮素和山柰酚[J].现代药物与临床,2011,26(4):310-312.
[9]冯 胜,刘向前,张伟兰,等.RP-HPLC法测定糙叶五加不同部位中刺五加苷B和E[J].中草药,2011,42(6):1144-1146.
[10]马柱坤,戴 源,张蓓蓓,等.高山大戟化学成分研究[J].西北药学杂志,2012,2(1):1-4.
[11]王 峰,崔红花,王淑美.苏合香化学成分研究[J].中国实验方剂学杂志,2011,4,17(8):89-91.
[12]Maique W B, Paulo C V, M.Fátima G.F, et al.Separation and NMR studies on lignans of Raulinoa echinata[J].Phytochem.Anal,2010(12):64-68.
[13]Kyeong W W, Sang U C, Jong C P, et al.A new lignan glycoside from Juniperusrigida [J].Arch Pharm Res,2011,34(12):2043-2049.
[14]Jiang H L, Yi L, Guang Z T, et al.Phenolic glucosides from Oxytropis myriophylla[J].Journal of Asian Natural Products Research,2002,4(1):43-46.
[15]Nzunzu L, Shigetoshi K, Tohru K, et al.Constituents of the roots of Boerhaavia diffusa L. III. identification of Ca2+channel antagonistic compound from the methanol extract[J].Chem Pharm Bull,1991,39(6):1551-1555.
[16]John B.Dictionary of Natural Product[DB/CD].London:Chapman&Hall/CRC,2011.
[17]Ban H S, Lee S, Kim Y P, et al.Inhibition of PGE2 production by taiwanin C isolated from the rootofAcanthopanax chiisanensis and the mechanism of action[J].Biochem.Pharmacol,2002,64(9):1345-1354.
[18]Lee S, Ban H S, Kim Y P, et al.Lignans from Acanthopanax chiisanensis having an inhibitory activity on prostaglandin E2production[J].Phytother.Res,2005,19(2):103-106.
Study on chemical constituents from root barks of Acanthopanax henryi
LIU Heng-yan1, KIM Jongh-wan2, LIU Xiang-qian1,YOOK Chang-soo3
(1.Pharmaceutical college, TCM University of Hunan,Changsha, Hunan 410208 China;2.Herbal Medicine Research Division,Korea Food&Drug Administration,Seoul 363-700,Korea;3.Pharmaceutical college,Kyung-Hee University, Seoul 130-701, Korea)
root barks of Acanthopanax henryi(A.henryi);chemical constituents;structure identification;DART-MS
R284.1
A
10.3969/j.issn.1674-070X.2012.11.009.034.04
〔Absrract〕Objective To study the chemical constituents of root barks of Acanthopanax henryi(A.henryi)based on anti-inflammatory activities.Methods The compounds were isolated and obtained by column chromatography including XAD-4, silica gel, ODS and Sephadex LH-20,combined with DART-MS technology.The structures of these compounds were elucidated by means of physiochemical properties and spectroscopic analysis.Results Seven compounds were separated and identified as stigmasterol(1), β-sitosterol(2), pimaric acid(3), (+)-sesamin(4), savinin(5), syringing(6)and eleutheroside E (7)by column chromatography.In addition, taiwanin C,10-hydroxy-2,8-decadiene-4,6-diynoic acid, 3,7,11-trimethyl-2,6,10-dodecatrienoic acid, caffeic acid together with stigmast-7-ene-3,6-diol could be existed in root barks of Acanthopanax henryi by DART-MS compared with their standard spectrums.Conclusion Compounds 3, 4, 5, 7 were obtained from the genus for the first time.
2012-07-21
湖南省自然科学基金重点项目(11JJ2042);湖南省研究生科研创新项目(CX2011B348);湖南中医药大学药物分析学“十二五”校级重点学科建设项目。
刘恒言(1987-),男,安徽宿州人,在读硕士研究生,主要从事中药及天然产物活性成分研究。
* 刘向前,男,教授,硕士研究生导师,E-mail:lxq0001cn@163.com。
(本文编辑 杨 瑛)
