酶解大豆蛋白产天冬氨酸蛋白酶抑制剂的研究
2012-12-22张国强田亚平
张国强,田亚平
江南大学工业生物技术教育部重点实验室,无锡214122
蛋白酶四大家族[1-4],即天冬氨酸蛋白酶、丝氨酸蛋白酶、半胱氨酸蛋白酶和金属蛋白酶,通过特异性地水解不同的肽键控制着生物体内蛋白质合成后的结构修饰与功能释放,来规范生物体的生理活动,例如参与消化的胃蛋白酶、调控血压的肾素、参与细胞内肽水解的组织蛋白酶D、水解酪蛋白的凝乳酶、艾滋病病毒蛋白酶等[5,6]。研究天冬氨酸蛋白酶的抑制剂作为高血压、病毒传染、肿瘤转移、大脑进行性萎缩(Alzheimer's disease)等疾病的治疗方案有较高的医疗学价值[7,8]。天冬氨酸蛋白酶抑制剂还可作为纯生啤酒、面粉加工等的品质改良剂。
大豆蛋白在大豆中含量38%左右,是谷类食物的4~5倍[9]。降解大豆蛋白有多种方法,每种方法获得的肽段的种类及组成不尽相同。目前,主要采用化学水解法、酶解法、和微生物发酵的方法获得活性多肽[10],其研究成果集中在ACE活性抑制肽、抗氧化肽、降胆固醇肽、调节免疫肽等方面。吴建平[11]等通过蛋白酶酶解大豆豆粕获得了两种ACE抑制肽;钟芳[12]等通过两种蛋白酶AS1.398和Alcalase水解大豆分离蛋白制得水解度为10%~24%的大豆多肽,通过大孔树脂以及凝胶层析获得了3个ACE抑制剂峰。
本文采用可控酶解大豆蛋白的方式获得一种小分子肽类天冬氨酸蛋白酶抑制剂,原料纯天然,来源广泛、酶解条件安全温和、工艺易于规模化放大,目标产品在医药保健和食品品质提升方面有较大的应用潜力。
1 材料与方法
1.1 试剂与仪器
大豆分离蛋白,购自安阳漫天雪食品有限公司;胃蛋白酶、胰蛋白酶、木瓜蛋白酶购自美国sigma公司;风味蛋白酶购自诺维信公司;DEAE-52,美国Amersham公司;AKTA纯化系统,GE Healthcare医疗集团;高速冷冻离心机、真空冷冻干燥机,日本日立公司;MOS-450 AF-CD圆二色光谱仪,法国Bio-Logic SAS公司。
1.2 实验方法
1.2.1 蛋白酶活性、酶解产物抑制活性测定
蛋白酶活力测定:福林酚法。
抑制活性测定:对蛋白酶的抑制活性是通过测定在酶最适pH条件下抑制组(加入抑制剂)与空白组(加入缓冲液)底物水解度差异来进行的。空白组为正常的酶解反应,预反应时只加入与溶解抑制剂相同的缓冲液。
抑制活性的定义:即为抑制组与空白组所测得蛋白酶活力的差异百分数,10%为一个抑制单位,用IU表示。
1.2.2 可控酶解条件
配置浓度为5%的蛋白底物,酶加入量为8000 U/g,分别用木瓜蛋白酶(50℃)、胰蛋白酶(37℃)、风味蛋白酶(37℃,酸式水解、碱式水解),在其最适条件下单酶水解大豆蛋白,在0~90 min内每隔10 min取样,样品立即在90℃灭酶活15 min,恢复至室温后测定对胃蛋白酶抑制活性。
1.2.3 抑制剂的分离纯化
酶解液90℃热处理15 min,离心除去析出的不溶蛋白,冻干备用。
DEAE Sepharose Fast Flow阴离子交换层析:用pH 6.8的磷酸钠缓冲液(20 mmol/L)溶解冻干样品,用pH 6.8的磷酸钠缓冲液(20 mmol/L),在流速为5 mL/min条件下平衡HiPrep DEAE FF 16/10 (1.6×10 cm)柱,收集未吸收峰,再分别以含Nacl浓度为0.2、0.4、0.6、0.8、1.0 M的磷酸钠缓冲液进行梯度洗脱。
Superdex Peptide 10/300 GL凝胶层析:用 pH 6.8的磷酸钠缓冲液平衡色谱柱。进样量为0.2 mL,以同样的缓冲液洗脱,流速为0.1 mL/min,检测波长为220 nm。
SOURCE 15RPC反相层析:SOURCE 15RPC ST4.6/100色谱柱,流动相:A,10%乙腈(V/V),0.1%三氟乙酸(TFA)(V/V);B,80%乙腈(V/V),0.1%三氟乙酸(TFA)(V/V),线性洗脱,检测波长为220 nm。
1.2.4 纯度鉴定
用RP-HPLC法测定反相层析获得的样品的纯度。取冻干后的样品用双蒸水溶解后用0.22 μm微孔滤膜过滤。色谱条件:Restek C18柱 (250 mm ×4.6 mm,5 μm);流动相:A,20%乙腈(V/V),0.1%三氯乙酸(V/V);B,70%乙腈(V/V),0.1%三氯乙酸(V/V)。梯度洗脱程序:0~3 min 100%A (V/V),5~20 min:0~100%B(V/V)。流速为1 mL/min;柱温为25°C,进样量为10 μL;检测波长为220 nm。
1.2.5 SAPI的基本性质研究
温度稳定性的研究:在温度范围20~90℃内,每增加10℃为一个梯度,水浴1 h,之后恢复至室温,测定抑制剂对胃蛋白酶的剩余抑制活性,确定抑制剂温度稳定性。
抑制酶谱的确定:分别测定酶解产物对胃蛋白酶(Pepsin,天冬氨酸族蛋白酶)、凝乳酶(Chymosin,天冬氨酸族蛋白酶)、木瓜蛋白酶(Papain,巯基蛋白酶)、胰蛋白酶(Trypsin,赖氨酸、精氨酸酶)、中性蛋白酶(Neutral protease)和碱性蛋白酶(Alkaline protease)的抑制活性,确定抑制剂的抑制酶谱。
抑制剂对胃蛋白酶的IC50测定:在最佳条件下,测定不同的抑制剂浓度对胃蛋白酶活性的抑制百分比,以抑制剂浓度为横坐标,胃蛋白酶损失的酶活单位为纵坐标,作图法确定抑制剂对胃蛋白酶的半数抑制浓度。
抑制剂抑制动力学分析:固定胃蛋白酶质量浓度为1 mg/mL,改变底物浓度以及抑制剂加入量,测定反应初速度。以血红蛋白浓度为横坐标,胃蛋白酶反应初速率为纵坐标,研究不同抑制剂浓度对酶活的影响。以底物浓度倒数为横坐标,以反应初速度为纵坐标,作Lineweaver-Burk双倒数曲线,测定抑制剂抑制类型。
2 结果与讨论
2.1 大豆分离蛋白可控酶解条件
如图1所示,木瓜蛋白酶水解大豆分离蛋白,在水解30 min时获得最大对胃蛋白酶抑制活性,为3.3 IU/mL。30 min后继续酶解,抑制活性无明显增加。取木瓜蛋白酶水解30 min后的酶解液,分别用胰蛋白酶,风味蛋白酶(酸式与碱式)继续酶解,酶解时间为60 min,酶解后抑制活性几乎没有变化,因此明确可控酶解条件为:大豆分离蛋白85℃水浴20 min,恢复至木瓜蛋白酶最适温度后以酶底比为8000 U/g的加入量酶解30 min。
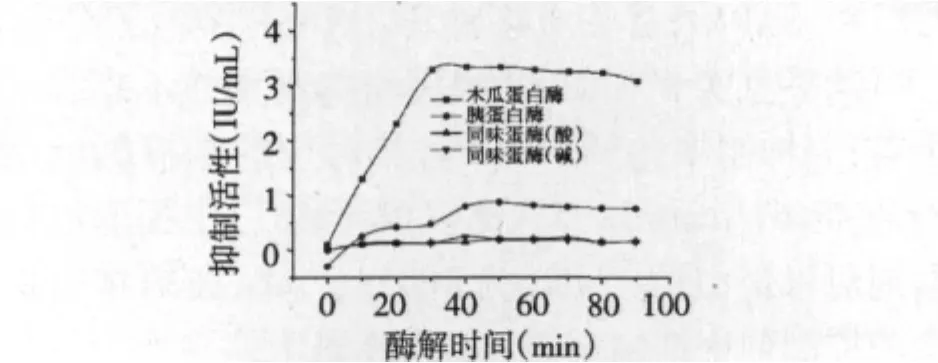
图1 单酶水解大豆蛋白Fig.1 Production of inhibitor from soy protain by single enzyme hydrolysis
2.2 抑制剂的分离纯化
木瓜蛋白酶酶解30min的酶解液90℃水浴15 min灭酶,冷冻离心去除析出变性蛋白质后冻干,备用。
2.2.1 DEAE-52阴离子交换层析
酶解后的冻干样品,通过DEAE-52阴离子交换层析,结果见图2,在以0.2M Nacl进行洗脱时获得了具有较高抑制活性的组分,收集活性峰处样品,冷冻干燥,即为粗抑制剂。

图2 DEAE-52离子交换层析图谱Fig.2 Ion-exchange chromatography by DEAE-52
2.2.2 Superdex Peptide 10/300 GL凝胶层析
将上一步获得的粗抑制剂进行凝胶层析,结果见图3,在峰a处检测到了高抑制活性的组分,但是相应的电导率峰a也达到了最大值,在凝胶层析过程中,活性组分与盐分同时洗脱出来,说明活性组分分子量可能比较小,后续分离步骤尝试采用反相层析的方法。

图3 Superdex Peptide 10/300 GL凝胶层析ig.3 Superdex Peptide 10/300 GL gel chromatography
2.2.3 SOURCE 15RPC反相层析
将凝胶层析的结果进行反相层析,结果见图4,在峰a处测得了样品具有对胃蛋白酶抑制活性。在0~10 min内洗脱下来的是未吸附于层析柱上的组分,且在峰a处测得了较大的电导率,说明活性组分仍然与盐分一并洗脱下来。表1为木瓜蛋白酶酶解大豆蛋白获得抑制剂的分离、纯化过程的比抑制活性及活力的变化情况。最终比抑制活力为254.2 IU/mg,纯化倍数为62。

图4 SOURCE 15RPC反相层析Fig.4 SOURCE 15RPC reverse phase chromatography

表1 纯化结果Table 1 Purification results
2.2.4 抑制剂纯度鉴定(多肽分布)

图5 反相层析纯化后多肽分布Fig.5 Polypeptide molecular weight distribution after reverse phase chromatography
测定反相层析后获得样品的多肽分布,结果见图5。经过反相层析的样品,大分子量的杂蛋白已经基本去除,分子量为62的吸收峰为样品中的盐分,分子量为167的最为可能是目的组分,从分子量上推测可能是含2个氨基酸的小肽。结合等电点测定在pH 4~5之间及其在离子交换层析过程的表现,说明其中必定含有一种酸性氨基酸。
2.3 SAPI的基本性质研究
2.3.1 抑制剂热稳定性试验
结果见图6,在20~90℃范围内,获得大豆蛋白酶解产物(胃蛋白酶抑制剂)具有良好的热稳定性,因此其应用范围更广,且对加工、保存皆有较大益处。
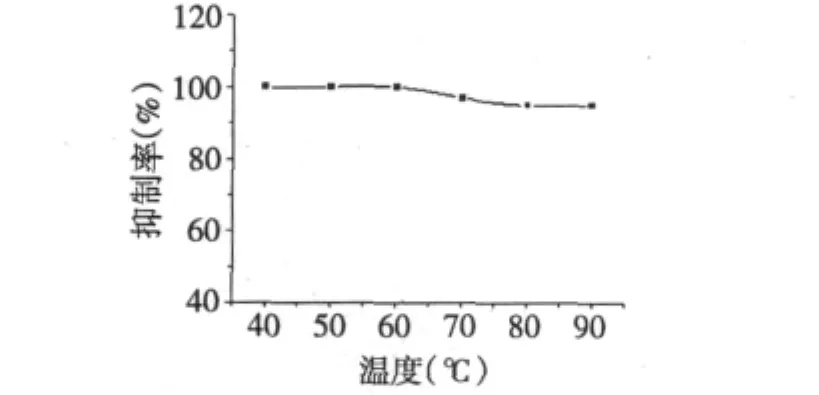
图6 SAPI的温度稳定性Fig.6 The heat stability of SAPI
2.3.2 抑制剂的抑制酶谱的研究
如图7,SAPI对天冬氨酸家族的胃蛋白酶以及凝乳酶具有较高抑制活性,对其它家族的蛋白酶几乎没有抑制效果,可明确该小分子抑制剂为一种天冬氨酸族蛋白酶抑制剂。


2.3.3 SAPI对胃蛋白酶的IC50测定
结果见图8,SAPI的浓度与抑制率并不成线性关系,当抑制率达到50%时,其对应的半抑制浓度约为25.67 μg/mL,从灵芝发酵干粉[13]中提取的抑制剂对胃蛋白酶的IC50为180 μg/mL,在植物中提取的抑制剂中抑制剂的IC50值已属于抑制作用较强的类型。
2.3.4 抑制剂对胃蛋白酶的抑制动力学研究
Lineweaver-Bunk双倒数法作图,结果见图9、10。由图可知,抑制剂加入后没有影响胃蛋白酶的Km值,同时Vm值减小,说明抑制剂属于非竞争性的,由于抑制剂分子量较小,推测抑制剂可以与胃蛋白酶分子多处相互作用。

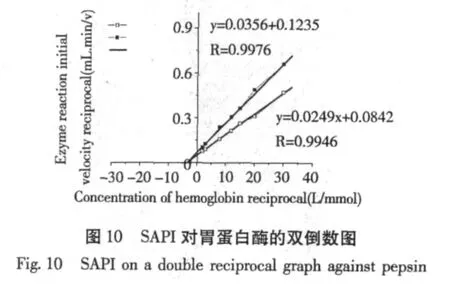
3 结语
大豆蛋白热处理后经木瓜蛋白酶在特定条件下酶解,可获得较高抑制活性的酶解产物。经过DEAE-52阴离子交换、Superdex Peptide 10/300 GL凝胶层析、SOURCE 15RPC反相层析获得了62倍纯化的天冬氨酸蛋白酶抑制剂,属于一种非竞争性抑制剂。酶解大豆蛋白获得的天冬氨酸蛋白酶抑制剂SAPI符合具有药用潜力蛋白酶抑制剂的特点:天然产物、易于获得、分子量较小(<1000 Da)、具有良好的温度稳定性。
1 Babine,RE,Bender,SL.Molecular recognition of protein-ligand complexes:Applications to drug design.Chem Rev.1997,97:1359-1472.
2 Ripka AS,Rich DH.Peptidomimetic design.Curr Opin Chem Biol.1998,2:441-52.
3 Alessandro T,Irena B,Nikolinka A,et al.Aspartic protease inhibitors.Eur J Biochem.2000,267:1715-1722.
4 Shaw E.Cysteinyl proteinases and their selective inactivation.Adv Enzymol Relat Areas Mol Biol.1990,63:271-347.
5 Donmienne L,Giovanni A,David P,et al.Protease Inhibitors:Current Status and Future Prospects.J Med Chem.2000,43:305-341.
6 Patick AK,Potts KE.Protease inhibitors as antiviral agents.Clin Microbiol Rev.1998,11:614-627.
7 Simon AC,Wendy EL,Jeffrey H,et al.Aspartic proteinase inhibitors from tomato and potato are more potent against yeast proteinase A than cathepsin D.Biochim Biophys Acta,2002,1596:76-82.
8 Martin JL,Begun J,Schindeler A.Molecular recognition of macrocyclic peptidomimetic inhibitors by HIV-1 protease.Biochemistry,1999,38:7978-7988.
9 Fan XK(范喜宽),Zhuang L(庄磊),Zhao YM(赵一敏),et al.Current situation of research and prospects of use of soybean peptides.Beverage Ind(饮料工业),2009,12:1-4.
10 Ni XM(倪雪朋),Fu Z(付正),Guan B(管斌),et al.Research progress on the preparation of soybean bioactive peptides by enzymatic modification.China Brewing(中国酿造),2010,11:9-12.
11 Wu JP(吴建平).Development of Antihypertensive Peptide from Soybean.Chin Oils and Fats(中国油脂),1998,23:22-25.
12 Liu JM(刘健敏),Zhong F(钟芳),Ma JG(麻建国),et al.Soybean Bioactive Peptides(Ⅱ)--Antioxidant activity and ACE inhibitory activity of the hydrolysates.J Wuxi Uuiv Light Ind(无锡轻工大学学报),2004,23:50-55.
13 Tian YP(田亚平),Zhang KC(章克昌).Purification and Characteristic of Proteinase Inhibitor GLPIA2 from Ganoderma lucidum by Submerged Fermentation J.Chin J Chrom(色谱),2005,23:267-269.
