原生质体紫外诱变提高简青霉的木质素降解性能
2012-12-20胡天觉曾光明吴娟娟黄丹莲湖南大学环境科学与工程学院湖南长沙410082湖南大学环境生物与污染控制教育部重点实验室湖南长沙410082
沈 莹,胡天觉*,曾光明,吴娟娟,黄 超,刘 晖,黄丹莲,尹 璐 (1.湖南大学环境科学与工程学院,湖南 长沙 410082;2.湖南大学环境生物与污染控制教育部重点实验室,湖南 长沙 410082)
原生质体紫外诱变提高简青霉的木质素降解性能
沈 莹1,2,胡天觉1,2*,曾光明1,2,吴娟娟1,2,黄 超1,2,刘 晖1,2,黄丹莲1,2,尹 璐1,2(1.湖南大学环境科学与工程学院,湖南 长沙 410082;2.湖南大学环境生物与污染控制教育部重点实验室,湖南 长沙 410082)
以简青霉Penicillium simplicissimum (Oudem.) Thom BGA为出发菌株,对其进行原生质体紫外诱变.经过筛选获得2株诱变菌株(J12与J18),它们的木质素降解酶酶活要明显高于出发菌株J.其中诱变菌株J12产生的漆酶和锰过氧化物酶酶活较高,相对于出发菌株J分别提高了145%和47%,达到44.0,50.9 U/g.诱变菌株J18产生的木质素过氧化物酶酶活较高,达到67.1 U/g,相对于出发菌株J提高了40%.且木质素降解率也最高,相对于出发菌株J分别提高了198.1%.经过7次传代, J12和J18的木质素降解酶活性保持稳定,没有降低.
简青霉;诱变;生物降解;木质素
木质素是一种难降解的天然有机物质,大量存在于植物秸秆、木材中,如水稻中木质素占秸秆总量的 20%~28%.木质素的结构十分复杂,严重制约了水稻秸秆等农业固体废物的减量化、资源化和再利用.研究表明,微生物菌种如真菌,通过分泌木质素降解酶氧化断裂木质素的化学键,有效降解木质素[1-5].木质素降解酶主要是指漆酶(Laccase)、木质素过氧化物酶(Lip)和锰过氧化物酶(Mnp).目前生物降解木质素的研究大多集中于白腐真菌如黄孢原毛平革菌等,对简青霉等软腐菌在相关方面的研究报道较少[6-7].简青霉的研究报道多集中于其对纤维素的降解,而对于木质素的降解仅有少量研究报道[3-4].作者用筛选得到的一株产生上述 3种重要的木质素降解酶的简青霉(Penicillium simplicissimum (Oudem.) Thom BGA)[4]进行了原生质体制备及紫外诱变育种,研究其对木质素的降解能力.
1 材料与方法
1.1 实验菌株
简青霉(P. simplicissimum (Oudem.)Thom BGA),由湖南大学环境科学与工程学院“863”课题研究组提供[3,4].
1.2 培养基
基础培养基(查氏培养基):NaNO32g, K2HPO41g,KCl 0.5g,MgSO40.5g, FeSO40.01g,蔗糖30g,琼脂16g,蒸馏水1000mL,pH 6.0,121℃灭菌20min.
菌种保藏培养基(PDA培养基):去皮马铃薯200g,葡萄糖20g,琼脂16g,蒸馏水1000mL,121℃灭菌20min.
再生固体培养基:NaCl浓度为 0.7mol/L,其他同基础培养基.
鉴别培养基1(愈创木酚PDA固体培养基):去皮马铃薯 200g,葡萄糖 20g,琼脂 16g,KH2PO33g,MgSO41.5g,蒸馏水 1000mL,灭菌后添加愈创木酚0.4g.
鉴别培养基2(Azure-B培养基)[8]:去皮马铃薯 200g,葡萄糖 20g,琼脂 16g,KH2PO33g, MgSO41.5g,天青-B(Azure-B) 0.1g,蒸馏水1000mL, 121℃灭菌20min.
鉴别培养基 3(RBBR)培养基[9]:去皮马铃薯200g,葡萄糖 20g,琼脂 16g,KH2PO33g,MgSO41.5g,雷玛唑亮蓝(RBBR)0.625g/L,蒸馏水1000mL,121℃灭菌20min[10].
固态发酵培养基:称取烘干稻草 30g于1000mL锥形瓶中,加入70mL蒸馏水.121℃灭菌20min.
1.3 主要试剂和仪器
蜗牛酶(Snailase)购自合肥博美生物科技有限责任公司;稳渗剂:0.7mol/L的NaCl ;RBBR、Azure-B、2,2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)、96% 藜芦醇均购自于Sigma-ALDRICH公司.
紫外-可见光分光光度计(日本岛津公司, UV-2550);光学显微镜(OLYMPUS BX61);显微镜照像机(Penguin 600CL,Pixera公司);环境扫描电镜(FEI Quanta 200).
1.4 实验方法
1.4.1 蜗牛酶酶液配制 用 0.7mol/L的 NaCl溶液配制 0.04g/mL浓度的蜗牛酶酶液,经0.22um的微孔滤膜过滤除菌.
1.4.2 原生质体紫外诱变[11]在无菌操作台上,收集处于对数期(经培养 72h~120h)的简青霉菌丝体约重 0.1g.将收集好的菌丝体按每 50mg菌丝体加入1mL蜗牛酶酶液的比例混合,37℃保温2h,用 G3砂芯漏斗过滤去除菌丝碎片.滤液10000r/min离心10min,离心3次,沉淀即为纯净原生质体.
将稀释至浓度为103个/mL左右的纯净原生质体溶液1mL均匀涂布于再生固体培养基平板上(平皿直径9cm).置于10W的紫外灯下(照射前打开30min使光波稳定),距离50cm,于黑暗条件下分别照射 0,7,8,9,10,11,12,13,14,15,16,17,18, 19,20min.照射完毕后,马上置于冰箱内在低温条件(-5℃)下暗处理1h.然后,置于34℃恒温培养箱中培养.每天观察,待菌落数稳定后记下每个培养皿中的菌落数.
致死率(%)=(未照射的再生菌落数-照射后的再生菌落数)÷未照射的再生菌落数×100%
1.4.3 筛选 初筛:挑选在再生平板上长势好的或发生形态变化的菌落,点植在鉴别培养基上,培养 5d,每天进行观察,根据 RBBR培养基、Azure-B培养基和愈创木酚培养基上的生长和褪色情况判断菌株降解木质素的能力.挑选在鉴别培养基上表现好的菌落划线接种于PDA培养基平板上,继续培养 5d后,重复鉴别培养和传代过程,共转7代.
复筛:挑取传了7代,并在鉴别培养基上表现好的菌株进行生物降解木质素的产酶能力和降解性能测定.每隔 5d测一次木质素降解酶酶活,到第30d结束.比较出发菌株和诱变菌株产最大木质素降解酶的酶活,确定诱变菌株产酶性能是否稳定.
1.4.4 降解木质素能力测定 每瓶固态发酵培养基中加入浓度为1×106个/mL菌悬液10mL.每隔5d从上述培养基中取样测定漆酶、木质素过氧化物酶和锰过氧化物酶的酶活.同时用10g稻草装瓶,相同条件接种培养,测定始末木质素、半纤维素和纤维素的含量,用于计算各组分绝对量的变化.
1.4.5 粗酶液制备 从固态发酵培养基中取出约2.00g±0.05g的固体样品,装入250ml锥形瓶中,并在瓶中加入20mL蒸馏水,稍作振荡后,放入摇床中 150r/min振荡浸提 1h;振荡完毕后 10000 r/min离心10min,上清液可看作除去孢子的粗酶液,用于酶活的测定.
1.4.6 酶活和木质素降解率测定 木质素过氧化物酶[12]:于310nm测藜芦醇被氧化成藜芦醛的光密度变化.反应体系包括藜芦醇(10mmol/L)、H2O2(10mmol/L)、0.1mol/L酒石酸缓冲液(pH 3.0)和粗酶液.定义每min使1μmol的藜芦醇氧化成藜芦醛所需的酶量为一个酶活力单位(U).
锰过氧化物酶[13]:于240nm测Mn2+被氧化成 Mn3+的光密度变化.反应体系包括MnSO4(15mmol/L)、H2O2(10mmol/L)、0.05mol/L琥珀酸缓冲液(pH 4.5)和粗酶液.定义每min产生1μmol Mn3+所需要的酶量为一个酶活力单位(U).
漆酶[14]:于420nm测ABTS被氧化的光密度变化.反应体系包括 ABTS(1.0mmol/L)、100mmol/L柠檬酸-柠檬酸钠缓冲溶液(pH 5.0)和粗酶液.定义每min转化1μmol的ABTS所需的酶量为一个酶活力单位(U).
采用中性洗涤法、酸性洗涤法和72%硫酸法[15-16]来测定固态发酵物中的中性洗涤去除物含量、半纤维素含量、纤维素含量和木质素含量.
2 结果与讨论
2.1 简青霉生长曲线的测定
从图1可以看出,第3d到第5d简青霉菌丝体生长速率最大,是菌丝体生长的对数期,故选用这一时期的菌丝体来制备原生质体进行诱变.
2.2 简青霉原生质体的制备及再生
在原生质体制备的实验中发现菌龄对原生质体的形成影响很大.当菌丝体处于对数期时,原生质体的制备率最高.只用蜗牛酶处理就可以获得较高数量的原生质体.通过预实验计算,简青霉出发菌株原生质体的制备率为16.9%、再生率为90.4%.简青霉原生质体的高再生率,有利于进行下一步的紫外诱变.
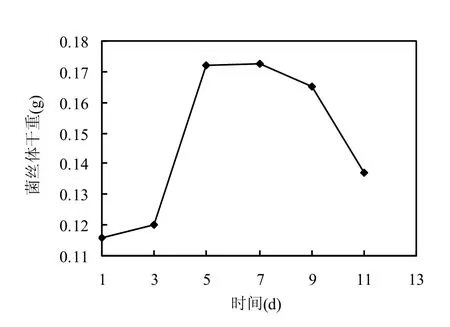
图1 简青霉生长曲线Fig.1 Growth curve of Penicillium simplicissimum
2.3 简青霉原生质体的紫外照射致死曲线
采用紫外线对简青霉原生质体即出发菌株原生质体进行不同时间的照射,原生质体的致死率与诱变时间的关系如图2所示.研究表明,当致死率在80%左右时,产生的正诱变菌株较多,但高致死率有利于筛选到产量提高幅度大的诱变菌株[17].本实验选用紫外照射致死率在 80%~98%的诱变菌株用于初筛,并从紫外照射致死率在85%的处理中成功筛选出诱变菌株 J12,从紫外照射致死率在 97%的处理中获得诱变菌株 J18.实验结果表明该紫外照射致死率范围内的诱变效果理想.
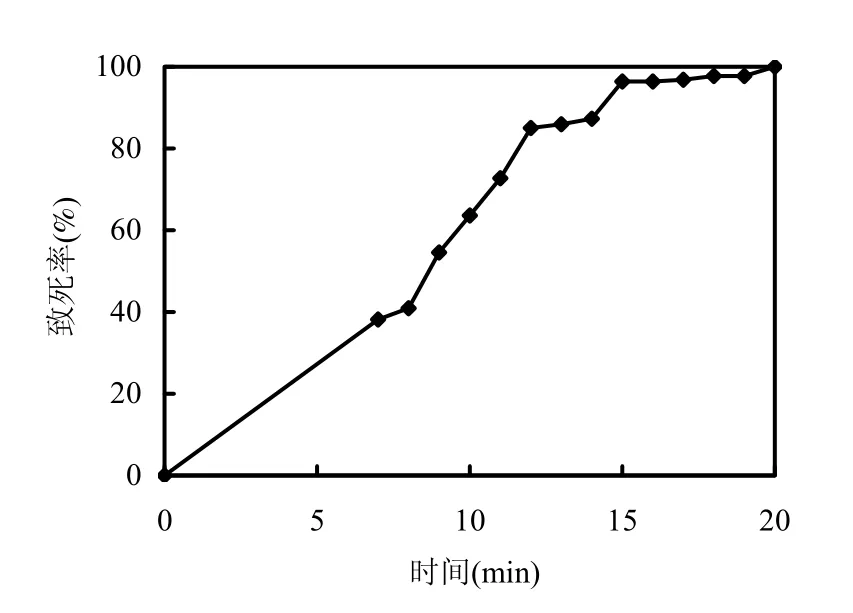
图2 紫外线照射不同时间对原生质体致死率影响Fig.2 Effect of UV irradiation time on the death rate of the protoplast
2.4 诱变菌株筛选
依次重复在鉴别培养基上培养菌株、挑选诱变菌株和传代的过程,传7代后,筛选获得2株诱变菌株J12和诱变菌株J18,它们在鉴别培养基上的褪色及生长情况均优于出发菌株J.
2.5 诱变菌株与出发菌株的形态比较
诱变菌株J18与出发菌株J相比,发生了形态学变化.诱变菌株 J12的孢子形态和菌落形态及大小与出发菌株J相同,未发生变化.
由图3可见,诱变菌株J18的孢子形态为圆形,相对于出发菌株J的椭圆形孢子而言,形态学上发生了很明显的变化.
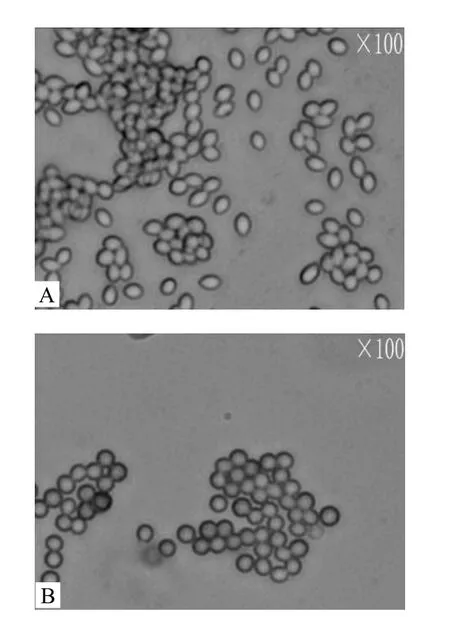
图3 出发菌株J孢子与诱变菌株J18孢子光学显微镜下观察结果Fig.3 The spore morphology of original strain J, mutant strain J18(Seen in light microscope)A.出发菌株J孢子; B.诱变菌株J18
由图4可以看出,培养相同时间后,诱变菌株J18的菌落颜色为深绿色,出发菌株J的菌落颜色为绿色,并且菌落直径要大于出发菌株 J的菌落直径.说明在相同条件下,诱变菌株J18的生长能力更强.
2.6 对木质素降解效果的比较
2.6.1 产木质素降解酶分析 从图5可知,出发菌株J、诱变菌株J12和诱变菌株J18的最大木质素过氧物化物酶酶活都出现在固态发酵的第10d.诱变菌株J18产生最大的木质素过氧化物酶酶活,为67.1U/g,是出发菌株J的最大木质素过氧化物酶酶活48.0U/g的1.40倍,提高了40%,诱变后酶活提高较显著.菌株 J12的最大木质素过氧化物酶酶活为44.4U/g,略低于出发菌株J.
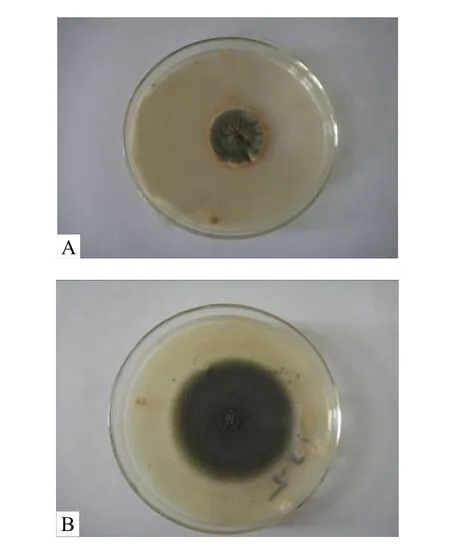
图4 出发菌株J与诱变菌株J18菌落形态Fig.4 Colony morphology of original strain J and mutant strain J18A.出发菌株J; B.诱变菌株J18
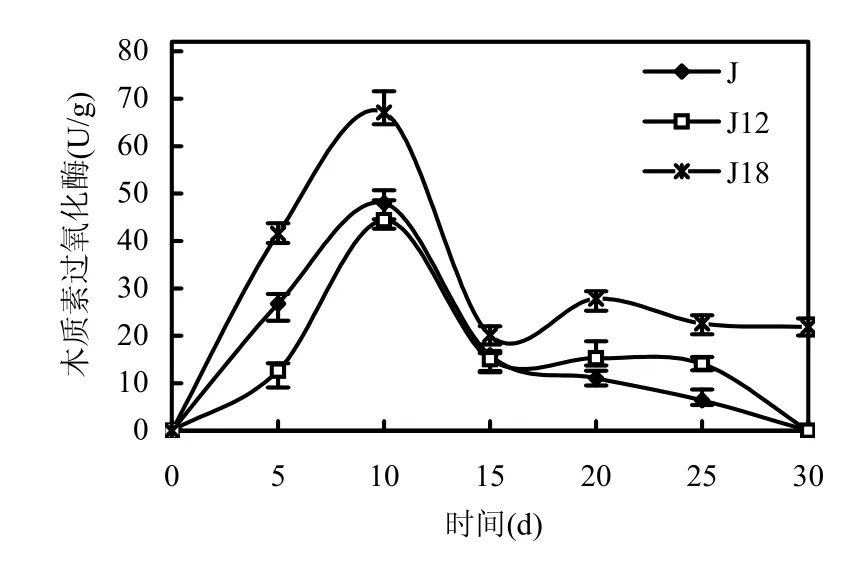
图5 原始株和诱变株木质素过氧化酶酶活比较Fig.5 The activities of Lip of original strain and mutant strains数据为3次测量的平均值
从图6可知,出发菌株J和诱变菌株J12的最大漆酶酶活出现在第20d,诱变菌株J18的最大漆酶酶活出现在第25d.诱变菌株J12的最大漆酶酶活为 44.0U/g,是出发菌株 J的最大漆酶酶活18.0U/g的2.45倍,提高了145%,诱变后酶活提高显著.诱变菌株 J18的最大漆酶酶活为 20.8U/g,是出发菌株J的最大酶活17.9U/g的1.16倍,提高了16%.
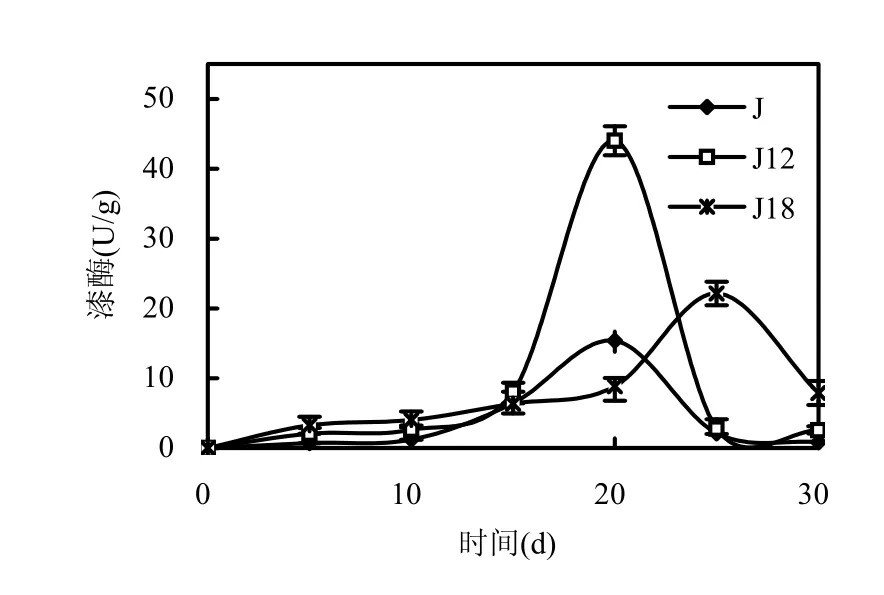
图6 原始株和诱变株漆酶酶活比较Fig.6 The activities of laccase of original strain and mutant strains数据为3次测量的平均值
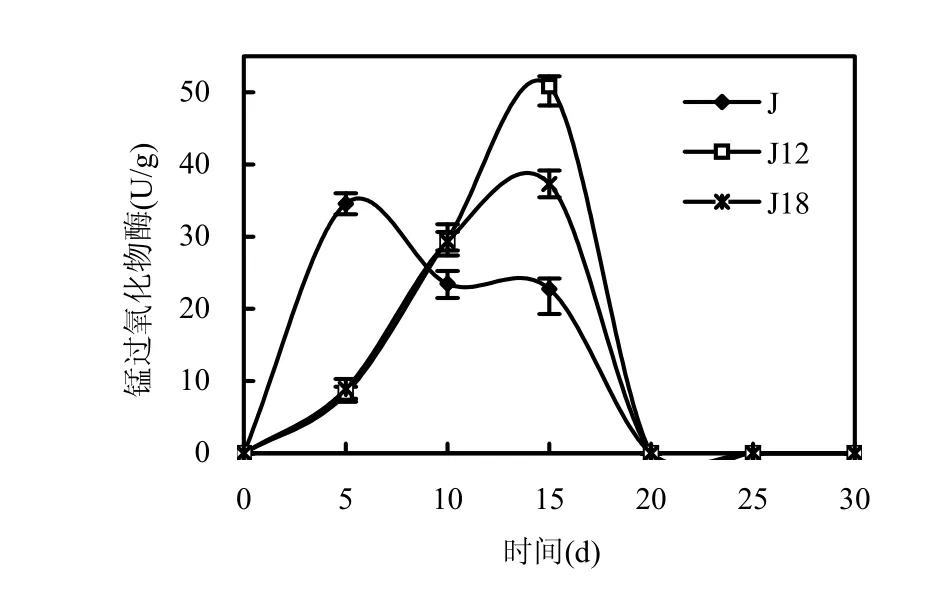
图7 原始株和诱变株锰过氧化物酶酶活比较Fig.7 The activities of Mnp of original strain and mutant strains数据为3次测量的平均值
从图7可知,出发菌株J的最大锰过氧化物酶酶活出现在第5d,诱变菌株J12和诱变菌株J18的最大锰过氧化物酶酶活都出现在第 15d.从第20d开始,出发菌株J及诱变菌株J12、J18均检测不出锰过氧化物酶酶活.诱变菌株 J12的最大锰过氧化物酶酶活为50.8U/g,是出发菌株J的最大锰过氧化物酶酶活34.6U/g的1.47倍,诱变后锰过氧化物酶酶活提高了 47%,诱变后酶活提高较显著.诱变菌株 J18的最大锰过氧化物酶酶活是37.3U/g,略高于出发菌株J.
由表1数据可知,经过7次传代,诱变菌株J18产生的最大木质素过氧化酶酶活、诱变菌株J12产生的最大锰过氧化物酶酶活和最大漆酶酶活相对于出发菌株 J仍然保持有极显著提高(P<0.01),诱变菌株J18产生的漆酶酶活相对于出发菌株J有显著提高(P<0.05),说明诱变菌株J12和诱变菌株 J18的遗传性状稳定.各菌株的木质素过氧化物酶酶活最大值和锰过氧化物酶酶活最大值出现的时间较接近且较早,而漆酶酶活的最大值出现最晚.产生这种现象的原因可能是漆酶对木质素的降解能力要弱于其他 2种木质素降解酶,木质素经过木质素过氧化物酶和锰过氧化物酶一定程度的降解后,将更易于被漆酶降解,是 3种木质素降解酶在降解木质素方面协同作用的表现.
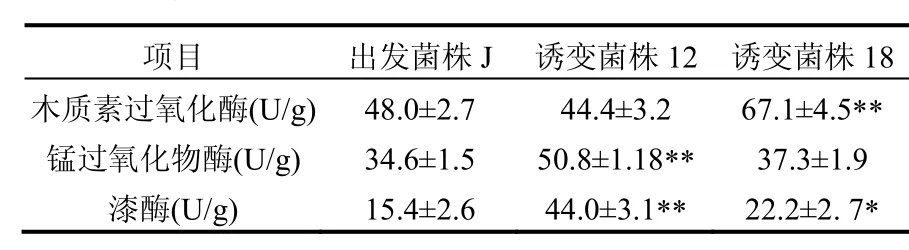
表1 出发菌株与诱变菌株经固态发酵产生的最大木质素降解酶酶活之间比较Table 1 Compared original strain with mutants in highest ligninolytic enzymes by solid fermentation
2.6.2 木质素降解能力的分析及比较 诱变菌株对木质素的实际降解能力如表 2所示,出发菌株J、诱变菌株J12和诱变菌株J18的木质素降解率,依次为9.94%、16.65%和29.63%.相对于出发菌株 J,诱变菌株 J12和诱变菌株J18的木质素降解率分别提高了 67.5%和198.1%,有极显著提高(P<0.01).中性洗涤的去除物主要是指用中性洗涤剂(pH7)消化植物细胞后,溶于中性洗涤剂中的细胞内容物,包括蛋白质、脂肪和无氮浸出物(糖类、淀粉和果胶)等物质.中性洗涤去除物是结构简单的有机物,在固态发酵初期应首先被降解,但经过 30d的固态发酵后,固态发酵培养基中的中性洗涤去除物含量没有减少反而增加,可能是复杂结构的半纤维素、纤维素及木质素被分解后所形成的产物.出发菌株J、诱变菌株J12和诱变菌株J18的中性洗涤去除物提高率,依次为12.85%、 22.48%和 30.80%,有极显著提高(P<0.01).相对于出发菌株J,诱变菌株J12和诱变菌株J18的中性洗涤去除物提高率分别提高了 74.9%和139.7%,有极显著提高(P<0.01).
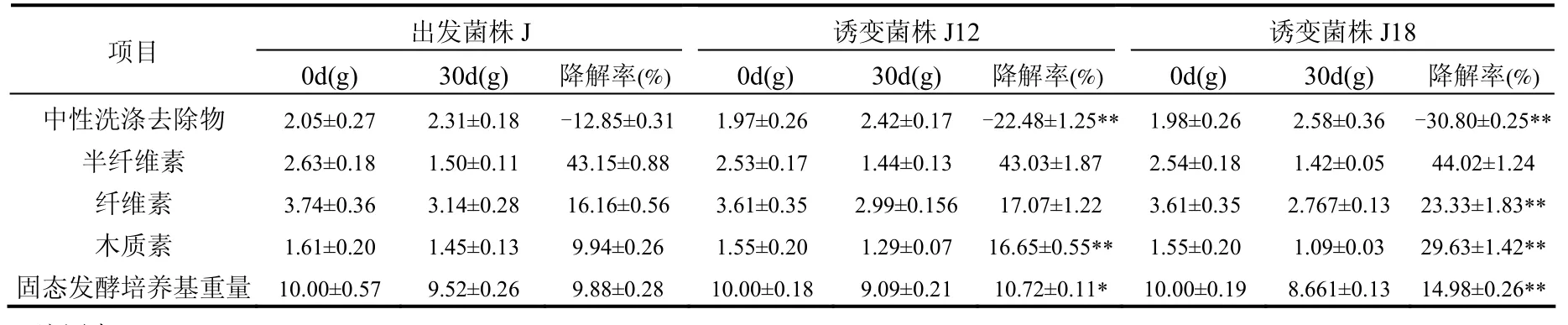
表2 固态发酵前后木质纤维素组分质量变化Table 2 Quality changes of lignocellulose components before and after solid fermentation
2.7 讨论
本实验所用的固态发酵培养基中仅加入了水稻秸秆和蒸馏水,未加入任何其它营养物质或者对水稻秸秆进行任何形式的预处理.经过 30d的固态发酵诱变菌株J12和J18对固态发酵培养基的木质素降解率达到 16.59%和 29.68%.相对于培养天数相同,培养条件相似的菌种Phanerochaete chrysosporium、Pleurotus eryngii、Phlebia radiata、Ceriporiosis subvermispora和Ceriporiopsiss subvermispora对木质素的降解率6%~11%[18-19],诱变菌株J12和J18对木质素的降解效果显著.
由实验结果可知,诱变菌株 J18对木质素降解能力最强,这主要是由于诱变菌株 J18分泌的木质素过氧化物酶酶活最大.自然界中木质素是由非酚结构的木质素单元和酚结构的木质素单元组成的结构复杂的酚类聚合物,其中非酚结构的木质素单元大约占木质素结构单元的90%[7,20],一般情况下,只有木质素过氧化物酶能降解非酚结构的木质素,因此木质素过氧化物酶酶活大小对木质素的降解影响极显著.尽管诱变菌株 J18在漆酶和锰过氧化物酶的提高率上不如诱变菌株 J12,但其对木质素的降解率却要优于诱变菌株 J12.由此可见,本实验中木质素过氧化物酶在对木质素降解中所起的作用要大于其他2种木质素降解酶.中性洗涤去除物可以被用于大部分土壤微生物的初级代谢,因此中性洗涤去除物含量越高,越有利于多种土壤微生物的共生作用和协同作用.经过30d的固态发酵,培养诱变菌株 J18的固态培养基中的中性洗涤去除物增加量是诱变菌株J的2.46倍,有利于土壤中各类微生物利用协同作用对土壤中的木质纤维素进行降解,更易于形成腐殖质,提高土壤的养分.诱变菌株J12的木质素过氧化物酶虽然略低于出发菌株J,但因其漆酶和锰过氧化物酶的酶活要显著高于出发菌株J,因此其对木质素的降解率要明显高于出发菌株 J.由此可见,在本实验中漆酶和锰过氧化物酶对木质素的降解作用虽然没有木质素过氧化物酶大,但其作用不容忽视.诱变菌株 J12尽管对木质素的降解率差于诱变菌株
J18,但其漆酶产量很高,可用于漆酶产生机理的研究和木质素降解酶之间协同作用的研究.
3 结论
3.1 通过对简青霉原生质体进行紫外诱变,显著提高出发菌株 J的木质素降解酶酶活.诱变菌株J12的漆酶酶活提高145%、锰过氧化物酶酶活提高47%.诱变菌株J18的木质素过氧化物酶酶活提高40%.
3.2 诱变后的菌株对木质素的降解能力得到了显著提高.诱变菌株 J18对木质素降解率提高198.1%.诱变菌株 J12对木质素降解率提高67.5%.
3.3 诱变菌株经过7次连续传代接种,对木质素保持高效的降解率,具有遗传稳定性.
3.4 木质素过氧化物酶对木质素的降解能力大于其他2种木质素降解酶,其在木质素降解过程中起主要作用的机理有待作进一步的深入研究.
[1] Novaes E, Kirst M, Chiang V, et al. Lignin and biomass: a negative correlation for wood formation and lignin content in trees [J]. Plant Physiol. ,2010,154(2):555-561.
[2] Guang Ming Zeng,Hong Yan Yu et al. Laccase activities of a soil fungus Penicillium simplicissimum in relation to lignin degradation [J]. World Journal of Microbiology and Biotechnology, 2006,22(4):317.
[3] 郁红艳,曾光明,黄国和,等.简青霉Penicillium simplicissimum木质素降解能力 [J]. 环境科学, 2005,26(2):167-171.
[4] 郁红艳,曾光明,黄国和,等.木质素降解真菌的筛选及产酶特性[J]. 应用与环境生物学报, 2004,10(5):639-642.
[5] Gutarra M L, Godoy M G, Maugeri F, et al. Production of an acidic and thermostable lipase of the mesophilic fungus Penicillium simplicissimum by solid-state fermentation [J]. Bioresour. Technol., 2009,100(21):5249-5254.
[6] Liew C Y, Husaini A. Lignin biodegradation and ligninolytic enzyme studies during biopulping of Acacia mangium wood chips by tropical white rot fungi [J]. World J. Microbiol. Biotechnol., 2011,27:1457-1468.
[7] 池玉杰,伊洪伟.木材白腐菌分解木质素的酶系统-锰过氧化物酶、漆酶和木质素过氧化物酶催化分解木质素的机制 [J]. 菌物学报, 2007,26(1):153-160.
[8] Archibald F S. A new assay for lignin-type peroxidases employing the dye azure B. [J]. Appl. Environ. Microbiol., 1992, 58(9):3110-3116.
[9] 刘卫晓,钞亚鹏,钱世钧.漆酶高产工程菌构建及漆酶对 RBBR的脱色作用 [J]. 生物加工过程, 2004,2(1):21-24.
[10] 钞亚鹏,叶 军.担子菌组成型漆酶产生特性的研究 [J]. 微生物学报, 2000,40(6):628-632.
[11] 施巧琴,吴松刚.工业微生物育种学 [M]. 中国: 科学出版社, 2002:300-303.
[12] Tien M, Kirk T K. Lignin Peroxidase of Phanerochaete chrysosporium [J]. Methods In Enzymology, 1988,161:238-249.
[13] Datta A, Bettermann A, Kirk T K. Identification of a specific manganese peroxidase among ligninolytic enzymes secreted by Phanerochaete chrysosporium during wood decay [J]. Appl. Environ. Microbiol., 1991,57(5):1453-1460.
[14] Buswell J A, Cai Y, Chang S. Effect of nutrient nitrogen and manganese on manganese peroxidase and laccase production by Lentinula (Lentinus) edodes [J]. FEMS Microbiology Letters, 1995,128(1):81-87.
[15] Van Soest P J. Use of detergents in the analysis of fibrous feeds.A rapid method for determination of fiber and lignin [J]. J. Assn.Official Agr. Chem., 1963,46:829.
[16] Van Soest P J. Use of detergents in the analysis of fibrous feeds. Determination of plant cell-wall constituents [J]. J.Assn.Official Agr.chem., 1967,50:50.
[17] 冯 栩,李旭东,曾抗美,等.紫外线诱变提高特效菌的降解性能[J]. 中国环境科学, 2008,28(9):807-812.
[18] Jose D, Gonzalo A, Susana C. Transformation of wheat straw in the course of solid-state fermentation by four ligninolytic basidiomycetes [J]. Enzyme And Microbial Technology, 1999, 25(7):605-612.
[19] Guerra A, Mendonca R, Ferraz A, et al. Structural characterization of lignin during Pinus taeda wood treatment with Ceriporiopsis subvermispora [J]. Appl. Environ. Microbiol., 2004, 70(7):4073-4078.
[20] Tuor U, Wariishi H, Schoemaker H E, Gold M H. Oxidation of phenolic arylglycerol β-aryl ether lignin model compounds by manganese peroxidase from Phanerochaete chrysosporium: oxidative cleavage of an α-carbonyl model compound [J]. Biochemistry, 1992,31:4986-4995.
Improving lignin degradation ability of Penicillium simplicissimum by UV induced protoplast mutagenesis.
SHEN Ying1,2, HU Tian-jue1,2*, ZENG Guang-ming1,2, WU Juan-juan1,2, HUANG Chao1,2, LIU Hui1,2, HUANG Dan-lian1,2, YIN Lu1,2(1.College of Environmental Science and Engineering, Hunan University, Changsha 410082, China;2.Key Laboratory of Environmental Biology and Pollution Control, Ministry of Education, Hunan University, Changsha 410082, China). China Environmental Science, 2012,32(3):485~491
The aim of this study was to obtain new Penicillium simplicissimum mutants with high yield of ligninolytic enzymes. UV induced mutagenesis of protoplast was performed on original strain Penicillium simplicissimum (Oudem.) Thom BGA. Two genetically stable mutant strains J12 and J18 were selected from a large amount of the regenerative mutants. The highest laccase and manganese peroxidase (Mnp) activities produced by strain J12 were 1.45 and 0.47-fold higher than that by original strain, reached 44.0 U/g and 50. 9 U/g, respectively. The highest lignin peroxidase (LiP) activity of 67.1 U/g was obtained by strain J18, which was 0.4-fold increased compared with its original strain. The highest degradation rate of lignin also was obtained by strain J18, which increased 1.98-fold compared with its original strain. Further experiment confirmed after seven generations successively propagating the activity of strain J12 and strain J18 were stable and did not decrease generally.
Penicillium simplicissimum;mutagenesis;biodegradation;lignin
X705
A
1000-6923(2012)03-0485-07
2011-06-22
湖南省自然科学基金(07JJ5053);湖南省高校创新平台开放基金项目(11K013);中央高校基本科研业务费
* 责任作者, 副教授, hutj66@yahoo.com.cn
沈 莹(1982-),女,辽宁鞍山人,湖南大学环境科学与工程学院硕士研究生,主要研究方向为微生物对有机固体废物的降解.发表论文2篇.
