变应性鼻炎大鼠模型的建立
2012-12-07宋建明黄秀清林燕惠
宋建明,黄秀清,林燕惠,张 敏
(1.莆田学院医学院临床医学系,福建 莆田351100;2.莆田学院医学院生理学教研室,福建 莆田351100)
变应性鼻炎大鼠模型的建立
宋建明1,黄秀清1,林燕惠1,张 敏2
(1.莆田学院医学院临床医学系,福建 莆田351100;2.莆田学院医学院生理学教研室,福建 莆田351100)
目的:建立变应性鼻炎 (AR)Wistar大鼠模型,探讨呼吸道变应性炎症的发病机制,为临床治疗AR提供实验依据。方法:将30只Wistar大鼠随机分成模型组、正常组和地塞米松 (DEX)组,每组10只。模型组大鼠经腹腔注射卵清蛋白 (OVA)变应原,鼻腔滴入OVA鼻内激发;正常组大鼠以生理盐水替代OVA;DEX组大鼠激发成AR后再用DEX (0.2mL·kg-1)后肢肌肉注射,观察大鼠行为学症状;采用HE染色和免疫组织化学染色法检测大鼠鼻黏膜组织学变化、嗜酸性粒细胞计数及其鼻黏膜免疫球蛋白E(IgE)的吸光度(A)值。结果:模型组大鼠均出现鼻痒、喷嚏和流清涕等AR的临床特征,大鼠鼻黏膜可见大量的嗜酸性粒细胞、淋巴细胞浸润,黏膜水肿增厚、腺体增生、分泌旺盛和鼻黏膜表面纤毛破坏等组织形态学变化。正常组大鼠仅轻度抓鼻,且喷嚏少。DEX组Wistar大鼠小血管无明显扩张,黏膜厚度较模型组明显降低,炎性细胞浸润程度减轻。模型组和DEX组大鼠嗜酸性粒细胞计数及其A值均高于正常组 (P<0.05),DEX组大鼠鼻黏膜中嗜酸性粒细胞计数及A值均低于模型组 (P<0.05)。结论:成功建立OVA变应原致敏的AR Wistar大鼠模型。
变应性鼻炎;疾病模型,动物;卵清蛋白;嗜酸性粒细胞;免疫球蛋白E
变应性鼻炎 (allergic rhinitis,AR)是发生在鼻黏膜的变态反应性疾病,是主要由IgE介导的I型变态反应。AR是变应原致敏激发产生一系列生化反应,导致黏膜的各种病理改变,包括毛细血管通透性增高、黏膜水肿、多形核细胞和单核细胞浸润的一种慢性鼻黏膜炎症性疾病。近几十年来,由于人们生活方式的改变和环境污染的加重,该病的发病率呈现逐年上升的趋势[1]。AR发病机制十分复杂,国内外众多学者对AR的研究[2-4]均是通过实验性动物模型实现的。豚鼠是最早被用来建立变应性模型的动物,早在1988年 Tanaka等[5]就利用甲苯二异氰酸酯建立豚鼠AR模型。本研究以Wistar大鼠为研究对象,通过注射卵清蛋白(ovalbumin,OVA)变应原致敏,观察大鼠行为学表现和组织学的改变,旨在制备实验性AR模型,为进一步探讨呼吸道变应性炎症的发病机制及临床研究提供基础。
1 材料与方法
1.1 动物、主要试剂及仪器 30只健康 Wistar大鼠购自福建医科大学实验动物中心,SPF级,5~6周龄,体质量120~150g,随机分为正常组、模型组和地塞米松 (dexamethasone,DEX)组,每组10只。实验动物分笼饲养,饲以标准颗粒饲料,在空调动物房饲养,饲养房避免过敏原存在,早晚12h间断照明,温度保持在18~25℃。OVA(美国Sigma公司);氢氧化铝、10%水合氯醛(北京化学试剂公司);DEX注射液、IgE (美国R&D公司);SP二步法试剂盒 (北京中杉金桥生物技术有限公司);DAB显色试剂 (北京中杉金桥生物技术有限公司);光学显微镜 (上海仪圆光学仪器有限公司);可调移液器 (芬兰Finnpipette Digital公司);5mL注射器、电子天平 (英国A1003Pharmacia Biotech公司)。
1.2 动物分组及给药[6-7]基础致敏过程:模型组,0.3mg OVA加15mg Al(OH)3混于1mL生理盐水中,按大鼠体质量隔日行腹腔注射,共14d;正常组,以等量生理盐水替代OVA混悬液,按大鼠体质量隔日行腹腔注射,共14d;DEX组,基础致敏的方法和步骤同模型组。激发阶段:模型组,以0.1g·L-1OVA每日滴鼻维持过敏状态,共7d;正常组,用生理盐水代替OVA每日滴鼻,共7d;DEX组,用0.1g·L-1OVA每日滴鼻,同时用0.2mL·kg-1DEX后肢肌肉注射,共7d。
1.3 大鼠AR模型成功判定标准 通过激发实验,模型大鼠会出现打喷嚏、挠鼻、抓脸和鼻溢等症状。赵秀杰等[8]在给药后30min内对上述症状建立了评分系统。鼻痒:轻度为1分,轻擦鼻几次;重度为2分,抓挠鼻、面不止,到处擦磨。喷嚏:1~3个为1分,4~10个为2分,11个以上为3分。清涕:流到鼻前孔为1分,过鼻前孔为2分,流涕满面为3分。以叠加法记录总分,总分超过5分即为建模成功。
1.4 AS标本制备 大鼠末次激发24h后,用10%水合氯醛 (300mg·kg-1)行腹腔注射,麻醉后将大鼠心脏放血处死,迅速打开鼻背,剥去上颌骨部皮肤,沿右侧鼻中隔外侧前庭壁剪断,向上翻开暴露鼻中隔和双侧鼻腔,取双侧鼻中隔黏膜,固定于10%中性甲醛溶液中过夜后,先后放在20%和30%蔗糖溶液中分别过夜,然后制成切片,进行免疫组织化学染色。
1.5 免疫组织化学染色观察各组大鼠嗜酸性粒细胞 采用SP法染色,切片经常规脱蜡、水化,3%H2O2室温10min,微波抗原修复10min,冷却,PBS冲洗,非免疫血清封闭20min,PBS冲洗,加一抗 (IgE 1∶200)4℃过夜;滴加生物素化二抗室温静置20min,PBS冲洗,滴加100μL新配制的DAB液,显微镜下观察,显色约2min、双蒸馏水冲洗、苏木精复染、脱水、透明和封片,光镜下观察各组大鼠嗜酸性粒细胞计数及其IgE的吸光度 (A)值。
1.6 免疫组织化学法测定IgE吸光度 (A)值采用免疫组织化学法检测各组大鼠反应切片中选取的形态典型的对应切面,所得图像经SimpPCI图像分析系统分析。在不同鼻黏膜切片间测量相同解剖结构区,每一解剖区各测5个点,每个测量点测量的像素量 (即被测量面积)保持一致。以上每个解剖区测量值总和的平均值即为鼻黏膜结构区域的最终A值,通过A值间接反映大鼠鼻黏膜表面IgE的表达水平。
1.7 统计学分析 采用SPSS 10.0统计软件进行数据分析。各组大鼠行为学评分、鼻黏膜嗜酸性粒细胞计数及其IgE的A值以±s表示,组间比较采用单因素方差分析。
2 结 果
2.1 各组大鼠行为学表现 模型组10只 Wistar大鼠打喷嚏均多于11个,持续抓鼻,脸部布满鼻分泌物,总评分 >5分。DEX组大鼠致敏期和激发第1次开始出现明显的抓鼻、打喷嚏和流鼻涕症状,总评分>5分,激发后期,症状逐渐缓解;DEX组大鼠的鼻喷嚏平均次数较模型组的鼻喷嚏平均次数明显减少。正常组10只Wistar大鼠仅有轻度抓鼻,且喷嚏少,总评分 <5分。各组大鼠症状评分变化见表1。
表1 各组大鼠行为学症状评分Tab.1 The behavior symptom scores of rats in various groups (n=10,±s)
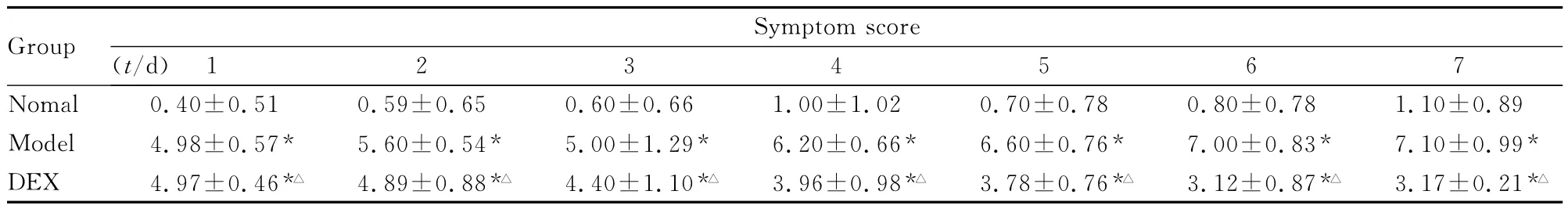
表1 各组大鼠行为学症状评分Tab.1 The behavior symptom scores of rats in various groups (n=10,±s)
*P<0.05compared with nomal group;△P<0.05compared with model group.
Group Symp 02 0.70±0.78 0.80±0.78 1.10±0.89 Model 4.98±0.57* 5.60±0.54* 5.00±1.29* 6.20±0.66* 6.60±0.76* 7.00±0.83* 7.10±0.99*DEX 4.97±0.46*△ 4.89±0.88*△ 4.40±1.10*△ 3.96±0.98*△ 3.78±0.76*△ 3.12±0.87*△ 3.17±0.21*1 2 3 4 5 6 7 Nomal 0.40±0.51 0.59±0.65 0.60±0.66 1.00±1.tom score(t/d)△
2.2 各组大鼠鼻黏膜组织学表现 模型组大鼠鼻黏膜组织中有大量嗜酸性粒细胞和其他炎性细胞浸润,上皮细胞有脱落,杯状细胞化生、肥大,黏膜间质水肿增高,腺体增生肥大、分泌旺盛且鼻黏膜表面纤毛破坏等。正常组大鼠鼻黏膜上皮完整,呈柱状排列,未见嗜酸性粒细胞和其他炎症细胞浸润。DEX组大鼠小血管无明显扩张,黏膜厚度较模型组明显降低,炎性细胞浸润程度减轻。见图1(插页三)。
2.3 各组大鼠嗜酸性粒细胞计数和鼻黏膜IgE表达平均A值 模型组和DEX组大鼠嗜酸性粒细胞计数和A值均高于正常组 (P<0.05);DEX组大鼠鼻黏膜中嗜酸性粒细胞计数和A值低于模型组(P<0.05)。见表2和图2 (插页三)。
表2 各组大鼠鼻黏膜嗜酸性粒细胞计数和IgE表达A值Tab.2 The numbers of eosinophile granulocytes and A values of IgE of rats in various groups (n=10,±s)

表2 各组大鼠鼻黏膜嗜酸性粒细胞计数和IgE表达A值Tab.2 The numbers of eosinophile granulocytes and A values of IgE of rats in various groups (n=10,±s)
*P<0.05compared with nomal group;△P<0.05compared with model group.
Group No.of eosinophile granulcoytes A value of IgE Nomal 0.45±0.56 22.46±1.46 Model 11.78±2.24* 39.56±4.58*DEX 7.12±2.12*△ 25.34±4.43*△
3 讨 论
建立有效可行的大鼠AR模型,可以更有效地研究该疾病的发病机制,克服人体实验的局限性。目前国内外制备AR模型尚未统一和标准化,造模使用的致敏原、免疫佐剂致敏和激发的方法、途径和试剂等也不完全相同。致敏原有真菌性抗原致敏[9]、豚草花粉变应原致敏[10]等。本实验中模型组大鼠经OVA长期刺激,产生过敏反应,使鼻部黏膜炎症长期存在,促进了IgE的合成并使组织内嗜酸性粒细胞的数量增加[11-13],表现为鼻黏膜组织中有大量嗜酸性粒细胞和其他炎性细胞浸润,上皮细胞脱落,杯状细胞化生、肥大,黏膜间质水肿加重,腺体增生肥大、分泌旺盛,鼻黏膜表面纤毛破坏等,鼻黏膜部的IgE的A值高于正常组。DEX组大鼠中,DEX可抑制白细胞的黏附,降低免疫蛋白超家族黏附分子1/黏合素分子1(ICAM-1/LFA-1)间相互作用,使AR的症状得到一定的缓解,同时DEX防止或抑制细胞介导的免疫反应,减少嗜酸性细胞的数目,使DEX组大鼠鼻黏膜中嗜酸性粒细胞计数低于模型组,与模型组和正常组比较,DEX组大鼠的症状较轻,同时大鼠鼻黏膜部IgE的含量较模型组大鼠降低。
通过动物疾病模型来研究人类疾病,可以观察到无法在患者身上进行实验的各种致病因素对人体的作用,同时还可克服人类疾病发生、发展缓慢,潜伏期长,发病原因多样,经常伴有各种其他疾病等因素的干扰,可以用单一的病因,在短时间内复制出典型的动物疾病模型。动物模型是研究人类各种疾病的发生、发展规律和疾病防治的重要工具之一。
[1]Knipping S,Holzhausen HJ,Riederer A,et al.Immunoelectron microscopic findings in patients with allergic rhinitis [J].Laryngorhinootologie,2002,81(12):861-865.
[2]顾之燕.呼吸道炎症反应 [J].中华耳鼻咽喉科杂志,2001,36 (5):397-399.
[3]张 罗,周 炎,韩德民,等.变应性鼻炎研究进展 (一):发病机制 [J].耳鼻咽喉头颈外科杂志,2003,10(5):316-320.
[4]佘文煜,董 震.实验性变应性鼻炎鼻黏膜组织的特点 [J].中华耳鼻咽喉头颈外科杂志,2006,41(1):48-53.
[5]Tanaka K,Okamoto Y,Nagaya Y,et al.A nasal allergy nodel developed in the guinea pig by intranasal application of 2,4-Toluene disocy-anate [J].Int Arch Allergy Appl Immunol,1988,85 (4):392-397.
[6]赵 宇,van Hasselt CA,吴港生,等.卵白蛋白经鼻致敏建立变应性鼻炎动物模型 [J].中华耳鼻咽喉头颈外科杂志,2005,4 (3):176-180.
[7]Robert J,Ho M,Jack A.Airway remodeling in asthma:therapeutic implications of mechanisms [J].Physiology,2005,20 (1):28-35.
[8]刘建国,杨 政,刘月辉.变应性鼻炎大鼠模型建造 [J].江西医学院学报,2008,48 (5):33-34.
[9]张志明.真菌性抗原致变应性鼻炎豚鼠模型建立 [J].中国耳鼻咽喉头颈外科,2005,12(5):313.
[10]余洪猛,文三立.豚草花粉变应性过敏性鼻炎豚鼠模型的建立 [J].上海实验动物科学,2001,21(4):212.
[11]孔 红.细胞黏附分子和变应性鼻炎 [J].国外医学:耳鼻咽喉科分册,1999,22 (2):92-94.
[12]Watanabe T,Okano M, Hattori H,et al.Roles of fcgammaRIIB in nasal eosinophilia and IgE production in murine allergic rhinitis [J].Am J Res pir Crit Care Med,2004,169 (1):105-112.
[13]Diarme CW,Andrew NJ,Aulikki ML,et al.Integrated signals between IL-13,IL-4,and IL-5regulate airways hyperreactivity [J].J Immunol,2000,165 (1):108-113.
Establishment of allergic rhinitis models of rats
SONG Jian-ming1,HUANG Xiu-qing1,LIN Yan-hui1,ZHANG-Min2
(1.Department of Clinical Medicine,College of Medical Sciences,Putian University,Putian 351100,China;2.Department of Physiology,College of Medical Sciences,Putian University,Putian 351100,China)
ObjectiveTo establish allergic rhinitis(AR)models of Wistar rats,and to discuss the pathogenesis of allergic inflammation of respiratory tract,and to provide basis for clinical treatment of AR.Methods30Wistar rats were randomly divided into model group (n=10),normal group (n=10)and dexamethasone (DEX)group(n=10).The rats in model group were immunized intraperitoneally with ovalbumin (OVA),followed by intranasal administration of OVA;and the rats in normal group were adminstrated with saline instead of OVA;the rats in DEX group were challenged into AR,then they were injected with 0.2mL·kg-1dexamethasone muscle of hind legs.The behavioral symptoms,histological changes of nasal mucosa,the number of eosinophile granulocytes and the expression levels of IgE were detected by HE staining and immunohistochemical methods.ResultsThe AR symptoms,such as nasal itching,sneezing,and rhinorrhea of the rats in model group were observed.There were a lot of histological changes,such as eosinophile granulocytes,lymphocytes,edema of the mucosa,gland hyperplasia,strong secretion,and cilia destruction on nasal surface of the rats in model group.There were only mild grasping nose and a small amount of sneezing of the rats in normal group.The small blood vessels of the rats in DEX group had no significant expansion,the mucosal thickness was lower than that in model group and the degree of inflammatory cell infiltration was alleviated.The numbers of eosinophile granulocytes and their A values of the rats in DEX group and model group were higher than those in nomal group (P<0.05).The number of eosinophile granulocytes and its A value of the rats in DEX group were lower than those in model group (P<0.05).ConclusionThe AR rat model induced by OVA is established successfully.
allergic rhinitis;disease model,animal;ovalbumin;eosinophile granulocytes;immunoglobutin
R765.21
A
1671-587Ⅹ(2012)06-1152-04
2012-05-06
福建省莆田市科技局科研基金资助课题 (2010G06);莆田学院创新实验项目资助课题 (2010P11352)
宋建明 (1988-),男,福建省莆田市人,医学本科,主要从事变应性鼻炎的发病机制方面的研究。
张 敏 (Tel:0594-2694201,E-mail:zm5995@sina.com)
