异辛烷/正庚烷/乙醇三组分燃料着火的化学动力学模型
2012-11-30钟北京
郑 东 钟北京
(清华大学航天航空学院,北京100084)
异辛烷/正庚烷/乙醇三组分燃料着火的化学动力学模型
郑 东 钟北京*
(清华大学航天航空学院,北京100084)
提出一个包括异辛烷、正庚烷和乙醇的三组分燃料的着火动力学模型,该机理包括50个组分和193个反应.通过路径分析和灵敏度分析,给出了基础燃料在高低温条件下的不同反应路径和影响氧化过程的重要基元反应.该机理预测的单组分(异辛烷、正庚烷、乙醇)燃料、双组分基础燃料和三组分燃料的点火延迟时间与实验值有很高一致性.本文机理包含较少的组分数与反应数,因而可适用汽油掺烧乙醇的多维计算流体动力学(CFD)数值模拟.
替代燃料;基础燃料;着火延迟时间;机理;乙醇
1 引言
随着化石燃料的日渐匮乏和环境问题的日益尖锐,替代燃料和新型的燃烧方式成为能源动力领域研究的主流.乙醇作为一种可再生的含氧生物替代燃料,以其良好的燃烧和排放性能备受青睐.其中汽油掺烧乙醇广受关注,表1为乙醇和汽油特性的对比.1可以看出乙醇含氧量较高,有利于降低CO、未燃烧碳氢化物和碳烟等污染物的排放.许多研究表明,2-6汽油添加乙醇燃烧能够改善其污染物排放特性.Lemaire等4的实验表明,汽油添加10%-30%的乙醇可以使碳烟前驱物和碳烟总量减少25%-81%.宋崇林等5的研究显示,汽油掺烧乙醇后苯排放降低,并且随着添加比例的增大,苯排放改善更明显,掺烧体积分数为9.8%的乙醇对苯排放的改善程度达50%.乙醇的辛烷值较高,汽油内燃机添加乙醇后可以进一步提高压缩比,使得热效率提高.要实现汽油掺烧乙醇的数值模拟,就需要提出包含汽油和乙醇的多组分燃料机理.由于汽油是包含上千种燃料的混合物,且其成分也因产地不同而有所差异,因此需要找到一种或者几种纯组分燃料替代汽油,并且能够很好地再现汽油的燃烧特性.基础燃料(PRF),即异辛烷和正庚烷两组分的混合燃料,普遍用来代替不同辛烷值的汽油,在内燃机数值模拟中得到广泛的应用.7目前常用的基础燃料的反应机理概况如表2所示.8-13

表1 乙醇和汽油特性的对比Table 1 Comparison of gasoline and ethanol properties
Shell8和Cox9等经验模型只能描述着火前阶段的情况,无法反映中间产物变化和整个燃烧过程. Tanaka简化模型10虽然基本上可以描述整个燃烧过程,但是高温反应用4个总包反应直接生成CO、H2O、H2O2和HO2,忽略了大分子的高温裂解过程,难以预测燃烧过程的排放特性.Tsurushima11给出了一个骨架机理,其低温反应来自于Tanaka简化模型,并添加和修正了部分反应,这样在一定程度上考虑了大分子高温裂解.Ra简化模型12是在Curran详细机理13基础上分析简化得到的,此模型能够较为准确地计算着火延迟时间、缸压、释热率.Curran等13给出了一个非常详细的机理,能够很好地描述着火燃烧过程.
描述汽油燃烧的多组分反应机理也有少量研究,如Andrae14提出的包括异辛烷、正庚烷、乙醇、甲苯、二异丁烯五组分混合燃料的详细机理(1121组分、4961反应)和简化机理15(142组分、672反应).包括异辛烷、正庚烷、甲苯的三组分燃料(TRF)也常作为汽油替代燃料.目前常用的TRF机理有Andrae等提出的详细机理16和简化机理17,Anderlohr等发展的模型,18Sakai等提出的模型19和张等人提出的模型.20其中张等人提出的TRF模型20较小,包括70组分、196反应.由于五组分机理组分数和反应数都比较大,不太适用于计算流体动力学(CFD)的耦合计算,而TRF机理不包含乙醇.因此,本文在考虑汽油掺烧乙醇时,在上述基础燃料的基础上通过增加乙醇的反应,首先提出了包含较少组分和反应的三组分反应动力学机理,然后通过与实验结果的比较对该机理进行了验证.
2 三组分燃料机理的构建
2.1 三组分燃料机理的初步构建
在构建异辛烷/正庚烷/乙醇三组分燃料机理时,首先确定基础燃料的反应机理.在基础燃料选择时,不仅要考虑机理的准确性,还要考虑机理规模的大小.虽然Curran详细机理13能够较为准确地预测燃烧特性和中间产物,但是由于机理过于庞大,难以用于CFD耦合计算.Ra机理12虽然规模较小,仅包含41组分和130反应,但该机理能较为准确地计算着火延迟时间、缸压、释热率,而且包含较多的C2
-C4反应,能够反映燃烧过程中小碳分子的变化.因此,本文初步选择Ra的反应机理作为基础燃料的机理.本文的基础燃料命名按照常用PRF加辛烷值的方式,例如PRF60,指基础燃料中异辛烷和正庚烷体积分数分别是60%和40%.
其次,我们通过对Marinov详细乙醇机理21进行反应路径分析,如图1所示,取节点上组分的相关反应,构成了乙醇部分反应机理.由于在Ra机理中包含了C2H4、CH3、CH2CO等小分子反应,所以在乙醇部分机理中就不用再包含这些反应了.这样将提出的乙醇部分反应机理与Ra机理整合,初步得到三组分燃料的着火反应动力学机理.
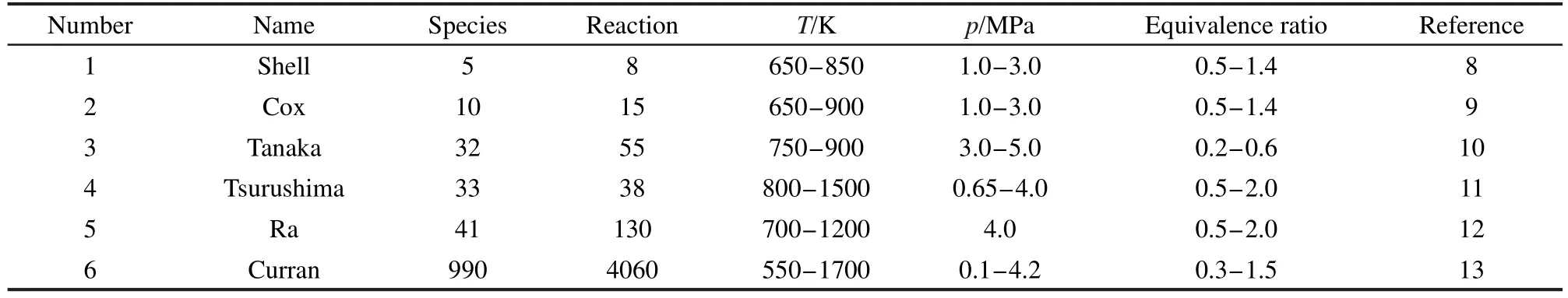
表2 基础燃料(PRF)机理Table 2 Primary reference fuel(PRF)mechanisms
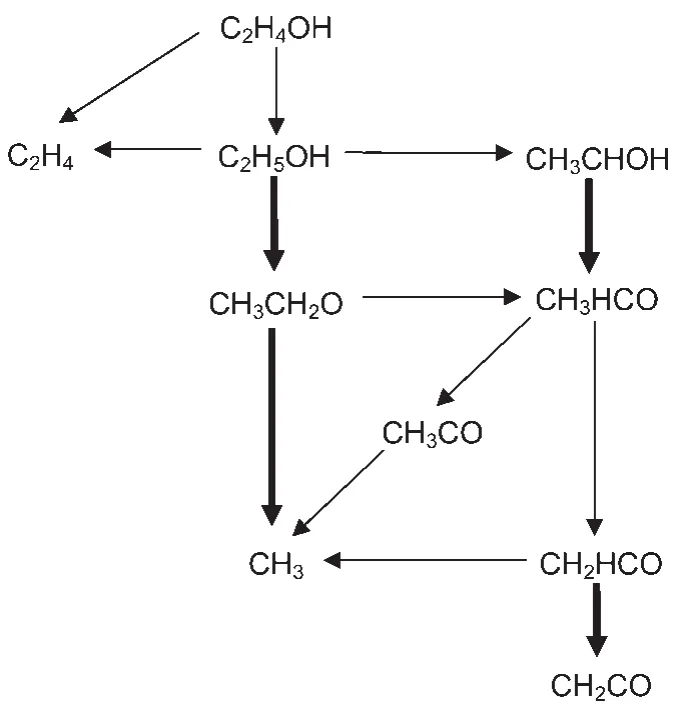
图1 乙醇氧化部分反应路径Fig.1 Major reaction branches of ethanol oxidation
2.2 三组分燃料机理的修正

图2 未修正三组分机理在不同初始温度下计算的着火延迟时间与实验结果22,23比较Fig.2 Comparison of experimental22,23and calculated ignition delay time using uncorrected three-component mechanism at different initial temperatures(a)PRF,conditions:equivalence ratio=1(in air);p=4.0 MPa. (b)ethanol,conditions:p=0.35 MPa; volume fractions,C2H5OH 1.25%,O23.75%,Ar 95%
使用上述构建的三组分燃料机理分别对异辛烷、正庚烷和乙醇纯组分燃料的着火延迟时间进行了初步计算,计算与实验结果22,23对比如图2所示.由图可见,计算得到的异辛烷、正庚烷和乙醇着火延迟时间在高温区与实验结果符合较好,但在低温区存在较大的差别,尤其是正庚烷和乙醇.这说明无论是基础燃料机理,还是乙醇机理都存在一定的缺陷,因此需要对上述三组分燃料机理进行适当的修正与调整.
机理修正的基本原则就是调整对低温着火过程有较大影响,而对高温过程影响甚微的基元反应.通常是通过化学反应的灵敏度分析和路径分析来找到这些基元反应.对燃料着火时刻进行温度的灵敏度分析,分别取灵敏度系数最大的前10个反应.灵敏度系数为正的反应对燃料氧化过程起促进作用,灵敏度系数为负的反应对燃料氧化过程起抑制作用.
首先分析三组分燃料机理中异辛烷和正庚烷氧化反应路径.图3为异辛烷氧化反应的主要路径.在低温区异辛烷的主要反应途径如图3(a)所示.异辛烷分子中的氢原子首先被OH基夺走生成异辛烷基(R2、R3),接着异辛烷基与氧气加成产生过氧烷基(R5),然后过氧烷基与氧气加成产生过氧化氢酮和OH基(R6),R6生成的OH基又参与R2反应,从而形成由R2、R3、R5、R6构成的一个放出大量热量的低温反应循环.随着温度的升高,过氧化氢酮又会发生分解,生成OH基(R7),此时反应系统进入快速反应阶段.当系统温度进一步升高,支链反应R45 (H2O2+M=OH+OH+M)迅速加快,发生热爆炸反应,此时系统进入了如图3(b)所示的高温反应阶段,因此温度迅速升高.分析这个反应过程,可以得到影响异辛烷低温氧化过程的主要基元反应为R2、R5、R6和R7.

图3 异辛烷氧化反应路径Fig.3 Major reaction branches of iso-octane oxidation(a)low temperature,(b)high temperature
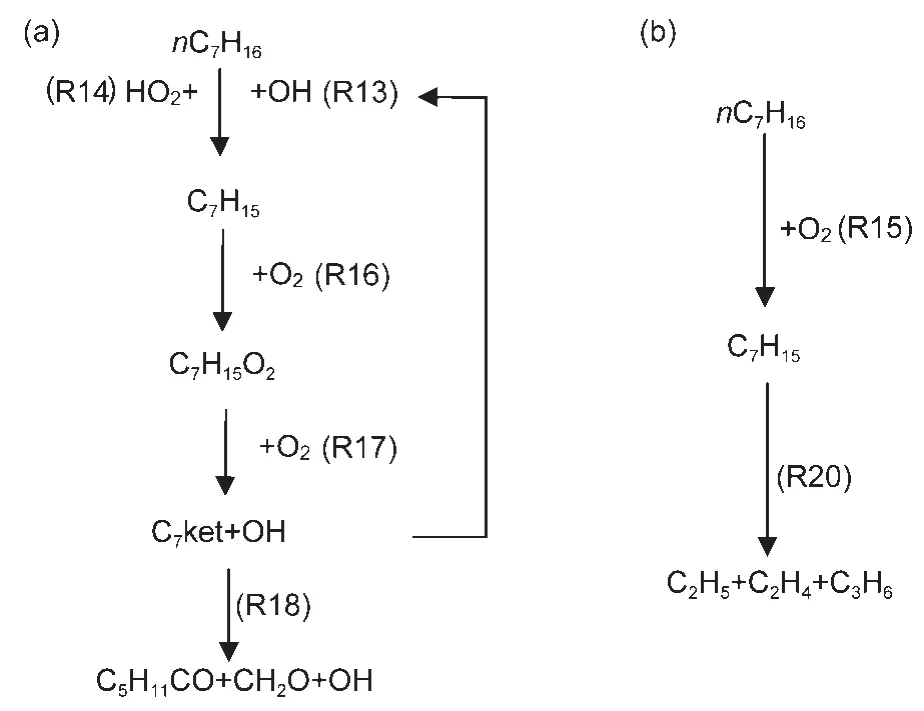
图4 正庚烷氧化反应路径Fig.4 Major reaction branches of n-heptane oxidation(a)low temperature,(b)high temperature
图4给出了正庚烷氧化反应的主要路径.正庚烷氧化反应的主要路径与异辛烷极其相似,这里就不再重复描述了.分析反应过程,同样可以得到影响正庚烷低温氧化过程的主要基元反应为R13、R16、R17和R18.
在反应途径分析的基础上,进一步对异辛烷和正庚烷在低温(700 K)和高温(1250 K)区的反应进行温度的灵敏度分析.图5给出了异辛烷在高、低温条件下的温度灵敏度分析结果.可以看出,反应R5、R7、R52对异辛烷低温氧化过程有较大影响,而对高温过程影响甚微.
图6给出了正庚烷在高、低温条件下的温度灵敏度分析结果.由图不难看出,反应R17、R18对正庚烷低温氧化过程有较大影响,而对高温过程的影响较小.
综合上述反应路径分析和温度的灵敏度分析可得,对异辛烷而言基元反应R5不仅对低温氧化速度有较大影响,而且对低温区系统温升也有较大影响.对正庚烷而言基元反应R17、R18对低温氧化过程影响较大.基元反应R52对异辛烷和正庚烷低温氧化都有很大的负影响.因此,对上述四个基元反应的动力学参数指前因子A进行了适当的调整.
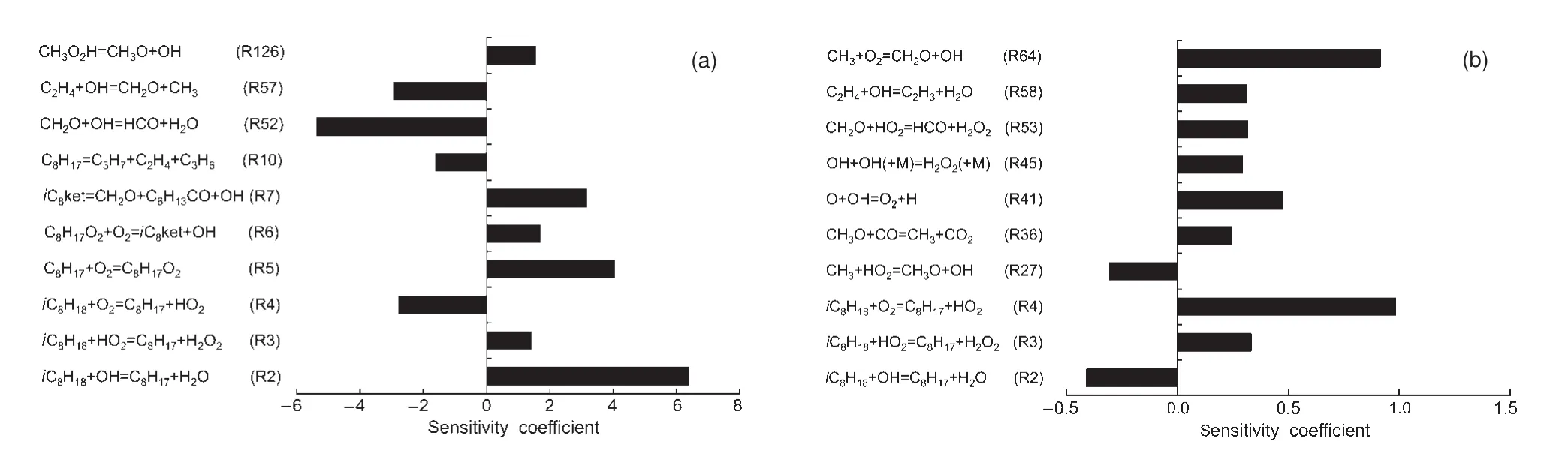
图5 不同初始温度下异辛烷温度灵敏度系数Fig.5 iso-Octane sensitivity coefficients at different initial temperatures (a)low temperature,(b)high temperature
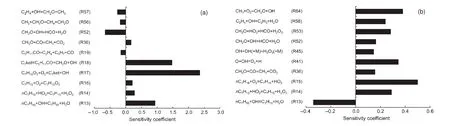
图6 正庚烷高、低温温度灵敏度分析Fig.6 n-Heptane sensitivity coefficients at different initial temperatures(a)low temperature,(b)high temperature
基元反应指前因子的调整需要考虑调整方向(即增大/减小)和调整量.根据上述分析,R5和R52指前因子的调整标准是调整后的机理能够准确计算异辛烷着火延迟时间.R5和R52指前因子调整方向分别是增大和减小,至于调整量需要经过多次实验,才能找到合适调整量.R17和R18指前因子调整的标准是调整后的机理能够准确计算正庚烷着火延迟时间.R17和R18指前因子调整方向都是增大,调整量同样需要经过多次试验,才能找到合适调整量.
乙醇机理的调整方法与上述基础燃料机理调整方法一致,通过路径分析和灵敏度分析找出对低温着火过程有较大影响而对高温过程影响甚微的基元反应.同时为了不影响已经修正的基础燃料机理,需选择乙醇氧化为C2H4、CH3、CH2CO等小分子的反应,并对其动力学参数指前因子进行了适当的调整.对异辛烷、正庚烷以及乙醇反应机理进行修正的基元反应及其动力学参数指前因子如表3所示.
经过上述调整与修改,三组分燃料反应机理包含50组分和193个基元反应(见Supporing Information).该机理能够描述异辛烷、正庚烷和乙醇三组分燃料的着火过程.使用修正后的机理对异辛烷、正庚烷和乙醇的着火延迟时间进行了重新计算,计算结果与实验结果的对比如图7所示,显然调整之后的机理能够更准确地预测燃料的着火延迟时间.
3 三组分燃料机理的验证
验证一个反应动力学机理有效性的重要标志就是对着火延迟时间的准确预测,本文详细地比较了单组分、PRF、三组分的着火延迟时间.计算使用化学反应动力学程序CHEMKIN,24为着重研究反应机理,计算中均采用零维绝热模型,忽略流动换热等因素影响.用于对比着火延迟时间的实验数据均来自激波管实验,在激波管模拟计算中,假定激波过后激波管内气体反应在定容、匀质绝热的条件下进行.
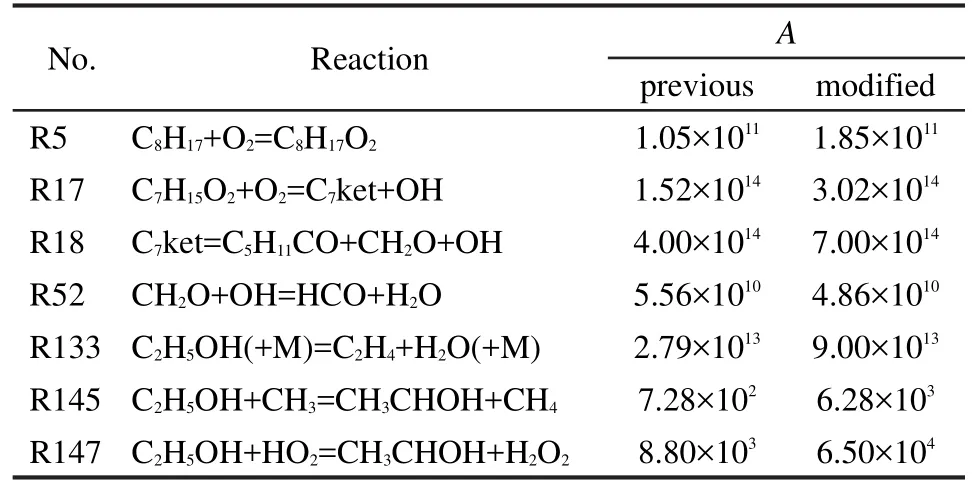
表3 修正的基元反应及其动力学参数指前因子ATable 3 Modified elementary reaction and kinetic parameter pre-exponential factorsA
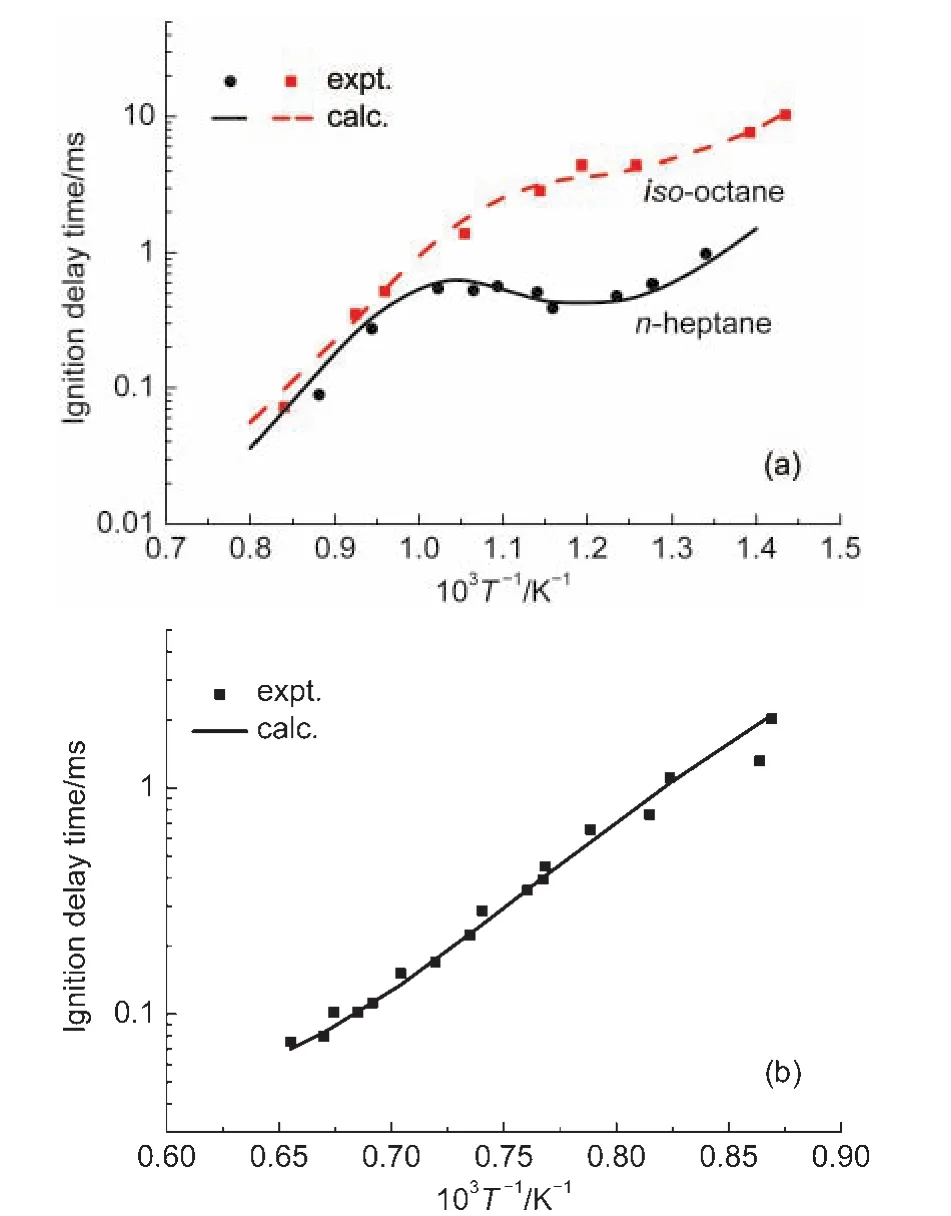
图7 修正后三组分机理在不同初始温度下计算的着火延迟时间与实验结果22,23比较Fig.7 Comparison of experimental22,23and calculated ignition delay time using modified three-component mechanism at different initial temperatures(a)PRF,conditions:equivalence ratio=1(in air);p=4.0 MPa. (b)ethanol,conditions:p=0.35 MPa;volume fractions, C2H5OH 1.25%,O23.75%,Ar 95%
图8为初始压力为4 MPa、化学计量比为1.0、温度范围700-1250 K时四种基础燃料(异辛烷、正庚烷、PRF60、PRF80)的着火延迟时间随温度的变化关系.实验数据点来自Fieweger等22的激波管测量结果.图中同时给出了使用Curran机理13和Ra机理12计算的结果.
图8(a)给出了不同温度下三种机理预测的单组分异辛烷的着火延迟时间.可以看出本文的三组分燃料机理、Ra机理和Curran机理在高温(T>1000 K)条件下的预报值均与实验结果有较高的一致性,但在低温(T<1000 K)条件下,Ra机理和Curran机理的预报值明显地高于实验值,而本文的机理与实验结果非常吻合.这说明本文的机理在高、低温区间都能较准确地预测异辛烷着火延迟时间.
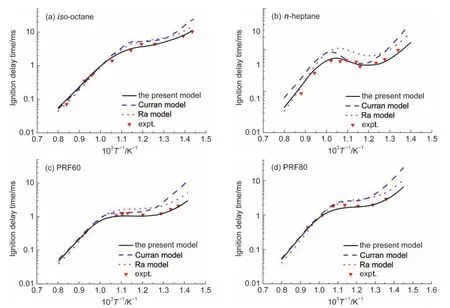
图8 不同初始温度下计算的基础燃料着火延迟时间与实验结果22比较Fig.8 Comparison of experimental22and calculated PRF ignition delay time at different initial temperatures conditions:equivalence ratio=1(in air);p=4 MPa
图8(b)给出了不同的温度下三种机理预测单组分正庚烷的着火延迟时间.由图可见,Curran机理在整个温度范围内与实验结果都有较大偏差.Ra机理和本文机理在高温(T>1050 K)区与实验结果有较好的一致性,但在低温(T<1050 K)区Ra机理明显高估了实验结果,而本文机理在整个温度区间都能较好地预测实验结果,并准确地预测了770-950 K温度范围内的负温度效应(NTC).
图8(c,d)给出了不同温度下三种机理预测PRF的着火延迟时间.由图可以看出,本文机理的预测值与实验结果有很好的一致性,而Ra机理和Curran机理的预测值在低温时与实验结果有较大偏差.比较图8(c,d)可以得出,PRF的着火延迟时间随着异辛烷比例增大而增加,负温度效应随着异辛烷比例增大而减小.
图9为乙醇着火延迟时间与实验结果的对比.其中,图9(a)给出了三个不同乙醇机理的计算与实验测量的着火延迟时间随温度的变化关系,图9(b)给出了本文机理在不同化学计量比下计算得到的乙醇着火延迟时间与实验结果的对比.图中的实验数据来自于Dunphy和Simmie23在激波管中的测量结果.在计算乙醇着火延迟时间时,由于初始温度较高,乙醇绝热燃烧温度在2000 K左右,如果还以温度升高400 K来计算着火延迟时间,必然会带来较大的计算误差.因此本文将乙醇着火延迟时间定义为OH基浓度达到最大值所经过的时间.由图9(a)可以看出,本文机理和Marinov详细机理21计算的乙醇着火延迟与实验数据比较接近,而Andrae机理15在1250-1550 K温度范围内低于实验数据,过早着火.图9(b)表明不同当量比下本文机理仍然能较好地预测乙醇着火延迟时间.
图10给出了压力分别为1、3和5 MPa,化学计量比为1,液态体积分数为20%乙醇、62%异辛烷、18%正庚烷三组分燃料在670-1250 K温度范围内的着火延迟时间随温度的变化关系.实验数据来自Fikri等25在激波管的测量结果.由图可见,压力为1 MPa时,本文机理比Andrae机理更接近实验结果.压力增大到3和5 MPa,本文机理和Andrae机理总体上均能与实验结果一致,但在高温段Andrae机理的计算结果略低于实验结果,而本文机理无论在高温段还是低温段都比Andrae机理更准确一些.

图9 不同初始温度下计算的乙醇着火延迟与实验结果23比较Fig.9 Comparison of experimental23and calculated ethanol ignition delay time at different temperatures(a)using various mechanisms,conditions:p=0.35 MPa;volume fractions,C2H5OH 1.25%,O23.75%,Ar 95%;(b)at different equivalence ratios,conditions:(case1)p=0.34 MPa,volume fractions,C2H5OH 1.25%,O27.5%,Ar 91.25%, (case2)p=0.34 MPa,volume fractions,C2H5OH 2.5%,O23.75%,Ar 93.75%
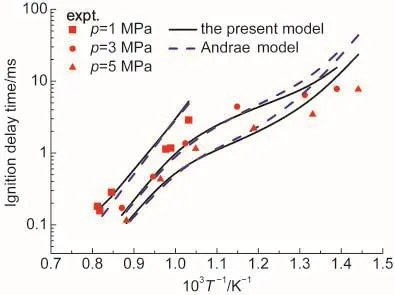
图10 不同初始温度下计算的三组分燃料着火延迟时间与实验结果25比较Fig.10 Comparison of experimental25and calculated tertiary mixtures ignition delay time at different initial temperatures
4 结论
通过反应路径分析和灵敏度分析,在Ra基础燃料机理和Marinov乙醇机理的基础上,合理地修正和补充重要的低温反应,构建了一个能够准确描述异辛烷/正庚烷/乙醇三组分燃料着火过程的、包含50组分和193个基元反应的着火化学动力学机理.
使用本文提出的三组分燃料机理计算单组分(异辛烷、正庚烷、乙醇)燃料、双组分、PRF燃料和三组分燃料的着火延迟时间与实验结果有更好的一致性.表明该机理能够更准确地预测异辛烷/正庚烷/乙醇三组分燃料的着火延迟时间.
提出三组分燃料机理包含较少的组分数与反应数,因而可适用汽油掺烧乙醇的多维数值模拟.
Supporting Information Available: Reaction mechanisms of three-component fuel have been included.This information is available free of charge via the internet at http://www.whxb. pku.edu.cn.
(1) Yücesu,H.S.;Topgül,T.;Cinar,C.;Okur,M.Appl.Therm. Eng.2006,26(17-18),2272.
(2)Maricq,M.M.Combust.Flame 2012,159(1),170.doi: 10.1016/j.combustflame.2011.07.010
(3)Yang,H.H.;Liu,T.C.;Chang,C.F.;Lee,E.Appl.Energy 2012,89(1),281.doi:10.1016/j.apenergy.2011.07.035
(4) Lemaire,R.;Therssen,E.;Desgroux,P.Fuel 2010,89(12), 3952.doi:10.1016/j.fuel.2010.06.031
(5) Dong,S.R.;Song,C.L.;Zhao,C.P.;Zhang,Y.F.;Guo,Z.P.; Xu,G.P.Journal of Tianjin University 2006,No.1,68.[董素荣,宋崇林,赵昌普,张延峰,郭振鹏,徐冠鹏.天津大学学报, 2006,No.1,68.]
(6) Chen,L.;Stone,R.;Richardson,D.Fuel 2012,96,120.
(7)Zhang,Q.F.;Zheng,C.L.;He,Z.W.;Wang,Y.Transactions of CSICE 2011,No.2,133.[张庆峰,郑朝蕾,何祖威,王 迎.内燃机学报,2011,No.2,133.]
(8) Halstead,M.P.;Kirsch,L.J.;Quinn,C.P.Combust.Flame 1977,30,45.
(9) Cox,R.A.;Cole,J.A.Combust.Flame 1985,60(2),109.doi: 10.1016/0010-2180(85)90001-X
(10)Tanaka,S.;Ayala,F.;Keck,J.C.Combust.Flame 2003,133(4), 467.doi:10.1016/S0010-2180(03)00057-9
(11) Tsurushima,T.Proc.Combust.Inst.2009,32(2),2835.doi: 10.1016/j.proci.2008.06.018
(12) Ra,Y.;Reitz,R.D.Combust.Flame 2008,155(4),713.doi: 10.1016/j.combustflame.2008.05.002
(13) Curran,H.J.;Pitz,W.J.;Westbrook,C.K.;Callahan,G.V.; Dryer,F.L.Symposium(International)on Combustion 1998,27
(1),379.doi:10.1016/S0082-0784(98)80426-8
(14)Andrae,J.C.G.Fuel 2008,87(10-11),2013.
(15)Andrae,J.C.G.;Head,R.A.Combust.Flame 2009,156(4), 842.doi:10.1016/j.combustflame.2008.10.002
(16)Andrae,J.C.G.;Björnbom,P.;Cracknell,R.F.;Kalghatgi,G. T.Combust.Flame 2007,149(1-2),2.
(17)Andrae,J.C.G.;Brinck,T.;Kalghatgi,G.T.Combust.Flame 2008,155(4),696.doi:10.1016/j.combustflame.2008.05.010
(18)Anderlohr,J.M.;Bounaceur,R.;Pires Da Cruz,A.; Battin-Leclerc,F.Combust.Flame 2009,156(2),505.doi: 10.1016/j.combustflame.2008.09.009
(19) Sakai,Y.;Miyoshi,A.;Koshi,M.;Pitz,W.J.Proc.Combust. Inst.2009,32(1),411.doi:10.1016/j.proci.2008.06.154
(20)Zhang,Q.F.;Zheng,C.L.;He,Z.W.;Wang,Y.Acta Phys.-Chim.Sin.2011,27,530. [张庆峰,郑朝蕾,何祖威,王 迎.物理化学学报,2011,27,530.]doi:10.3866/PKU. WHXB20110334
(21) Marinov,N.M.Int.J.Chem.Kinet.1999,31(3),183.doi: 10.1002/(SICI)1097-4601(1999)31:3<183::AID-KIN3>3.0.CO; 2-X
(22)Fieweger,K.;Blumenthal,R.;Adomeit,G.Combust.Flame 1997,109(4),599.doi:10.1016/S0010-2180(97)00049-7
(23) Dunphy,M.P.;Simmie,J.M.Journal of the Chemical Society, Faraday Transactions 1991,87(11),1691.doi:10.1039/ ft9918701691
(24) Kee,R.J.;Rupley,F.M.;Miller,J.A.;et al.CHEMKIN Release 4.1;Reaction Design:San Diego,CA,2006.
(25) Fikri,M.;Herzler,J.;Starke,R.;Schulz,C.;Roth,P.;Kalghatgi, G.T.Combust.Flame 2008,152(1-2),276.
May 2,2012;Revised:July 4,2012;Published on Web:July 4,2012.
Chemical Kinetic Model for Ignition of Three-Component Fuel Comprising iso-Octane/n-Heptane/Ethanol
ZHENG Dong ZHONG Bei-Jing*
(School of Aerospace,Tsinghua University,Beijing 100084,P.R.China)
A reduced chemical kinetic mechanism for the oxidation of three-component fuel comprising iso-octane/n-heptane/ethanol has been developed.The mechanism consists of 50 species and 193 elementary reactions and emphasizes the ignition process.Using path and sensitivity analyses,the path of primary reference fuel(PRF)oxidation and major elementary reactions at high and low temperatures are given.The validated results show that the present mechanism gives good agreement with experimental data for ignition delay time predictions.Because of the few species and reactions presenting in the chemical kinetic model,the mechanism is applicable to multidimensional computational fluid dynamic (CFD)simulation of the co-combustion of gasoline with ethanol.
Surrogate fuel; Primary reference fuel;Ignition delay time;Mechanism;Ethanol
10.3866/PKU.WHXB201207042
O643
∗Corresponding author.Email:zhongbj@tsinghua.edu.cn;Tel:+86-10-62772928.
The project was supported by the National Natural Science Foundation of China(51036004).
国家自然科学基金(51036004)资助项目
