脂易消对NAFLD大鼠肝组织ChREBP mRNA表达的影响*
2012-11-16周岳君陈玉翠
周岳君 陈玉翠
脂易消对NAFLD大鼠肝组织ChREBP mRNA表达的影响*
周岳君①陈玉翠②
目的:观察脂易消对实验性非酒精性脂肪性肝病(NAFLD)大鼠肝组织碳水化合物反应元件结合蛋白(ChREBP)mRNA表达的影响。方法:采用高脂饮食制备NAFLD大鼠模型,分低、中、高剂量脂易消治疗组、易善复胶囊阳性对照组、模型对照组、正常对照组。显微镜下观察HE染色后各组肝细胞脂肪变性及肝组织炎性改变情况;使用RT-PCR法检测各组大鼠肝组织ChREBP mRNA的水平。结果:实验结束时模型组体重指数(BMI)明显增高,与正常组比较差异有显著统计学意义(P<0.01);而与模型组相比,脂易消各剂量组及易善复组肝指数明显降低,差异有统计学意义(P<0.05);但高、中、低剂量组与易善复组比较差异均无统计学意义(P>0.05)。光镜观察显示正常对照组没有发生脂肪变性及炎性浸润;模型组总体肝组织脂肪变性程度与正常组肝组织相比有显著的差异。脂易消组肝组织发生弥漫性肝细胞脂肪变性及轻微的炎性浸润,程度轻于模型组。易善复组肝组织炎性改变程度与脂易消组比较没有明显的差异。结论:脂易消能改善肝细胞脂肪性变及肝组织炎性病变,提高肝组织ChREBP mRNA表达水平,对高脂饮食引起的NAFLD有治疗作用,具有与易善复相似的疗效。
脂易消; NAFLD; 大鼠; ChREBP mRNA
非酒精性脂肪性肝病(NAFLD)主要与代谢异常、环境因素及遗传等因素相关,是以肝细胞脂肪变性为主要病理改变的临床综合征。非酒精性脂肪性肝炎(NASH)是其病理变化的重要阶段[1-2],发病率逐年增高[3],研究表明其是隐源性肝硬化的重要病因[4-5],甚至可发展为肝癌[6-7]。祖国医学把本病列入“胁痛”、“痰湿”、“积聚”等范畴,认为本病多因过食膏梁厚味或烟酒炙煿之品,脾胃受损,痰浊内生,湿毒郁滞;或情志郁结,肝失疏泄,或病后失调,气机阻滞,气滞血瘀所致。笔者认为湿毒痰瘀是本病的主要病机。
脂易消为笔者长期临床实践中总结出来的治疗脂肪肝的有效方药,经长期临床观察和前期课题证实疗效确切[8-11]。本研究采用高脂饮食诱导大鼠非酒精性脂肪性肝炎模型,通过低、中、高各剂量组脂易消对其进行干预,易善复胶囊作为阳性对照药物。经药物干预后观察各实验组大鼠肝脏组织病理学改变,同时运用RT-PCR技术检测肝组织中ChREBP mRNA的表达水平,探讨脂易消治疗非酒精性脂肪性肝炎的作用机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 清洁级SD大鼠60只,雄性,体重(180±20)g,由浙江中医药大学实验动物中心提供,分笼喂养,自由饮水和进食,室温(20±2)℃,湿度50%,明暗分别处理12 h,预养1周后进入实验阶段。
1.1.2 方药及制备 脂易消主要由丹参、半夏、荷叶、枳壳等中药组成,药物由杭州市方回春堂提供,再经浙江省中医院制剂室加工而成。易善复(多烯磷脂酰胆碱)由北京万安特制药有限公司提供,生产批号:20091110,生理盐水由浙江省新昌制药厂提供,生产批号:090803。
1.1.3 仪器 AP280-1冷台、HM335E切片机、AllegraTM 64R高速冷冻离心机,Nikon eclipse 80i光学显微镜,ATL-031型智控恒温摇床,PYX-DHS-35×40型Techne PCR仪、AP280-2型包埋机、1200系列高效液相色谱仪。
1.1.4 试剂 Oligod(T)18试剂、TaqTM试剂、M-MLV反转录酶(大连宝生物工程有限公司);TRIzol(US Invitrogen公司);PCR Marker、PCR引物合成(上海生物工程有限公司)。
1.2 实验方法
1.2.1 动物造模 动物造模采用陈芝芸[12]课题组NAFLD模型方法,雄性SD大鼠,体重(180±20)g,用高脂饲料(10%猪油、5%蛋黄粉、2%胆固醇、0.5%胆酸钠及82.5%基础饲料)持续饲养12周,大鼠产生重度大泡性脂肪变,小叶内炎性表现明显,点状或小灶性坏死,汇管区炎性程度较小叶内轻,血清转氨酶增高,NAFLD模型建立。
1.2.2 分组与用药 60只清洁级SD大鼠经适应性饲养1周后,随机分成模型组(下文简称B组),高、中、低剂量(脂易消)组(下文分别简称C、D、E组),易善复组(下文简称F组),正常对照组(下文简称A组),每组10只。其中A组喂食普通饲料,不予任何处理;B、C、D、E、F组均喂食高脂饲料。其中C、D、E组给予中药干预,每天经口灌服高、中、低剂量(分别为成人剂量的12倍/kg、6倍/kg、3倍/kg)脂易消;F组每天经口灌服中剂量易善复(成人剂量的6倍/kg);B组仅喂食高脂饲料,每天经口灌服等剂量的生理盐水。实验期间,实验动物自由饮水与进食,分笼饲养,每笼5只,(20±2)℃明暗各12 h,造模12周后处死动物。
1.2.3 制备标本 最后一次用药后,当晚禁食12 h,不用禁水,第2天上午用3%戊巴比妥钠溶液腹腔麻醉(按1 ml/kg的剂量空腹给予),从大鼠的下腔静脉抽血,用离心机把血清分离,放进冰箱保存备用,冰箱温度要控制在-20 ℃;同时把大鼠肝组织取出,称取其重量,于肝右叶中部选取数块肝组织置于液氮中备取总RNA,还要取肝右叶组织石蜡包埋,用于病理检查。
1.3 检测方法
1.3.1 肝组织病理学检测 取大鼠肝脏右叶肝组织,立即用10%中性磷酸缓冲液(phosphate buffer solution,PBS,pH=7.0,以下同)福尔马林液中固定,固定过夜后,按1 cm×1 cm×0.2 cm大小取材,标记后流水冲洗30 min,梯度酒精脱水,二甲苯透明后浸蜡,常规石蜡包埋,连续切片,切片厚度为4 μm,HE染色,观察肝组织炎性改变及细胞变性情况。
非酒精性脂肪性肝病病理学诊断标准参考《非酒精性脂肪性肝炎诊断指南》[13]实施:依据肝细胞脂肪变性占据所获取肝组织标本量的范围,分为4度(F0-4):F0:肝细胞内无脂滴沉积;F1:肝小叶内<30%的肝细胞有脂肪变;F2:肝小叶内30%~50%的肝细胞有脂肪变;F3:肝小叶内50%-75%的肝细胞有脂肪变;F4:75%以上的肝细胞有脂肪变。
1.3.2 RT-PCR检测ChREBP mRNA表达
1.3.2.1 提取总RNA 把肝组织(300 mg)从-70 ℃冰箱中取出,混合液氮后将其磨成粉末,再混合l2 ml的Trizo研磨,磨好后置入无RNA酶、DNA酶的1.5 ml离心管中。再与0.2 ml氯仿相混合,高强度振荡30 s,混匀后,常温下离心12 000 r/min,持续5 min;取上层溶液置入另一新洁净1.5 ml离心管中,混合等容积的异丙醇,振荡混匀,常温下放置5 min,在常温下再进行离心12000 r/min,持续5 min,去掉上清液,再混合70%乙醇1 ml洗净并烘干,用0.05 ml DEPC去离子水再次溶解RNA。提取出的总RNA经紫外线分光光度计检测提取物浓度,A260与A280之比在1.8~2.0范围之内。
1.3.2.2 相关引物合成 依据Primer premier 5.0设计引物,同时还要参照核苷酸排列,由上海生物工程有限公司进行相关引物的合成。ChREBP mRNA引物排列:ChREBP上游引物:5’-AGG GAG ACG CAG GTGT-3’;下游引物:5’-CTG ATA CTG GTC GTA GGT GA-3’,扩增片段为368bp。内参照β-actin上游引物:5’-ATG CCA TCC TGC GTC TG-3’;下游引物:5’-ACT CCT GCT TGC TGA TCC ACAT-3’,扩增片段为578bp。
1.3.2.3 逆转录操作 取提取好的总RNA,准备5μl 5×Buffer,10pmol oligd(dT),4μl dNTP(2.5 mM),1μl RNA酶抑制剂,5 U M-MLV逆转录酶,加入DEPC水至25 μl,轻轻混匀,常温下停放10 min,再置入42 ℃恒温器内,进行逆转录反应,要保持1 h的42 ℃恒温。反应完毕在冷水中降温2 min,降温后的反应液就能用作PCR反应中的逆转录反应液。
1.3.2.4 PCR反应操作 把逆转录反应物置入50 μl的反应体中进行PCR反应。反应体包含5 μl 10×Reaction Buffer、四种2 μl dNTP的混合物(每一种2.5 mM)、3 U/μl TaqDNA多聚酶、3 μl 逆转录反应液、1 μl上下游引物、35 μl去离子水。设定温度94 ℃使其预变性5 min,再依据以下要求重复30次,94 ℃变性,持续 30 s、55 ℃退火处理 30 s,72 ℃延伸处理 30 s,最后72 ℃延伸,持续5 min。
1.3.2.5 PCR产物检测 用1%的琼脂糖(含溴化乙锭溶液0.5μ g/ml)把5 μl的PCR反应物凝胶电泳2 h,再选用3 μl Marker当作PCR产物DNA片段体积的参照物。凝胶电泳完毕,用天能图像分析系统进行检测,用BandScan加以处理,测出产物条带的吸光度,以β-actin为标准,进行半定量研究,其中ChREBP mRNA的相对表达水平以ChREBP/β-actin来表示。
1.4 统计学处理 采用SPSS 15.0统计软件对数据加以处理,计量资料以(±s)的形式表示,组间比较采用t检验,计数资料采用字检验,以P<0.05为差异有统计学意义。
2 结果
2.1 一般状况 在实验过程中,C组1只大鼠死亡。A组大鼠饮食正常,发育良好,活泼好动;而高脂饲料饲养的各组大鼠体毛逐渐稀疏,性情较温顺,不喜动。实验结束时B组体重指数(BMI)明显增高,与A组比较差异有显著统计学意义(P<0.01);而与B组相比,C、D、E组及F组肝指数明显降低,差异有统计学意义(P<0.05);但C、D、E组与F组比较差异均无统计学意义(P>0.05)。见表1。
表1 六组大鼠BMI的变化(±s)

表1 六组大鼠BMI的变化(±s)
*与A组比较,P<0.01;△P<0.05,#P<0.01,与B组比较;*△与F组比较,P>0.05
?
2.2 大鼠肝组织HE染色后光镜观察结果 (1)A组:大部分肝细胞为单核,肝小叶结构光镜下显示清晰,肝板显示出条索结构,呈放射状排列,且包绕着中央静脉,没有发生脂肪变性及炎性浸润。(2)B组:光镜显示肝细胞肿胀,胞浆松散,产生大量脂肪空泡,出现弥漫性的肝细胞脂肪变性。炎性细胞浸润发生在汇管区和小叶间,破坏了正常的肝小叶,有的大鼠肝小叶内成片坏死并融合,没有肝纤维化表现;总体肝组织脂肪变性程度与正常肝组织相比有显著的差异。(3)C、D、E组:肝组织镜下显示出弥漫性肝细胞脂肪变性,程度轻于B组。汇管区及小叶间发生轻微的炎性细胞浸润,其程度也轻于模B组。(4)F组:该组的肝组织炎性改变程度与C、D、E组比较没有明显的差异。六组大鼠肝组织脂肪变性情况比较见表2,六组大鼠肝组织炎性浸润情况比较见表3。

表2 六组大鼠肝组织脂肪变性程度比较 只

表3 六组大鼠肝组织炎性浸润情况比较 只
2.3 肝组织ChREBP mRNA表达水平检测 B组大鼠肝组织ChREBP mRNA表达水平较A组显著升高(P<0.01);C、D、E组和F组显著低于B组(P<0.01);E组与A组相比无明显差异(P>0.05);D、E组大鼠肝组织ChREBP mRNA表达水平与F组相比无明显差异(P>0.05)。见表4。
表4 六组大鼠ChREBP mRNA表达水平(±s)
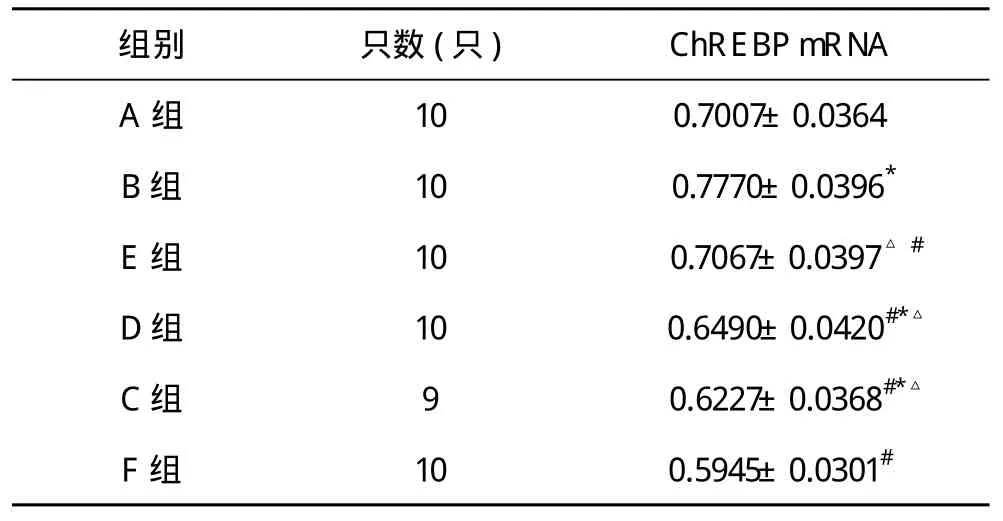
表4 六组大鼠ChREBP mRNA表达水平(±s)
*P<0.01,△P>0.05,与A组比较;#与B组比较,P<0.01;*△与F组比较,P>0.05
组别 只数(只) ChREBP mRNA A组 10 0.7007±0.0364 B组 10 0.7770±0.0396*E 组 10 0.7067±0.0397△#D 组 10 0.6490±0.0420#*△C 组 9 0.6227±0.0368#*△F 组 10 0.5945±0.0301#
3 讨论
评价NAFLD疗效的金标准是肝脏组织病理学检查。实验发现,A组大鼠肝组织无明显异常,B组大鼠肝组织可见弥漫性肝细胞脂肪变,程度均为重度,伴小叶内炎症及汇管区炎细胞浸润,部分大鼠小叶内坏死灶融合成片,但未见肝纤维化形成。C、D、E组大鼠肝组织也见不同程度脂肪变性,与B组比较差异无统计学意义(P>0.05);肝组织的炎症分布和性质与B组相似,但程度明显减轻;其炎症活动度较B组显著下降(P<0.05),但仍高于A组(P<0.05);与F组相似(P>0.05),结果显示B组大鼠脂肪变性处F3级,结果符合国内多数文献的报道;C、D、E组能明显改善肝组织炎症活动度,与F组相似(P>0.05),说明脂易消能减轻NAFLD大鼠炎性反应。
研究结果显示,与A组相比,B组ChREBP mRNA表达明显增高,差异有显著统计学意义(P<0.01),提示高脂饮食诱导时,脂易消可能调节脂肪细胞分泌ChREBP,降低肝组织ChREBP表达水平,从而达到治疗NAFLD的作用。本实验实验提示,脂易消可减轻肝组织炎症损伤,具有治疗作用,疗效与易善复相似;能显著降低NAFLD大鼠肝组织ChREBP mRNA表达水平,提示其治疗非酒精性脂肪性肝炎作用机理可能与其调节ChREBP mRNA在肝脏的表达有关。
[1] Bellentani S,Saccocio G,Masutti F,et al.Prevalence and risk of factors for hepatic steatosis in northern Italy[J].Ann Intern Med,2000,132(2):112-117.
[2] Clark J M,Diehl A M.Defining nonalcoholic fatty liver disease:Implications for edidemio-Logic studies[J].Gastroenterology,2003,124(1):248-250.
[3] Ayata G,Gordon F D,Lewis W D,et al.Cryptogenic cirrhosis:clinicopathologic Findings at and after liver transplantation[J].Hum Pathol,2002,33(11):1098-1104.
[4] Ong J P,Younossi Z M.Is hepatocellular carcinoma part of the natural history of nonalcoholic steatohepatitis[J].Gastroenterology,2002,123(1):375-378.
[5] Sanyal A J.Mechanisms of disease: pathogenesis nonalcoholic fatty liver disease[J].Nat Clin Pract Gastroenterol Hepatol,2005,2(1):46-53.
[6] Ong J P,Younossi Z M.Approach to the diagnosis and treatment of nonalcoholic fatty liver disease[J].Clin liver Dis,2005,9(4):617-634.
[7] Day C P,James.Steatohepatitis:a tale of two“hits”[J].Gastroenterology,1998,114(4):842-845.
[8] 周岳君,姚海清.脂易消治疗非酒精性脂肪肝36例疗效观察[J].浙江中医学院学报,2005,29(6):18-19.
[9] 周岳君,姚海清.脂易消对非酒精性脂肪肝血脂及肝功能变化的影响[J].中华医药杂志,2007,7(2):149-150.
[10] 周岳君.脂易消治疗非酒精性脂肪肝120例临床观察[J].中国中医药科技,2007,14(4):73-74.
[11] 周岳君.脂易消治疗非酒精性脂肪肝的临床研究[J].医学研究杂志,2008,37(4):115-117.
[12] 陈芝芸.脂肪性肝病动物模型的方法学研究进展[D].2006全国中西医结合脂肪肝专家论坛暨脂肪性肝病诊疗新进展学术会议论文集,63-68.
[13] 中华医学会肝脏学分会脂肪肝和酒精性肝病学组.非酒精性脂肪性肝病诊疗指南(2006年2月修订)[S].肝脏,2006,11(1):68-70.
The Influence of Zhiyixiao to Eliminate NAFLD Rat Liver Tissue ChREBP mRNA Expression
ZHOU Yue-jun,CHEN Yu-cui.
Objective:To observe the influence of Zhiyixiao on experimental nonalcoholic fatty liver disease (NAFLD) rat liver tissue carbohydrate response element binding protein (ChREBP ) on the expression of mRNA.Method:Given high fat diet to NAFLD rat model,divided them into low,medium, high Zhiyixiao treated group,Yishanfu capsule in the positive control group,saline control group,normal control group.Microscopically observed by HE staining in all groups after fatty degeneration of liver cells and the liver tissue inflammatory changes;the use of RT-PCR was detected by rat liver tissue ChREBP levels of mRNA.Result:At the end of the experiment in model group,body mass index (BMI) were significantly increased,compared with the normal group the differences were statistically significant (P<0.01);and compared with the model group,the index of all Zhiyixiao groups and Yishanfu group decreased significantly (P<0.05);but the high,medium,low treated groups and Yishanfu group there were no significant differences(P>0.05).The light microscope showed that the normal group had no fatty degeneration and inflammatory infiltration;group model overall liver fatty degeneration degree compared with that in normal liver tissues had significant difference.Conclusion:Zhiyixiao can improve liver steatosis and liver tissue inflammatory diseases, improve liver tissue ChREBP expression level of mRNA,on high fat diet induced by NAFLD treatment,and Yishanfu has similar efficacy.
Zhiyixiao; NAFLD; Rat; ChREBP mRNA
The Chinese Medicine University of Zhejiang,Hangzhou 310053,China
Medical Innovation of China,2012,9(22):001-004
10.3969/j.issn.1674-4985.2012.22.001
浙江省科技厅资助课题(编号:2009C33161)
①浙江中医药大学 浙江 杭州 310053
②山东医药技师学院
周岳君
2012-06-01) (本文编辑:连胜利)
