均相Fenton反应对偶氮染料橙黄G氧化脱色实验研究
2012-11-14江强明吴宏海窦晓文
江强明,吴宏海,窦晓文
(1. 闽西职业技术学院化学工程系, 福建龙岩364021; 2. 华南师范大学化学与环境学院, 广东广州510006)
均相Fenton反应对偶氮染料橙黄G氧化脱色实验研究
江强明1,吴宏海2*,窦晓文2
(1. 闽西职业技术学院化学工程系, 福建龙岩364021; 2. 华南师范大学化学与环境学院, 广东广州510006)
通过均相Fenton反应对偶氮染料橙黄G(简称为OG)废水溶液氧化脱色的实验研究,考察了废水中OG的初始质量浓度、二价铁离子和过氧化氢的投加量以及反应温度和初始pH值对OG脱色的影响.结果表明,均相Fenton法能够有效对OG废水溶液氧化脱色且该脱色反应遵循二级反应动力学方程.随着反应温度升高和pH适当降低,OG氧化脱色速率增强.若适当降低OG的初始质量浓度,OG氧化脱色率逐渐增大.在保证足够高脱色率的前提下,适当降低Fe2+离子的初始质量浓度,既实现OG脱色达标排放,又满足铁离子的排放限量规定.
偶氮染料橙黄G; 均相Fenton反应; 氧化脱色
传统均相Fenton法是一种高级氧化技术[1-2],其主要缺点是需要在较低pH介质条件(pH 3~4)下进行[2-3];而且反应体系中铁离子等催化剂容易沉淀,难以回收,造成二次污染.在治理工艺末端去除铁离子时可能会产生大量的污泥[4-5],需要付出额外成本进行污泥处置.目前印染废水不能达标排放,往往是色度因素[1],COD因素已不是达标排放的障碍.因此印染废水的脱色是印染行业的主要环保问题.均相Fenton法将继续成为印染废水脱色的重要技术之一.因为考虑去除色度铁离子浓度,那么,既可满足环境法规对铁离子浓度的排放限制又能实现对印染废水脱色达标排放.我国台湾地区制定的废水排放标准规定总铁为10 mg/L[6].SUN等[1]报道均相Fenton法对OG染料氧化脱色研究,以考察在低浓度铁离子时OG脱色机理及其影响因素.采用低浓度铁,可以避免均相Fenton法处理工艺末端铁离子容易发生沉淀而产生大量污泥的问题[7-8].本文针对均相Fenton法处理废水的脱色问题开展研究,同时以偶氮染料橙黄G为目标污染物,着重考察均相Fenton法对OG脱色的工艺性能及其主要影响因素.
1 实验材料与方法
1.1试剂
偶氮染料橙黄G (上海阿拉丁试剂厂)、体积分数为30%的过氧化氢、浓H2SO4与硫酸亚铁盐(均购自广州化学试剂厂),分析纯,实验用水为去离子水.
橙黄G废水溶液的配制:用电子天平(Sartorius AG)准确称取一定质量的OG染料,后放入100 mL的烧杯中,加入去离子水,充分搅拌均匀,并定容于1 000 mL的容量瓶中,配制出一系列不同浓度的OG溶液,以备使用.
1.2仪器
恒温磁力搅拌器(江苏金坛市正基仪器有限公司);PHS-3C精密pH计(上海雷磁仪器厂);原子吸收分光光度计(北京普析通用仪器有限责任公司的TAS-986型)
1.3实验步骤
量取300 mL橙黄G水溶液置于500 mL的烧杯中,调节工作液的H2O2、Fe2+和OG浓度,用0.1 M稀H2SO4和NaOH溶液调节pH至设定值.在恒温磁力搅拌器的搅拌下,迅速加入一定量的H2O2溶液,作为OG染料脱色的开始.立即计时,间隔取样,采用紫外-可见分光光度计测定OG染料的最大吸收波长478 nm处的吸光度,并根据标准曲线计算OG废水溶液的质量浓度.氧化脱色实验平行对照进行,同时进行脱色空白对照控制实验,以减少实验误差.
橙黄G标准曲线为:Y=33.033x+ 0.012,相关系数R2达到1.000.橙黄G染料溶液的氧化脱色率(E),可由下式(1)计算求出:

(1)
其中,E为脱色率(%);C0、C分别为橙黄G废水溶液中OG的反应前初始质量浓度、反应至某时刻t时的质量浓度(mg/L),均经标准曲线及空白对照控制确定.
2 结果与讨论
2.1初始pH值对OG脱色效果的影响
在[OG] 50 mg/L, [H2O2]03.0 mmol/L, [Fe2+] 5.0 mmol/L和30 ℃条件下,研究初始pH对OG降解脱色的影响(图1).pH4时橙黄G废水溶液最佳脱色效率可达99.6%,而初始pH 6时脱色率则为91.3%. Fenton试剂中的Fe2+离子在较低pH条件下呈溶解游离态,容易催化H2O2的分解作用并产生大量羟自由基,而在较高pH条件下Fe2+会以氢氧化物的形式发生沉淀而失去催化H2O2能力,抑制羟基自由基的产生,并导致脱色率下降. 当pH 2时橙黄G废水的氧化脱色速率低于pH 4时,因为pH值过低,从反应式(2)和(3)可看出,溶液中的H+浓度过高会抑制Fe3+还原为Fe2+,使得H2O2催化分解受阻,降低Fenton试剂的氧化能力.研究表明,H2O2倾向于与弱碱性物质结合[2, 6],本实验中OG降解脱色效率最佳时的溶液pH是4,已有学者归因于pH 4时生成Fe(OH)2, 其催化分解H2O2的速率较之Fe2+离子要快10倍[2].所以均相Fenton法中反应体系溶液介质pH 3~4范围内是适当的,与相关文献报道的是相一致的[1].
冠心病是一临床常见的慢性疾病,具有发病率高的特点,由于该病的致病高危因素多常见,病人家属容易忽略,导致该病有致死率高、发病迅速等特点。治疗依从性对病人高危因素的控制、预防诱发因子、延长患者生命起着至关重要的作用[6]。 医院、社区、居家共同的管理模式,能更好地利用医院、社区及家庭的特点和优势,对有限的医疗资源进行合理利用同时能缓解患者负担,能增加医院与社区及患者三方之间的联系和交流,以提高冠心病的诊断率、治疗率和控制率,使冠心病的致死率得到有效的降低。
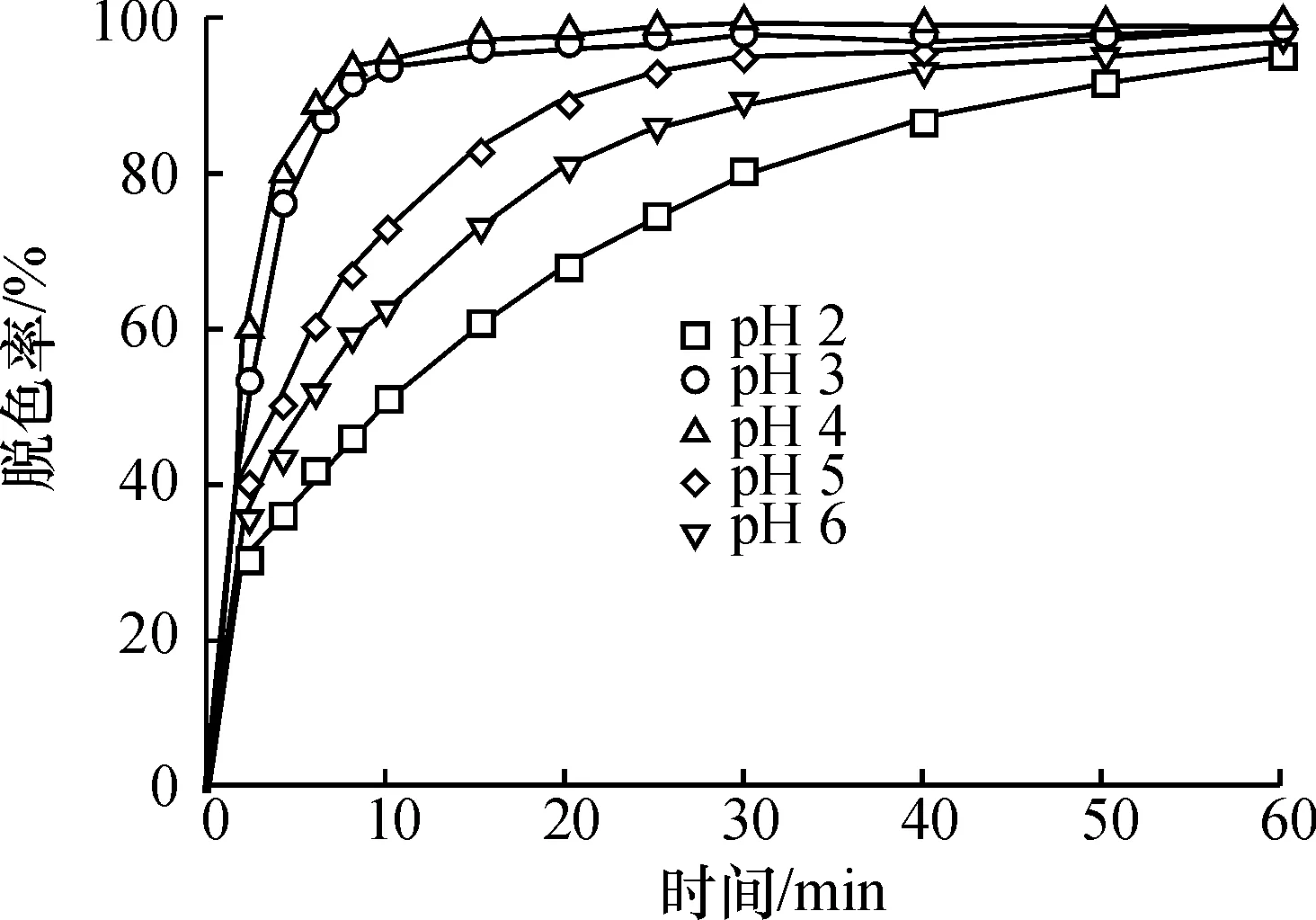
图1 溶液初始pH值对橙黄G脱色效果的影响
Figure 1 Effect of initial solution pH value on the decolorization of OG
Fe3++ H2O2→ Fe2++ O2H·+ H+
(2)
Fe3++ O2H·→Fe2++H++O2
(3)
2.2橙黄G初始质量浓度对脱色效果的影响
[H2O2]03.0 mmol/L, [Fe2+] 5.0 mmol/L, pH 4和30 ℃条件下,随着OG的初始浓度的升高,OG氧化脱色率随之降低(图2).当OG初始质量浓度为20 mg/L时,反应进行10 min,OG的脱色率达到97.6%,而当OG为80 mg/L时,反应进行10 min后,OG脱色率仅有87.1%,但是反应进行至30 min时脱色率近于100%.这是因为投加定量的Fe2+和H2O2,仅能相应产生定量的OH·,若OG的初始质量浓度增大,OH·却没有增加,会导致OG废水脱色速率相应降低.因此,在于印染废水脱色的关键,在于控制好OG的初始质量浓度,以保证在不需要加入较多的铁离子剂量的前提下,实现染料废水脱色达标排放,同时又能满足环保法规对铁离子排放的浓度限制.目前一般印染废水的色度不达标,大多数情况下水中染料的实际浓度不高,因此可实现染料废水的脱色达标排放.

图2 橙黄G初始质量浓度对OG脱色效果的影响
Figure 2 Effect of OG concentration on the decolorization of OG
2.3Fe2+投加量对脱色效果的影响
[OG]050 mg/L, [H2O2]03.0 mmol/L, pH 4, 30 ℃条件下,随着Fe2+的初始浓度升高,OG氧化脱色率也升高(图3).当Fe2+的初始浓度为3.0×10-2mmol/L时脱色效果最理想.当Fe2+的初始浓度为3.0~5.0×10-2mmol/L范围时,反应进行60 min后,橙黄G的脱色率为99.6%,而Fe2+的初始浓度为1.0×10-2mmol/L时,其氧化脱色率仅为45.3%.从反应式(4)看出,Fe2+作为催化剂直接影响羟基自由基的生成速率和数量.若单位时间内OH·产生的速率和数量增加,反应速率提高和橙黄G的去除率也会相应增大.
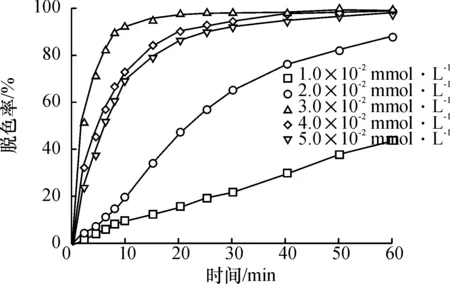
图3 不同Fe2+投加量对OG脱色效果的影响
Figure 3 Effect of various dosage of Fe2+on the decolorization of OG
Fe2++ H2O2+ H+→ Fe3++ OH·+H2O,
(4)
Fe3++ H2O2→Fe2++O2H·+ H+,
(5)
Fe3++ O2H·→Fe2++O2+ H2O,
(6)
Fe2++ ·OH → Fe3++ OH-.
(7)
2.4H2O2初始浓度对脱色效果的影响
在[OG]050 mg/L, [Fe2+]5.0×10-2mmol/L, pH 4 和30 ℃条件下,当H2O2的浓度为3.0×10-3mol/L时,橙黄G的降解率几乎达到100%,而为6.0×10-4和6.0×10-1mol/L时,脱色率分别为91.2%和17.4%(图4).这是因为:一方面,Fenton法是以Fe2+催化H2O2分解所产生的OH·攻击水中的橙黄G而实现氧化降解脱色,因而H2O2投加量直接决定着Fenton法的氧化脱色效果.另一方面,若H2O2浓度过高,过量的H2O2会抑制OH·的生成,这归因于对羟自由基的捕获效应[10],如式(8)和式(9)所示,H2O2首先与OH·生成O2H·.副产物,O2H·不仅氧化性能弱,而且还会与OH·反应消耗OH·,进一步降低氧化脱色效果[10-11].因此本文实验中适合的H2O2初始浓度为3.0×10-3mol/L.

图4 不同H2O2投加量对OG脱色效果的影响
Figure 4 Effect of various dosage of H2O2on the decolorization of OG
OH·+ H2O2→O2H·+ H2O
(8)
OH·+O2H·→ O2+H2O
(9)
2.5反应温度对脱色效果的影响
[OG]050 mg/L, [H2O2]03.0 mmol/L, [Fe2+] 5.0×10-2mmol/L和pH 4条件下,随反应温度升高,OG氧化脱色反应速率也相应得到提高.50 ℃反应10 min后,OG脱色率几乎100%(图5).这是因为,一般的化学反应随着反应温度升高,反应物分子平均动能增大,使得氧化脱色反应速率提高. 说明温度升高,有利于均相Fenton法对橙黄G染料废水的脱色[1],因而是一个吸热反应过程.不过,对于Fenton法来说,温度不是主要限制条件,从图5可看出,在20 ℃条件下,OG染料废水的脱色率很高,均相Fenton法就表现出很好的氧化脱色性能,故可称为一种低温绿色型的高级氧化处理技术[3].
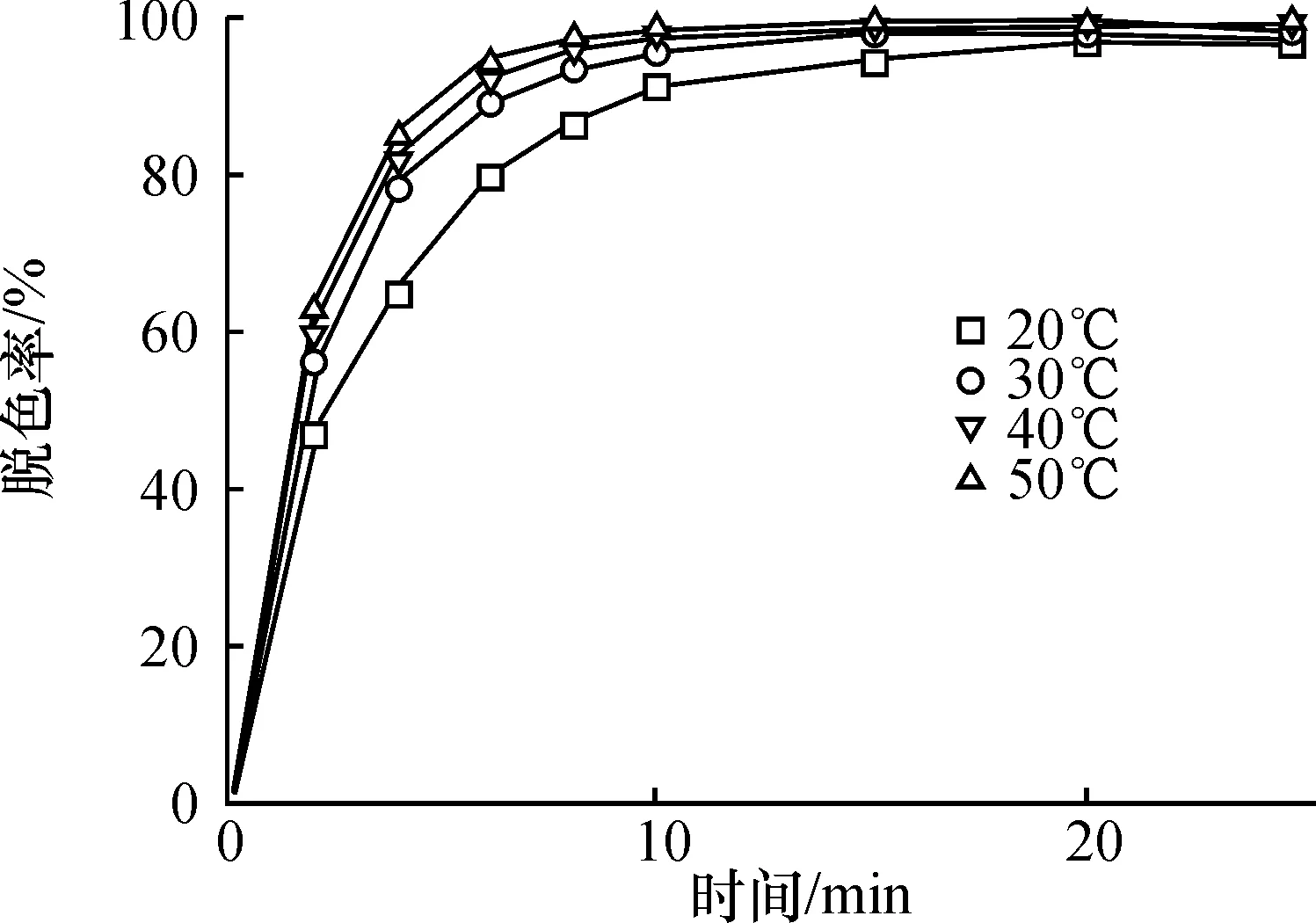
图5 不同反应温度对OG脱色效果的影响
Figure 5 Effect of various temperatures on the decolorization of OG
2.6脱色反应动力学方程与热力学方程的计算
均相Fenton法对OG染料脱色的动力学采用二级动力学方程(1/Ct=1/C0+kt)进行拟合,表1列出在不同的pH值、Fe2+投加量、H2O2投加量、温度等各种变化条件下对OG染料的降解脱色动力学实验数据拟合结果(表1).橙黄G废水的氧化脱色动力学符合二级动力学方程,并得到反应表观速率常数k,优化条件下相关系数R2可达0.989,表观速率常数k可达1.4×105.
橙黄G的降解脱色反应的表观活化能E可以采用Arrhenius方程,并按下式(10)再经对数变换计算求出:
(10)
式(10)中,k是动力学常数,A是常数项,E是反应表观活化能(J/moL),R理想气体常数 (8.314J/(moL·K);T是绝对温度 (K).可从Arrhenius方程的lnk对1/T线性关系作图求得E和常数项A值.由于实验存在一定的误差,20 ℃时k值与后3个温度差别较大,故采用后3个温度的k值拟合作图,R2达到0.914(图6),同时获得E为12.42 J/moL,虽然较之文献报道的34.84 J/moL偏小一些[1],但却可说明均相Fenton法脱色反应容易实现.温度升高可促进Fenton氧化脱色反应的进行,这与本文实验事实基本相吻合的.

表1 不同反应介质条件下橙黄G染料氧化脱色的动力学方程及其常数Table 1 Kinetics and constants for decolorizing OG dye by Fenton reaction under different reaction medium conditions
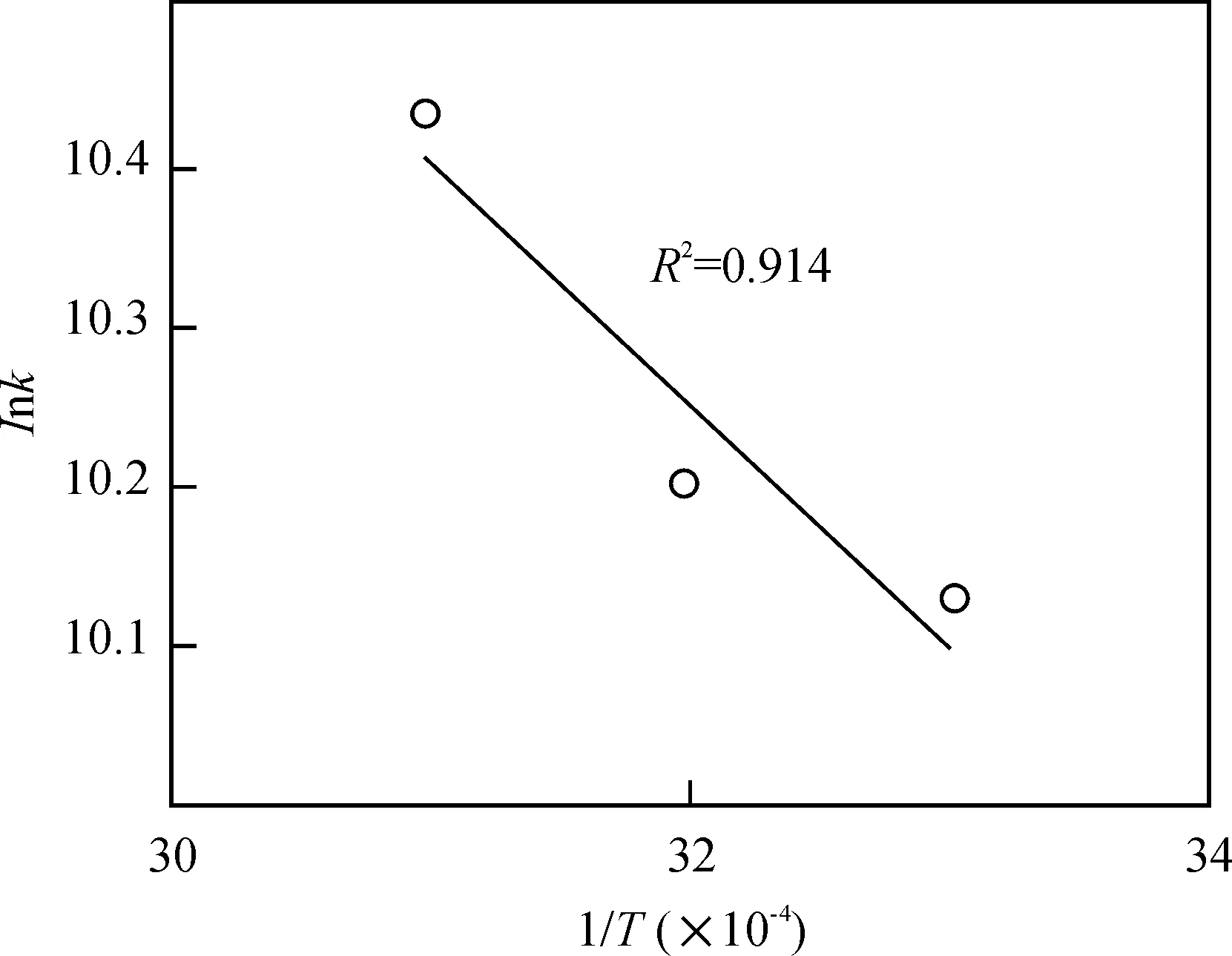
C0=[OG] 50 mg·L-1, [Fe2+] 5.0×10-2mmol·L-1,[H2O2]03.0 mmol·L-1, pH 4.0
图6 动力学常数lnk对1/T的线性关系图
Figure 6 Plot of linear relationship of kinetic constant lnk versus temperature 1/T
3 结论
均相Fenton反应法能够高效的对偶氮染料橙黄G进行氧化脱色.脱色反应动力学研究表明,均相Fenton法对OG的脱色反应遵循二级反应动力学方程,并在上述优化反应条件下,脱色表观速率常数k可达1.4×105.而且,随着脱色反应温度的升高和pH适当降低,OG脱色率也相应提高.若控制好适当的OG初始质量浓度如50 mg/L左右,并在较低铁离子浓度下(如0.03~0.05 mmol/L)就可以确保OG染料废水的完全脱色,既能实现OG脱色环保达标排放,同时又能满足铁离子免后续处理的低浓度排放要求.
[1] SUN S P, LI C J, SUN J H, et al. Decolorization of an azo dye Orange G in aqueous solution by Fenton oxidation process: Effect of system parameters and kinetic study [J]. J Hazard Mater, 2009, 161:1052-1057.
[2] PIGNATELLO J J, OLIVEROS E, MACKAY A. Advanced oxidation processes for organic contaminant destruction based on the Fenton reaction and related chemis-try [J].Crit Rev Environ Sci Technol, 2006, 36:1-84.
[3] HE J, MA W, HE J J, et al. Photooxidation of azo dye in aqueous dispersions of H2O2/-FeOH [J]. Appl Catal B: Environ, 2002, 39: 211-220.
[4] ORTIZ DE L A, PLATA G B, ALFANO O M, et al. Decomposition of 2-chlorophenol employing goethite as Fenton catalyst: I: Proposal of a feasible, combined reaction scheme of heterogeneous and homogeneous reactions [J]. Appl Catal B: Environ, 2010, 95: 1-13.
[5] CHEN J X, ZHU L Z. UV-Fenton discolouration and mineralization of Orange II over hydroxyl-Fe- pillared bentonite[J]. J Photochem Photobiol: A, 2007, 188: 56-64.
[6] HSUEH C L, HUANG Y H, WANG C C, et al. Degradation of azo dyes using low iron concentration of Fenton and Fenton-like system [J]. Chemosphere, 2005, 58: 1409-1414.
[7] GARCIA-MONTANO J, TORRADES F, PEREZ-ESTRADA L A. Degradation pathways of the commercial reactive azo dye Procion Red H-E7B under solar-assisted photo-Fenton reaction [J]. Environ Sci Technol, 2008, 42: 6663-6670.
[8] LIANG X L, ZHONG Y H, ZHU S Y, et al. The decolorization of Acid Orange II in non- homogeneous Fenton reaction catalyzed by natural vanadium-titanium magnetite [J]. J Hazard Mater, 2010, 181: 112-120.
[9] 李欣玲,蓝咏,何广平,等. α-Fe2O3紫外光催化降解苯胺的研究[J]. 华南师范大学学报:自然科学版, 2009 (4): 69-74.
[10] SUN J, QIAO L, SUN S. Photocatalytic degradation of Orange G on nitrogen-doped TiO2catalysts under visible light and sunlight irradiation [J]. J Hazard Mater, 2008, 155: 312-319.
[11] XU X R, LI X Z. Degradation of azo dye Orange G in aqueous solutions by persulfate with ferrous ion[J]. Sep Purif Technol, 2010, 72: 105-111.
Keywords: Azo dye Orange G; homogeneous Fenton reaction; oxidative decolorization
ExperimentalInvestigationofOxidativeDecolorizationofOrangeGAzoDyeinAqueousSolutionbyHomogeneousFentonReaction
JIANG Qiangmin1, WU Honghai2*, DOU Xiaowen2
(1. Department of Chemical Engineering, Fujian Vocational and Technical College West, Longyan 364021, China; 2. School of Chemistry and Environment, South China Normal University, Guangzhou 510006, China)
Decolorization of azo dye Orange G (OG) in aqueous solution by homogeneous Fenton reaction was conducted. The effects of main parameters, including the initial concentration of OG, the dosages of ferrous ion and hydrogen peroxide (H2O2) along with the reaction temperature and the initial solution pH value, on the decolorization of the OG dye were investigated. The results showed that the homogenous Fenton process responsible for decolorizing OG in solution were effective and obeyed to second order kinetics with a good linear relationship (R2>0.989). With increasing the reaction temperature and appropriately decreasing the initial solution pH, the OG decolorization rate was enhanced accordingly. If the initial concentration of OG was appropriately decreased, the initial concentration of ferrous ion may be decreased also in ensuring to keep the decolorization efficiencies of OG to meet the environmental standard for dyes such as OG discharge concerning the color and iron ion discharge limits.
2011-07-22
国家自然科学基金项目(41072034);广东省自然科学基金项目(10151063101000028)
*通讯作者,wuhonghai@scnu.edu.cn
1000-5463(2012)01-0094-05
O643; X741
A
【责任编辑 成 文】
