Akt与ERK1/2在人骨关节炎软骨细胞中的表达*
2012-11-06赵洪海曾国庆张同恩王少杰王承云
程 亮, 赵洪海, 曾国庆, 张同恩, 王少杰, 石 磊, 王承云, 夏 春,△
(1福建医科大学协和临床医学院, 福建 福州 350000; 2厦门大学附属中山医院骨关节科, 福建 厦门 361000)
1000-4718(2012)05-0889-06
2011-10-26
2012-02-29
福建省自然科学基金资助项目(No.2010D007);福建省医学创新课题资助(No. 2011-CXB-36)
△通讯作者 Tel: 0592-2993080; E-mail: chunxia99@yahoo.com.cn
Akt与ERK1/2在人骨关节炎软骨细胞中的表达*
程 亮1, 赵洪海2, 曾国庆2, 张同恩2, 王少杰2, 石 磊2, 王承云2, 夏 春1,2△
(1福建医科大学协和临床医学院, 福建 福州 350000;2厦门大学附属中山医院骨关节科, 福建 厦门 361000)
目的观察蛋白激酶B(Akt)与细胞外信号调节激酶1/2(ERK1/2)在正常和骨关节炎(OA)软骨细胞中的表达,探讨Akt与ERK1/2在OA病程中的意义。方法手术中取5例正常和18例OA人膝关节软骨组织,包埋制备切片,免疫组织化学技术观察 p-Akt及p-ERK1/2在正常和OA 软骨组织中的表达;培养人软骨细胞,甲苯胺蓝染色、免疫组化鉴定并观察聚集蛋白聚糖及Ⅱ型胶原在正常和OA软骨细胞中的表达; Western blotting技术检测Akt、p-Akt、ERK1/2、p-ERK1/2、磷酸化70 kD核糖体蛋白S6激酶(p-p70S6K)及增殖细胞核抗原(PCNA)蛋白在正常和OA软骨细胞中表达水平; 实时荧光定量PCR技术检测聚集蛋白聚糖及Ⅱ型胶原在正常和OA软骨细胞中mRNA表达水平。结果与正常软骨细胞比较,OA软骨细胞内p-Akt和p-p70S6K蛋白表达明显降低(P<0.05),且聚集蛋白聚糖和Ⅱ型胶原mRNA和蛋白在OA软骨细胞中的表达水平降低(P<0.05),而 p-ERK1/2和PCNA蛋白表达明显提高(P<0.05)。结论Akt可能通过p-p70S6K来调控OA软骨细胞外基质聚集蛋白聚糖及II型胶原的合成,ERK1/2可能通过PCNA来调控OA软骨细胞增殖;Akt与ERK1/2可能参与了OA的病理过程。
骨性关节炎; 软骨细胞; 蛋白激酶B; 细胞外信号调节MAP激酶类; 蛋白合成; 细胞增殖
骨性关节炎(osteoarthritis,OA)是一种以关节软骨的变性、破坏及骨质增生为特征的慢性关节病,是引起中老年人关节疼痛的常见原因之一。流行病学调查表明,55岁以上中老年人OA的发病率为44%~70%,其中10%表现为各种功能障碍,且65岁以上的人群中的OA发病率男性为60%,女性为70%[1-2]。随着世界老龄化人口的增加,OA的发病率也呈现逐年上升趋势。软骨细胞是关节软骨中唯一的细胞,在软骨形成、代谢以及修复中起着举足轻重的作用[3]。蛋白激酶B(protein kinase B,PKB,又称Akt)是丝氨酸/酪氨酸家族成员之一,可促进细胞合成信号的转导,研究发现激活Akt可促进人骨性关节炎软骨细胞Ⅱ型胶原(type II collagen, COL2)、聚集蛋白聚糖(aggrecan,AGG)等分泌增多[4]。同时,细胞外信号调节蛋白激酶1/2(extracellular signal-regulated kinase1/2, ERK1/2)可促进细胞增殖信号的转导,激活ERK1/2信号通路可促进人骨性关节炎软骨细胞增殖,而ERK1/2特异性抑制剂可抑制细胞增殖反应[5]。但是,有关这2种信号分子在OA软骨细胞中的表达及相关功能了解尚少,本实验取人正常和OA组织制备切片;建立人正常和OA软骨细胞体外培养体系,观察p-Akt和p-ERK1/2 在正常和OA软骨组织及细胞中的表达差异,以期为临床探讨OA的病理生理提供一定的理论依据。
材 料 和 方 法
1标本
OA膝关节软骨组织取材自接受膝关节表面置换的 OA患者[18人,男性8 人,女性 10 人,平均年龄 62.7 岁(53~72岁) ]。OA 诊断依据美国风湿病协会 2001 年版指南。正常软骨组织取材于因车祸需截肢患者[5人,男性 4人,女性 1人,平均年龄27岁(18~35 岁) ],排除关节疾病病史。软骨标本取材均经过患者或家属知情同意。
2方法
2.1软骨细胞的分离、培养、细胞爬片及鉴定 术中无菌条件下取软骨,迅速在冷冻条件下带入无菌操作台,置于含双抗(HyClone)的PBS液中将软骨剪成1 mm×1 mm×1 mm大小,加入含 0.02% EDTA 的0.25%胰蛋白酶(Gibco)在37 ℃温箱孵30 min,1 000 r/min 离心7 min,弃上清,加入0.2%Ⅱ型胶原酶(Sigma)在37 ℃温箱消化过夜[6],200目滤网过滤,离心弃上清,PBS液漂洗3次,收集细胞,加入含10% 胎牛血清(Gibco)的高糖 DMEM 培养基(HyClone),将细胞均匀接种于培养皿中,置于 37 ℃、5% CO2培养箱内进行原代培养。倒置显微镜下观察细胞形态,并细胞爬片行甲苯胺蓝染色(购自国药集团化学试剂有限公司)及Ⅱ、Ⅹ型胶原免疫细胞化学染色鉴定(试剂盒购自福州迈新生物技术开发有限公司)。
2.2Western blotting检测 贴壁生长的人软骨细胞长至70%~80%汇合,0.25%胰酶+0.02%EDTA消化,收集细胞,加入适量RIPA裂解液(购自上海碧云天生物技术有限公司)[含1%PMSF(Sangon)、1%蛋白磷酸酶抑制剂(购自普利莱基因技术有限公司)和1%DTT(Sangon)],充分混匀,冰水浴45 min,每间隔5 min振荡混均1次;4 ℃ 12 000 r/min离心15 min,收集上清, BCA蛋白检测试剂盒(Pierce)定量,-20 ℃保存。取40 μg细胞总蛋白按常规方法进行10%SDS-聚丙烯酰胺凝胶电泳,电转移法将蛋白印迹转移至PVDF膜(GE)上,5%脱脂奶粉封闭。Ⅰ抗4 ℃过夜[Akt抗体、p-Akt抗体、ERK1/2抗体、p-ERK1/2抗体和磷酸化70 kD核糖体蛋白S6激酶(phosphorylated 70-kD ribosomal protein S6 kinase,p-p70S6K)抗体购自Cell Signaling Technology,稀释度分别为:1∶4 000、1∶2 000、1∶2 000、1∶2 000、1∶3 000;GAPDH抗体和增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)抗体购自Epitomics,稀释度分别为1∶4 000和1∶1 000];Ⅱ抗为HRP标记的羊抗兔IgG或羊抗鼠IgG(Proteinteach Group),25 ℃恒温下1 h,ECL(Millipore)发光法测定反应条带灰度值,以GAPDH作为内参照,计算相对值。
2.3实时荧光定量PCR检测 取对数生长期细胞,经Trizol(Invitrogen)法抽提细胞总RNA,定量。逆转录条件为:42 ℃逆转录60 min,-20 ℃保存。Real-time PCR条件为:95 ℃ 15 s,60 ℃ 30 s,72 ℃ 30 s,循环40次。反应体系构成: cDNA 模板2 μL、MaximaTMSYBR Green/ROX qPCR Master Mix (2×) (Fermentas)10 μL、上下游引物(300 nmol/L)各 1 μL、DEPC H2O 6 μL;引物序列见表1[7];PCR反应采用 Applied Biosystems 7500系统(ABI) ,观察AGG和COL2 mRNA在正常和 OA软骨细胞之间的表达差异,实验重复 3 次。组间差异应用 2-ΔΔCt法计算。产物用2%琼脂糖凝胶电泳,一般恒压130 V、30 min即可,Bio-Rad凝胶成像系统显像。

表1 Real-time PCR 引物序列
2.4免疫组化检测 术中取材的软骨组织4%多聚甲醛固定1周, EDTA脱钙液脱钙2周,修整组织标本后梯度乙醇脱水,石蜡包埋,切片(厚度 4 μm),贴片后经60 ℃烘烤过夜。二甲苯、乙醇梯度入水,用PBS(pH 7.4)冲洗3次,每次3 min,然后用抗原修复液进行抗原修复。滴加过氧化酶阻断溶液,室温孵育10 min后,用PBS(pH 7.4)冲洗3次,每次3 min,滴加正常非免疫动物血清,室温孵育10 min后,滴加Ⅰ抗,4 ℃过夜。用PBS(pH 7.4)冲洗3次,每次3 min,滴加生物素标记的第Ⅱ抗体,室温孵育10 min后,用PBS(pH 7.4)冲洗3次,每次3 min,滴加链霉菌抗生物素-过氧化物溶液,室温孵育10 min后,用PBS(pH 7.4)冲洗3次,每次3 min。添加 DAB 显色,显微镜下观察3~10 min,充分水洗后苏木素复染,自来水冲洗返蓝,再经过梯度乙醇脱水干燥,二甲苯透明,中性树胶封片后显微镜下观察结果,图像资料导入 Image-Pro Plus 6.0 软件进行分析。阳性表达细胞判定标准为: 细胞内出现棕色染色的颗粒或斑块,并采用细胞内颗粒或斑块表达量进行定量分析。
3统计学处理

结 果
1软骨细胞的形态及鉴定
分离培养的软骨细胞外观呈多角形,胞质丰富,胞核清楚,核为圆形或椭圆形,位于胞体中心,核仁为1~3个,细胞折光性好,且呈集落生长。甲苯胺蓝染色使正常软骨细胞胞浆呈蓝色,可见1~3个核仁,呈紫蓝色,见图1 A1;OA软骨细胞相对于正常软骨细胞,胞浆染色稍浅,见图1A2。正常软骨细胞Ⅱ型胶原免疫组化染色呈阳性反应,细胞胞浆内有黄色颗粒,胞核基本无着色,见图1B1;OA软骨细胞相对于正常软骨细胞,胞浆颗粒颜色稍浅,见图1B2。正常软骨细胞X型胶原免疫组化染色呈强阳性反应,细胞胞浆和胞核内均有棕黄色颗粒,见图1C2;OA软骨细胞相对于正常软骨细胞,胞浆和胞核内颗粒颜色稍深,见图1C1。
2人正常和OA软骨细胞中Akt、p-Akt、ERK1/2、p-ERK1/2、p-p70S6K和PCNA的表达水平
Western blotting检测显示,OA软骨细胞中Akt和ERK1/2表达水平与正常软骨细胞相比无明显差异(P>0.05),见图2;与正常软骨细胞相比,OA软骨细胞中p-Akt和p-p70S6K表达水平明显降低,差异有统计学意义(P<0.05),见图2;OA软骨细胞中p-ERK1/2和PCNA表达水平与正常软骨细胞相比明显升高,差异有统计学意义(P<0.05),见图2。
3人正常和OA软骨细胞中COL2和AGGmRNA的表达水平
Real-time PCR结果显示,与人正常软骨细胞相比,OA软骨细胞中COL2和AGG mRNA表达水平明显降低,差异有统计学意义(P<0.05),见图3。

Figure 1. The identification of the normal and osteoarthritic (OA) chondrocytes.A1: the expression of aggrecan in OA chondrocytes(toluidine blue staining,×200);A2:the expression of aggrecan in normal chondrocytes(toluidine blue staining,×200);B1: the expression of type II collagen in OA chondrocytes(immunocytochemical staining,×200);B2:the expression of type II collagen in normal chondrocytes(immunocytochemical staining,×200);C1:the expression of type X collagen in normal OA chondrocytes(immunocytochemical staining,×200);C2:the expression of type X collagen in normal chondrocytes(immunocytochemical staining,×200).
图1正常和OA软骨细胞的鉴定
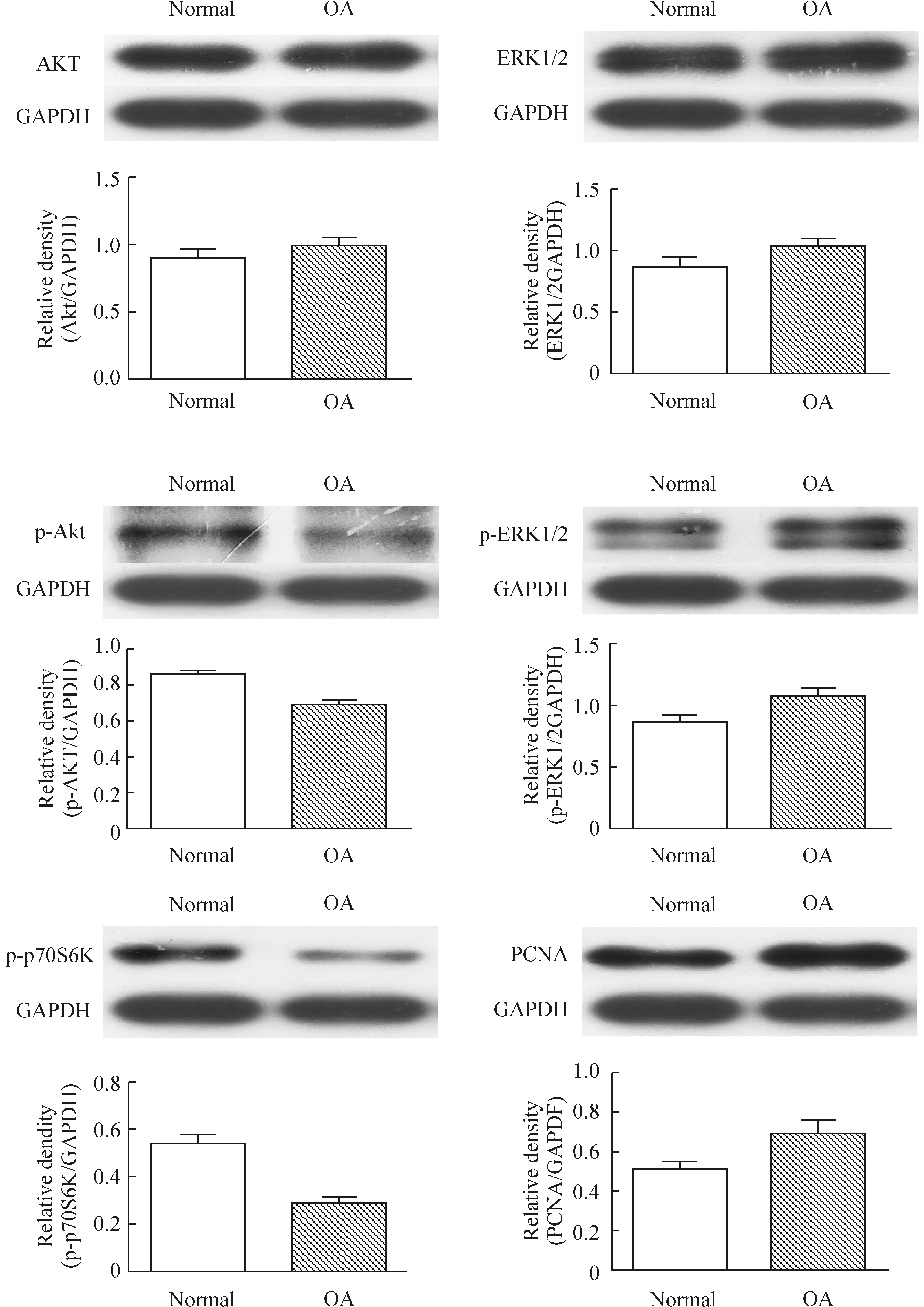

图2正常和OA细胞中Akt、p-Akt、ERK1/2、p-ERK1/2、p-p70S6K和PCNA蛋白表达水平
4人正常和OA软骨组织中Akt和ERK1/2表达水平
免疫组化结果显示正常和OA软骨组织内软骨细胞中均有p-Akt表达,分布在细胞胞浆内;且p-Akt在OA软骨组织中整体表达水平低于正常软骨组织,见图4A、B。而正常和OA软骨组织内软骨细胞胞浆与胞核中均表达p-ERK1/2,但p-ERK1/2在OA软骨组织中整体表达水平明显高于正常软骨组织,见图4C、D。
讨 论
传统观点认为软骨基质的合成和降解失衡是OA的主要发病机制,软骨细胞作为软骨组织中唯一的细胞,在细胞外基质(即胶原和蛋白聚糖)的合成、分解以及相应功能的维持方面具有重要作用。在OA病变过程中,软骨细胞经历了肥大分化、终末分化、矿化等变化过程,而细胞功能也随之发生变化,即合成分泌的胶原和蛋白多糖的类型发生改变以及受到病理刺激后的反应性增殖等。如软骨细胞病变可引起细胞外基质包括胶原蛋白类型及聚集蛋白聚糖分子大小等显著改变,对OA的发生、发展产生决定性的影响[8];正常软骨细胞是没有增殖能力的,而OA软骨细胞与之相比有一定的增殖能力[9]。因此,软骨细胞的功能调节是OA病程的关键。


图3正常和OA软骨组织细胞中II型胶原和聚集蛋白聚糖mRNA表达水平

Figure 4. p-Akt and p-ERK1/2 expression in the normal and OA cartilage (immunohistochemical staining,×400).A: the expression of p-Akt in OA cartilage;B: the expression of p-Akt in normal cartilage;C: the expression of p-ERK1/2 in OA cartilage;D: the expression of p-ERK1/2 in normal cartilage.
图4p-Akt和p-ERK1/2在正常和OA软骨组织中的表达
众多信号通路参与软骨细胞的调节,其中作为PI3K-Akt信号通路的关键酶,已有研究显示Akt通过磷酸化作用后使其活化,导致AGG和COL2合成和表达显著上升,抑制PI3K/Akt可使软骨细胞AGG和COL2合成下降[10]。
前期工作及本实验均显示OA软骨组织中p-Akt表达降低[11],并且这里还证实p-Akt表达在OA软骨细胞中明显下降,并且其下游底物之一p70S6K的磷酸化水平也同步下降,表明OA 中Akt/p70S6K通路受到抑制。p70S6SK作为Akt的下游激酶,其发生磷酸化可导致核糖体蛋白合成的开始和增加。进一步观察显示作为软骨基质主要成分的AGG和COL2在OA软骨细胞内的mRNA水平也呈下降趋势。即与正常关节软骨细胞比较,在OA软骨细胞中伴随Akt/p70S6K的抑制,AGG和COL2 mRNA水平也出现同步下降,结合以往学者的观察结果,提出OA软骨细胞内Akt/p70S6K通路的抑制可能与AGG和COL2 mRNA水平降低相关,推测可能正是Akt/p70S6K的抑制导致软骨细胞正常分化表型COL2和AGG表达水平下降。当然Akt/p70S6K的通路受抑制不仅限于对蛋白合成的影响,可能也涉及到细胞增殖、存活调节等,其作用机制有待进一步研究。
MAPK-ERK1/2信号通路是把细胞外信号转导到核内调控基因表达的重要细胞内信号分子,是不同促增殖因子调控的共同通路,参与多种细胞的增殖、分化[12]。本研究结果显示p-ERK1/2在OA软骨细胞中表达水平较正常软骨细胞呈现上调趋势,并在组织中也发现了p-ERK1/2在OA软骨组织中的表达上调。而且同时我们检测到作为细胞增殖状态指标之一的PCNA[13]在OA软骨细胞中表达呈上调趋势,揭示出OA软骨细胞增殖能力可能强于正常软骨细胞。显而易见,ERK1/2参与调控OA软骨细胞的病理改变,并可能通过调控PCNA而致OA软骨细胞增殖能力增加。
众所周知OA的病理发展是一个复杂的并受多种信号通路调节影响的过程,它不受任一信号通路(包括Akt和ERK1/2)单独调节。在任何时候软骨细胞内都有大量信号通路的激活,各信号通路之间的相互串话、正负反馈循环以及大量信号整合的结果决定软骨细胞最后的反应(包括软骨细胞的合成代谢、分解代谢、细胞增殖、细胞凋亡等等)。例如有研究表明Akt信号通路也参入调控OA软骨细胞增殖,ERK1/2信号通路也参入调控OA软骨细胞蛋白合成[9-14]。虽然本文的结果支持Akt的生物功能可能与OA软骨细胞蛋白合成功能相关联,ERK1/2的生物功能可能与OA软骨细胞增殖相关联,但软骨细胞 II 型胶原等产物的合成代谢可能受到其它信号调控因子的综合影响,不能以Akt调控“一元论”解释;软骨细胞的增殖反应也可能受到其它信号调控因子的综合影响,不能以ERK1/2调控“一元论”解释;如生长激素、表皮生长因子、胰岛素、肿瘤坏死因子-α等也参入软骨细胞的合成代谢、分解代谢、细胞增殖、细胞凋亡等调控[15-17]。
[1] Zhang W, Nuki G, Moskowitz RW, et al. OARSI recommendations for the management of hip and knee osteoarthritis: part III: changes in evidence following systematic cumulative update of research published through January 2009[J]. Osteoarthritis Cartilage, 2010, 18(4): 476-499.
[2] Matheson AJ, Perry CM. Glucosamine: a review of its use in the management of osteoarthritis[J].Drugs Aging, 2003,20(14) : 1041-1060.
[3] Kronenberg HM. Developmental regulation of the growth plate[J]. Nature, 2003, 423(6937): 332-336.
[4] Starkman BG, Cravero JD, Delcarlo M, et al. IGF-I stimulation of proteoglycan synthesis by chondrocytes requires activation of the PI 3-kinase pathway but not ERK MAPK[J]. Biochem J, 2005. 389(Pt 3): 723-729.
[5] Hayashi S, Nishiyama T, Miura Y, et al. DcR3 induces cell proliferation through MAPK signaling in chondrocytes of osteoarthritis[J]. Osteoarthritis Cartilage, 2011, 19(7): 903-910.
[6] Wang X, Li F,Fan C, et al. Effects and relationship of ERK1 and ERK2 in interleukin-1β-induced alterations in MMP3, MMP13, type II collagen and aggrecan expression in human chondrocytes[J]. Int J Mol Med, 2011, 27(4):583-589.
[7] Prasadam I, Friisa T,Shi W, et al. Osteoarthritic cartilage chondrocytes alter subchondral bone osteoblast differentiation via MAPK signalling pathway involving ERK1/2[J]. Bone, 2010, 46(1):226-235.
[8] Aigner T, Söder S, Gebhard PM, et al. Mechanisms of disease: role of chondrocytes in the pathogenesis of osteoarthritis-structure, chaos and senescence[J]. Nat Clin Pract Rheumatol, 2007, 3(7): 391-399.
[9] Rothwell AG, Bentley G. Chondrocyte multiplication in osteoarthritic articular cartilage[J]. J Bone Joint Surg Br, 1973, 55(3):588-594.
[10]Yin W, Park JI, Loeser RF. Oxidative stress inhibits insulin-like growth factor-I induction of chondrocyte proteoglycan synthesis through differential regulation of phosphatidylinositol 3-kinase-Akt and MEK-ERK MAPK signaling pathways[J]. J Biol Chem, 2009, 284(46):31972-31981.
[11]陈青植,余跃伟,夏 春,等. Akt和Bad信号分子在人膝骨性关节炎中的变化[J].中国组织工程研究与临床康复,2010,14 (33): 6175-6178.
[12]Force T, Bonventre JV.Growth factors and mitogen-activated protein kinases[J].Hypertension, 1998, 31(1 Pt 2):152-161.
[13]Kelman Z. PCNA: structure,functions and interactions[J].Oncogene, 1997, 14(6):629-640.
[14]Huang JG, Xia C,Zhang B, et al. 17β-Estradiol promotes cell proliferation in rat osteoarthritis model chondrocytes via PI3K/Akt pathway[J]. Cell Mol Biol Lett,2011, 16(4):564-575.
[15]潘思年,张成喜,李燕虹,等.GH与EGFR受体后信号交联在GH促进青春期大鼠生长板软骨细胞增殖中的作用[J].中国病理生理杂志,2010,26(11):2246-2252.
[16]叶 伟,黄东生,梁安靖,等.TNF-α对兔软骨终板细胞增殖凋亡及基质形成的影响[J].中国病理生理杂志,2008,24(9):1830-1834.
[17]崔蕴霞,狄静芳,曾耀英,等.成纤维细胞生长因子和胰岛素对小鼠软骨细胞增殖的影响[J].中国病理生理杂志,2003,19(3):394-396.
ExpressionofAktandERK1/2inhumanosteoarthriticchondrocytes
CHENG Liang1, ZHAO Hong-hai2, ZENG Guo-qing2, ZHANG Tong-en2, WANG Shao-jie2, SHI Lei2, WANG Cheng-yun2, XIA Chun1,2
(1UnionSchoolofClinicalMedicine,FujianMedicalUniversity,Fuzhou350000,China;2DepartmentofOrthopaedics,ZhongshanHospitalofXiamenUniversity,Xiamen361000,China;E-mail:chunxia99@yahoo.com.cn)
AIM: To investigate the expression of protein kinase B (Akt) and extracellular signal-regulated kinase 1/2 (ERK1/2) in normal and osteoarthritic chondrocytes.METHODSThe samples of knee cartilage were obtained from the normal donors (n=5) and the patients (n=18) undergoing total knee arthroplasty with the diagnosis of osteoarthritis (OA). The expression of p-Akt and p- ERK1/2 in the normal and osteoarthritic cartilage tissues was detected by the method of immunohistochemistry. The chondrocytes were isolated and identified by toluidine blue staining and immunohistochemical method. The expression levels of Akt, p-Akt, ERK1/2,p-ERK1/2,phosphorylated 70-kD ribosomal protein S6 kinase(p-p70S6K) and proliferating cell nuclear antigen(PCNA) were tested in normal and osteoarthritic chondrocytes by Western blotting. Real-time fluorescence quantitative PCR was used to measured the expression levels of aggrecan and type II collagen gene in normal and osteoarthritic chondrocytes.RESULTSThe expression of p-Akt in normal cartilage was higher than that in OA cartilage. The expression of p- ERK1/2 in OA cartilage was higher than that in normal cartilage. Compared with the normal chondrocytes, the expression of p-Akt and p-p70S6K, and the mRNA levels of aggrecan and type II collagen were increased (P<0.05), and the expression of p-ERK1/2 and PCNA was decreased in OA chondrocytes (P<0.05).CONCLUSIONAkt might regulate aggrecan and type II collagen synthesis via p-p70S6K, and ERK1/2 might regulate OA chondrocyte proliferation through PCNA. Both Akt and ERK1/2 play important roles in the pathogenesis of OA.
Osteoarthritis; Chondrocytes; Protein kinase B; Extracellular signal-regulated MAP kinases; Protein synthesis; Cell proliferation
R363.1
A
10.3969/j.issn.1000-4718.2012.05.021
