多胺化壳聚糖微球固定化AS1.398中性蛋白酶
2012-10-30王红艳朱建星
王红艳, 朱建星
(沈阳化工大学制药与生物工程学院,辽宁沈阳 110142)
蛋白酶是水解蛋白质的一群酶类,固定化中性蛋白酶可应用于啤酒澄清、各种蛋白水解液的制备等方面.构建性能优良的载体往往是酶固定化成功与否的关键.壳聚糖(Chitosan,CS)是地球上仅次于纤维素的第二大类天然高分子材料,壳聚糖分子链上含有大量的氨基和羟基,具有化学性质稳定、生物相容性好、无毒,以及可生物降解、不污染环境等优点,易于制成膜、多孔微珠、凝胶、纳米粒子等多种形态.壳聚糖被选择作为固定化载体,在固定化酶并保持其活性方面有独特的优点[1-4].在几类固定化方法中,以共价结合法制备的固定化酶性能最为稳定,符合工业化要求.研究表明,增加载体的亲水性、增加载体活性侧基手臂分子的长度甚至构建所谓“柔性链”有利于提高固定化酶活性[2-6].
为适应酶法生产工艺的实际要求,本文先从微米级单分散壳聚糖微球树脂出发,经氨基保护、C6羟基环氧化后与亲水性多胺偶联,制备多胺化壳聚糖微球载体,与未经多胺修饰的壳聚糖微球相比较,考察该偶联了亲水多胺分子链的壳聚糖微球载体对AS1.398中性蛋白酶的固定化效果.
1 实验部分
1.1 主要药品及仪器
壳聚糖,脱乙酰度86.9%,济南海得贝海洋生物有限公司,CS微球,实验室自制;环氧氯丙烷,AR,沈阳市新西试剂厂;四乙烯五胺,CP,天津市科密欧化学试剂有限公司;AS1.398中性蛋白酶,北京东盛华强生物技术有限公司,50 000 U/g.其他试剂均为分析纯.
电动搅拌器,常州国华JJ-1;恒温振荡器,常州国华SHA-B;扫描电镜,JEOL JSM-6360LV;紫外分光光度计,尤尼柯UV2000.
1.2 多胺化壳聚糖微球的制备
按文献[6]方法,略有改进:称取CS微球5 g于100 mL甲醇中,滴加25 mL苯甲醛,于恒温振荡器中60℃反应16 h,抽滤洗涤后将微球(壳聚糖的苯甲醛Schiff碱)浸泡在适量氢氧化钠溶液中、加入60 mL环氧氯丙烷,50℃恒温振荡反应4 h,抽滤洗涤后将环氧化微球置于100 mL乙醇中,加入100 mL四乙烯五胺或聚乙烯亚胺、适量氢氧化钠水溶液,55℃反应6 h,抽滤,最后将胺化反应产物加入0.25 mol/L的盐酸中搅拌48 h脱醛,调pH值到弱碱性后用蒸馏水充分洗涤,干燥,得终产品多胺化壳聚糖微球.以酸碱滴定法测定微球的氨基含量.
1.3 中性蛋白酶的固定化
称取适量多胺化壳聚糖微球置于烧瓶中,按5~6倍氨基摩尔数的量加入戊二醛,于乙醇中60℃反应2 h,然后用蒸馏水、pH=8.0的Tris-HCl缓冲液洗涤,真空干燥,称取干燥产品0.3 g于50 mL的三角瓶中,加入1 mL质量浓度为5 g/L的中性蛋白酶溶液(经纱布过滤)和19 mL的Tris-HCl缓冲液,室温下连续振荡反应20 h,固定化酶用缓冲液洗涤数次,备用.
1.4 酶的活力测定
在锥形瓶中依次加入1 mL酶液(或0.3 g固定化酶),加入10 mL已40℃预热5 min的酪蛋白溶液(质量分数1%,pH=7.5的Tris-HCl缓冲液配制),40℃振荡反应10 min,然后加入10 mL三氯乙酸溶液(质量分数10%),振摇,过滤,用Folin试剂显色法测定滤液中的酪氨酸含量,以每分钟释放1 μg的酪氨酸的酶量定义为一个活力单位(U).
固定化酶的活力回收率=(固定化酶总活力/加入的游离酶总活力)×100%.
2 结果与讨论
2.1 固定化载体的表面形貌
图1所示为固定化载体微球的SEM照片.

图1 固定化载体微球的扫描电镜图Fig.1 SEM image of immobilization support microspheres
从图1可以看出,多胺化壳聚糖微球粒径为60 ~200 μm,多数粒径分布在 100 μm 左右,较为均一,表面较光滑,这有利于减少固定化酶催化反应过程中的扩散限制效应的不利影响.
2.2 酶用量对固定化酶活力回收率的影响
考虑到节能,未选择低温或高于酶的最适作用温度下进行固定化.在室温,pH=8.0的条件下以不同酶用量固定20 h,制备固定化酶,结果如图2所示.

图2 酶用量对固定化酶活力及活力回收率的影响Fig.2 Effect of amount of enzyme on activity and recovery of immobilized enzyme
由图2可知,随着游离酶投加量的增加(固定化时加入的游离酶质量浓度增大),固定化酶活力在不断升高,游离酶质量浓度1~5 g·L-1时固定化酶活力上升的速度快,给酶量大(游离酶质量浓度大于5 g·L-1)时固定化酶活力增加趋缓.由图2还可知,酶用量增加时,活力回收率由60%左右不断下降.其原因之一是固定化体系中的酶分子达到一定浓度时,被固定在载体表面的酶分子数量趋于饱和,当酶用量再增加时,被固定化的酶量并未增加或增加很少,表现为酶活力回收率下降.加入的游离酶浓度越大,固定化酶的活力回收率越低.另一方面,固定化反应体系中的酶量多时,一部分酶分子被非定向固定化在载体表面,这些酶分子的高级构象发生改变甚至活性中心被遮蔽,造成这些酶分子的活力降低甚至失活(无效固定化),从而使固定化酶的表观活力未与被固定的酶蛋白量成比例增加,酶活力回收率亦下降.为兼顾固定化酶活力和酶活力回收率,选择适中的酶溶液质量浓度5 g·L-1,这样可既保证有较高的固定化酶活力回收率(49%),同时固定化酶活也较高(384 U·g-1).
2.3 固定化时间对固定化酶活力回收率的影响
投加的游离酶质量浓度为5 g·L-1,在室温,pH=8.0的条件下对中性蛋白酶分别固定化不同时间,测定固定化酶的活力回收率,结果如图3所示.

图3 固定化时间对固定化酶活力回收率的影响Fig.3 Effect of immobilization time on recovery of immobilized enzyme
由图3可知:固定化时间少于20 h时,固定化酶的活力上升较快,于20~25 h固定化酶活力回收率趋于稳定,达到50%,随后下降.这是因为在固定化初始阶段酶分子以较快速度与载体结合,表现为固定化酶活力迅速上升;随着时间的延长,载体表面结合的酶分子越来越多而发生拥挤,导致部分酶分子的高级构象发生细微变化,甚至有一些酶分子的活性中心被遮蔽,影响了底物及产物的传质扩散,使部分被固定的酶分子的活力下降,当之后新固定上去的酶分子带来的活力增加量与已被固定的酶分子的活力下降幅度相当时,表现为固定化酶活力增加趋缓;当固定化后期,载体表面结合的酶分子数量已经趋于饱和,活力下降的酶分子数亦较多,体系中酶分子的稳定性随振荡时间的延长也出现下降,从而使固定化酶的表观活力下降.综上,最适固定化时间可确定为20 h.
2.4 固定化pH值对固定化酶活力回收率的影响
投加的游离酶质量浓度为5 g·L-1,于室温下分别在不同pH值条件下对中性蛋白酶固定化20 h,测定固定化酶的活力回收率,结果哪图4所示.从图4可看出,该固定化过程的最适pH值为8.0.
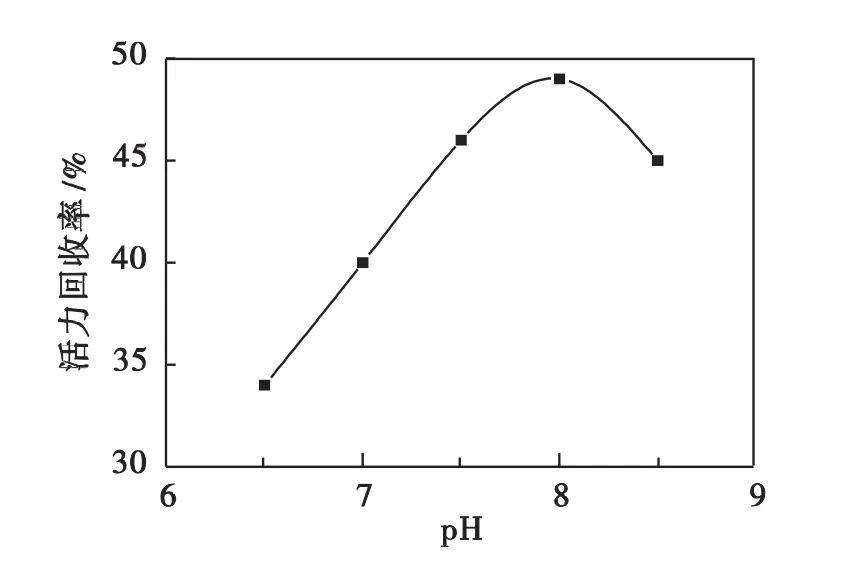
图4 固定化pH对固定化酶活力回收率的影响Fig.4 Effect of pH value on recovery of immobilized enzyme
2.5 多胺化壳聚糖微球与壳聚糖微球固定化效果的比较
用壳聚糖微球和多胺化壳聚糖微球载体分别经戊二醛活化后,分别以最优条件对中性蛋白酶进行固定,结果见表1.由表1可知,采用多胺化壳聚糖微球载体制备的固定化中性蛋白酶活力回收率达40%~50%,远高于采用未经多胺修饰的壳聚糖微球固定化中性蛋白酶的活力回收率.

表1 多胺化壳聚糖微球与壳聚糖微球固定化中性蛋白酶的比较Table 1 Comparison of immobilized neutral proteinase on different supports
图5所示为壳聚糖和多胺化壳聚糖的结构.对比壳聚糖和多胺化壳聚糖的结构可知:壳聚糖微球经多胺化修饰后的氨基含量大大提高,使之与戊二醛的活化连接位点数量大大增加,也即提高了酶装载量;且由于酶分子与载体微球之间间隔有亲水性多胺分子,不仅可减小底物分子向酶活性中心扩散限制阻力,还可在反应体系中赋予被固定的酶分子一定的自由度,有利于保持酶分子在游离状态下的活性构象,从而获得较高的酶活.

图5 壳聚糖和多胺化壳聚糖的结构Fig.5 Configuration of Chitosan and polyamine Modified Chitosan
2.6 固定化酶的性能
2.6.1 热稳定性
将固定化酶及游离酶在70℃下保温1 h之后,再在40℃下测酶活力,发现固定化酶活力仍有原活力的62%,而游离酶保温后活力只有原活力的20%,因此固定化酶具有较好的热稳定性.
2.6.2 储存稳定性
将固定化酶在4℃下储存30 d后,仍保留有原活力的78%,而游离酶在4℃下储存5 d后,其活力只为初始酶活力的一半,由此可见,固定化酶的储存稳定性远远高于游离酶.
2.6.3 操作稳定性
固定化中性蛋白酶连续使用不同批次后的相对活力变化结果见表2.
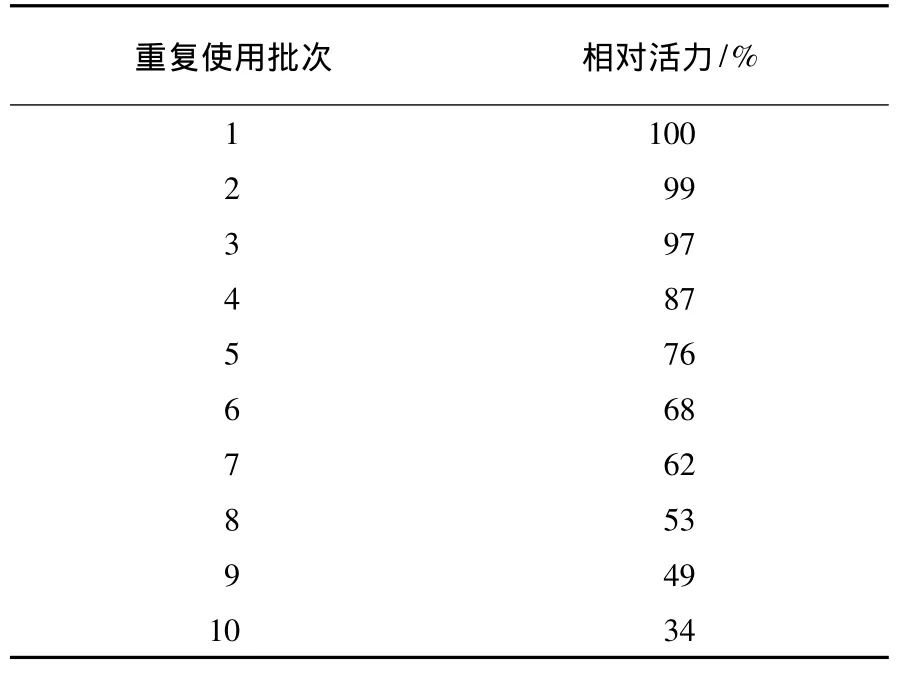
表2 固定化酶的连续使用稳定性Table 2 Use stability of immobilized enzyme
由表2可见,固定化酶连续重复使用9批次后仍保留有原固定化酶活力的一半.
3 结论
从制备的单分散壳聚糖微球树脂出发,经氨基保护、C6羟基环氧化、多胺化、脱醛等步骤制备了微米级多胺化壳聚糖固定化载体,氨基含量提高2倍以上.该载体对中性蛋白酶固定化效果较好,最佳固定化条件为:游离酶投加的质量浓度为5 g·L-1,25℃,pH=8的条件下固定中性蛋白酶20 h,固定化酶表观活力最高达384 U/g,固定化酶活力回收率达49%,是采用未改性壳聚糖微球固定化的2.7倍.该固定化中性蛋白酶的稳定性较好,热稳定性、贮存稳定性及操作稳定性均优于游离酶.
[1] Barbara K.Application of Chitin-and Chitosan-based Materials for Enzyme Immbilizations:A Review[J].Enzyme and Microbial Technology,2004,25:126-139.
[2] Cellapandian M,Krishnan M R V. Chitosan-poly(glycidyl methacrylate)copolymer for Immobilization of Urease[J].Process Biochem,1998,33(6):595-600.
[3] Giovanni Spagnaa,Riccardo N Barbagalloa,Daniele Casarinib,et al.A Novel Chitosan Derivative to Immobilize α-L-rhamnopyranosidase from Aspergillus Niger for Application in Beverage Technologies[J].Enzyme and Microbial Technology,2001,28:427-438.
[4] Ghanem A,Ghaly A.Immobilization of Glucose Oxidase in Chitosan Gel Beads[J].J.Appl.Polym.Sci,2004,91(2):861-866.
[5] 朱建星,王红艳,张万忠,等.用于酶固定化的多胺化壳聚糖基载体的合成及性能表征[J].精细化工,2008,25(4):333-337.
[6] 王红艳,朱建星,张万忠,等.多胺柔性链改性壳聚糖微球固定化木瓜蛋白酶[J].食品工业科技,2010,31(3):267-270.
