耳鲍消化酶活力的研究
2012-10-23王林桂王小兵
王林桂 , 王小兵 , 黄 勃
(1. 海南大学 海洋学院, 海南 海口 570228; 2. 海南大学 材料与化工学院, 海南 海口570228)
耳鲍消化酶活力的研究
王林桂1, 王小兵2, 黄 勃1
(1. 海南大学 海洋学院, 海南 海口 570228; 2. 海南大学 材料与化工学院, 海南 海口570228)
对人工养殖条件下体长0.52~7.05cm耳鲍(Haliotis asinina)的消化酶活力进行了研究。结果表明,淀粉酶活力随体长的增加而减小, 纤维素酶活力随体长的增加而递增, 脂肪酶活力随体长的增加无明显变化, 不同部位酶活力依次为: 胃 > 消 化腺 > 肠。方差分析表明: 同体长组别, 淀粉酶活力在胃、肠间存在显著差异(P<0.05), 在消化腺与肠间, 胃与消化腺间无显著差异(P>0.05); 纤维素酶活力在胃与消化腺、肠间存在显著差异(P<0.05), 在消化腺与肠间无显著差异(P>0.05)。
耳鲍(Haliotis asinina); 消化酶活力; 消化腺
耳鲍(Haliotis asinina)又称驴耳鲍, 是一种海产经济贝类, 具有极高的食用价值和药用价值[1]。耳鲍隶属于软体动物门(Mollusca)、腹足纲(Gastropoda)、前鳃亚纲(Prosobranchia)、原始腹足目(Archaeogastropoda)、鲍科(Haliotidae)、鲍属(Haliotis)[2]。耳鲍和九孔鲍及杂色鲍同属暖水性鲍, 分布于热带和亚热带海洋。在中国主要分布在东南沿海, 以海南岛沿海分布较多, 是重要的鲍鱼经济品种之一。2002年作者对耳鲍人工养殖的可行性进行了研究, 2004年获得国家 863计划资助进一步对人工育苗进行研究并取得了成功, 目前, 正在进行大规模人工养殖推广。从其他海洋动物人工养殖推广的经验来看, 研制出符合动物生长发育营养需求的全价人工饲料是成功推广的关键之一, 而动物消化酶活性是决定饲料配方的理论基础[3]。国外对鲍消化酶的研究早有报道,如: 日本盘鲍(H.discus discus)[4-5], 皱纹盘鲍(H.discus hannai)[6-7], 西式鲍(H.sieboldii)[8-10], 大鲍(H.gigantean)[11], 南非鲍(H.midae)[12-16], 黑唇鲍(H.rubra)[17], 绿唇鲍(H.laevigata)[18], 绿鲍(H.fulgens)[19-20].国内对鲍消化酶的研究报道有皱纹盘鲍[21-22]以及杂色鲍和九孔 鲍[23], 这些研究成果表明不同种鲍的消化酶活力有明显差异, 同种鲍不同生长阶段消化酶活力也有明显差异。耳鲍消化酶的研究, 国内未见报道。
1 材料和方法
1.1 实验材料
本研究所用材料于2007年6月取自海南省三亚市渔业贸易公司龙坡鲍鱼基地, 按规格不同共分为7组, 每组5只鲍鱼, 其平均体长如表1所示。
1.2 样品处理及酶测定方法
将规格在3 cm以上各组的样品分别去壳后解剖出消化腺、胃和肠, 放入研钵中加入冰水混合物分别进行充分研磨, 规格1.3 cm以下个体进行整体研磨。研磨在0~4℃条件下进行, 研磨液4 000 r/min离心3次, 每次 5 min, 弃沉淀, 取上清液测定各种消化酶活力。
1.2.1 纤维素酶活力的测定
纤维素酶活力的测定参考文献[24],其反应原理为纤维素酶从纤维素中分解出还原糖。还原糖又同3,5-二硝基水杨酸发生反应, 产生一种黄橙混合色,可通过用分光光度法测定其色深, 来算出纤维素酶的活力。具体操作为将1.0 mL酶溶液滴入一支具有刻度的 25 mL试管, 置于水浴中加热至 40℃。加4.0 mL已预热的底物溶液, 混合, 精确5 min之后加1.0 mL 2mol/LNaOH溶液和2.0 mL指示剂溶液, 使其反应终止。将试管置于沸水浴中, 5 min后流水冷却。用蒸馏水定容到20 mL后用分光光度计在490 nm处以空白值参比测定吸光度, 并以1mL灭活酶液代替作为空白对照。10个纤维素酶单位相当于每分钟内释放出相当于 1µmol葡萄糖的还原糖量时所需要的酶量。

表1 不同组别耳鲍的平均体长Tab. 1 The average body length of Haliotis asinina
1.2.2 淀粉酶活力的测定
淀粉酶活力的测定参考文献[24], 其原理为淀粉酶从淀粉中分解出还原物质。可以从其与3, 5-二硝基水杨酸的还原反应能力来测定这些还原物质,以一水麦芽糖计算。其具体操作步骤为: 用移液管将1.0 mL底物溶液移入一试管, 并加热至25℃。加1.0 mL酶溶液摇匀, 保温3 min后加2 mL指示剂溶液,终止反应。将此溶液置于水浴中5 min后, 取出来置于冰水中或进行流水冷却, 随后用蒸馏水定容至 20 mL。用分光光度计在490 nm处, 以空值为参比测定其颜色深度。并以1 mL灭活酶液代替作为空白对照。1个淀粉酶单位(用U表示)相当于在规定条件下释放1 mg还原碳水化合物(以一水麦芽糖计算)时所需酶量。
1.2.3 脂肪酶活力的测定
脂肪酶活力的测定参考文献[25], 脂肪酶为一种水解酶, 在一定条件下, 可以把甘油三酯脂肪逐步水解, 最后生成甘油及相应的脂肪酸。用已知浓度的标准溶液对水解进行滴定, 即可定量求出脂肪酸的量, 从而求出脂肪酶活力。具体操作步骤为: 加 5 mL pH 7.5, 浓度为0.025 mol/L磷酸缓冲液和4 mL聚乙烯醇橄榄油乳化液于三角瓶中, 置 40℃水浴中预热10 min。加入酶液1mL, 40℃保温15 min, 立即加入 15mL95%的乙醇终止酶反应。加酚酞指示剂2~3滴后以浓度为0.05 mol/LNaOH标准溶液滴定到微红色, 记下NaOH溶液的消耗体积, 并以1 mL灭活酶液代替作为空白对照。1个脂肪酶单位(用U表示)相当于在实验条件下释放出 1 µmol醋酸所需的量。
1.3 数据处理与分析
实验所得数据采用SPSS11.0统计软件进行方差分析, 0.05作为差异显著水平。
2 结果与分析
2.1 不同体长耳鲍淀粉酶活力
从表 2可知, 在人工养殖条件下, 淀粉酶活力随着体长的增加而减小, 体长 3cm以上耳鲍胃、消化腺和肠中淀粉酶活力平均值依次为: 7.55、7.18、7.05, 不同部位淀粉酶活力依次为: 胃 > 消 化腺>肠。同体长组别, 淀粉酶活力在胃与肠间显著差异(P<0.05), 在胃与消化腺、消化腺与肠间无显著差异(P>0.05)。
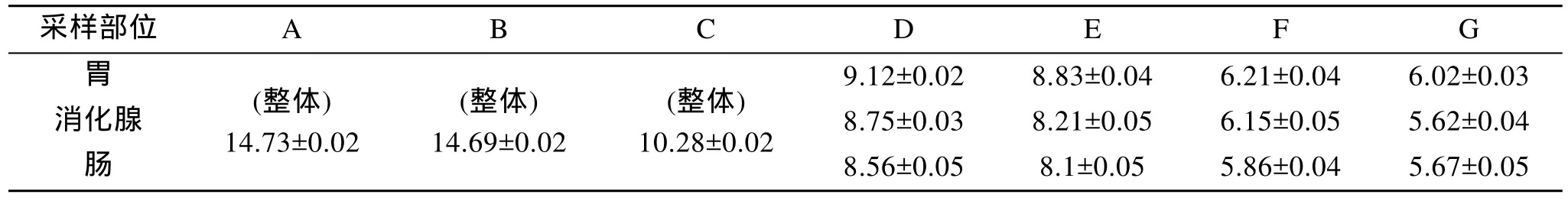
表2 不同体长耳鲍淀粉酶活力(U/mg)Tab. 2 Activity of amylase enzyme of Haliotis asinina
2.2 不同体长耳鲍纤维素酶活力从表 3可知, 纤维素酶活力随着体长的增加而
递增, 胃、消化腺和肠中纤维素酶活力平均值依次为:15.94、11.89、11.72; 不同部位纤维素酶活力依次为:
胃 > 消 化腺 > 肠。同体长组别, 纤维素酶活力在胃与
消化腺、肠间存在显著差异(P<0.05), 在消化腺与肠
间无显著差异(P>0.05)。
2.3 不同体长耳鲍脂肪酶活力
从表4可知, 脂肪酶活力随体长的增加无明显变化,胃、消化腺及肠中脂肪酶活力平均值依次为: 0.40、0.35、0.32。不同部位脂肪酶活力依次为: 胃 > 消 化腺> 肠。
3 讨论
参照黄勃等[23]对杂色鲍与九孔鲍消化酶活力的研究, 对耳鲍与杂色鲍、九孔鲍消化酶活力的比较可以看出, 耳鲍消化酶活力与体长之间的相互变化趋势与前两种鲍相一致, 但在不同生长阶段, 耳鲍身体不同部位的纤维素酶活力都远远大于杂色鲍、九孔鲍(图1~图3); 淀粉酶的活力在多数情况下也是如此(图4~图6), 但在体长达到5 cm以上时, 耳鲍肠、消化腺淀粉酶活力与杂色鲍、九孔鲍相差无几, 而胃淀粉酶的活力要远远低于杂色鲍、九孔鲍。
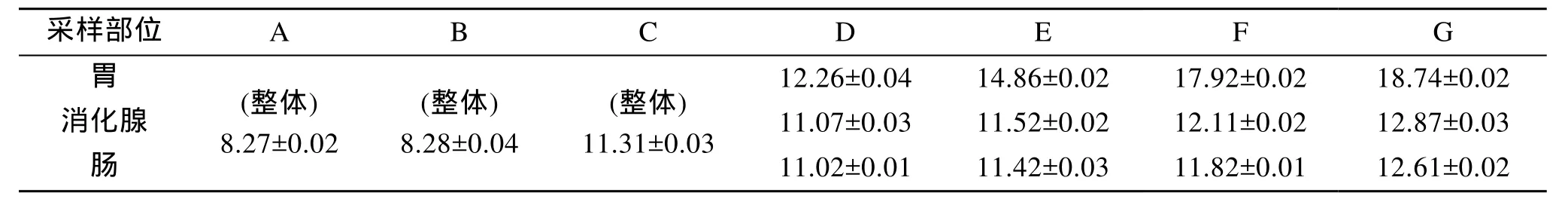
表3 不同体长耳鲍纤维素酶活力(U/mg)Tab. 3 Activity of cellulase enzymes of Haliotis asinine (U/mg)
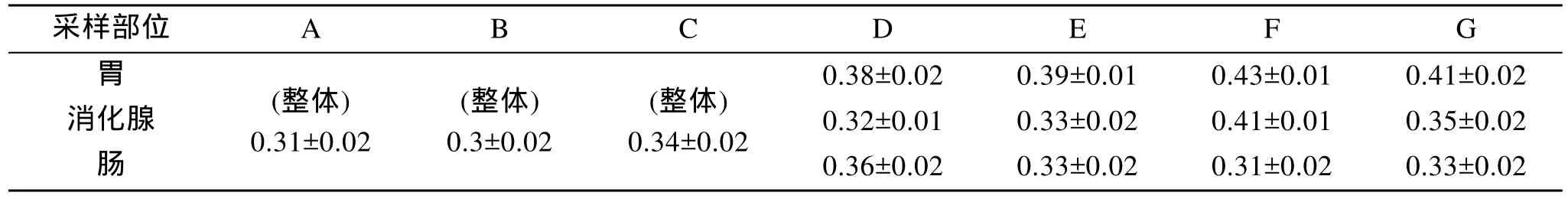
表4 不同体长耳鲍脂肪酶活力(U/mg)Tab. 4 Activity of lipase enzymes of Haliotis asinine (U/mg)
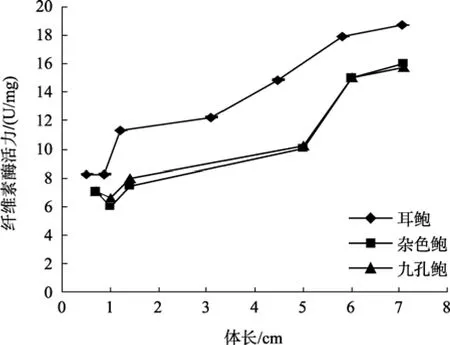
图1 耳鲍与杂色鲍、九孔鲍胃纤维素酶活力比较Fig. 1 Comparison on of cellulase activity in stomach among H.asinina,H.diversicolor diversicolor and H.diversicolor aquatilis
动物体内消化酶活力变化与其个体生长发育的新陈代谢水平有关, 个体的生长发育是伴随摄食量的增多、营养物质消化吸收率增高和营养物质积累的增多而实现的。完成这些复杂的过程需要有一个与之相适应的生理消化功能[26]。因此, 在耳鲍发育过程中, 消化酶变化反映了其个体的食性和营养需求。
从实验结果来看, 耳鲍的淀粉酶随着其体长的增大活性逐渐减小, 其中在两个阶段减少幅度明显加快, 一是从体长0.86 cm的组别到1.20 cm的组别,二是从4.46 cm组别到5.83 cm组别, 第一阶段淀粉酶活力的快速减小, 刚好与耳鲍的食性从小型的底栖硅藻过渡到江蓠相吻合, 第二阶段淀粉酶活力的快速减小, 极有可能是因为耳鲍生长到这一阶段后,生长速度明显加快, 对大型藻类的需求增加, 对淀粉酶活性的要求快速降低的缘故。
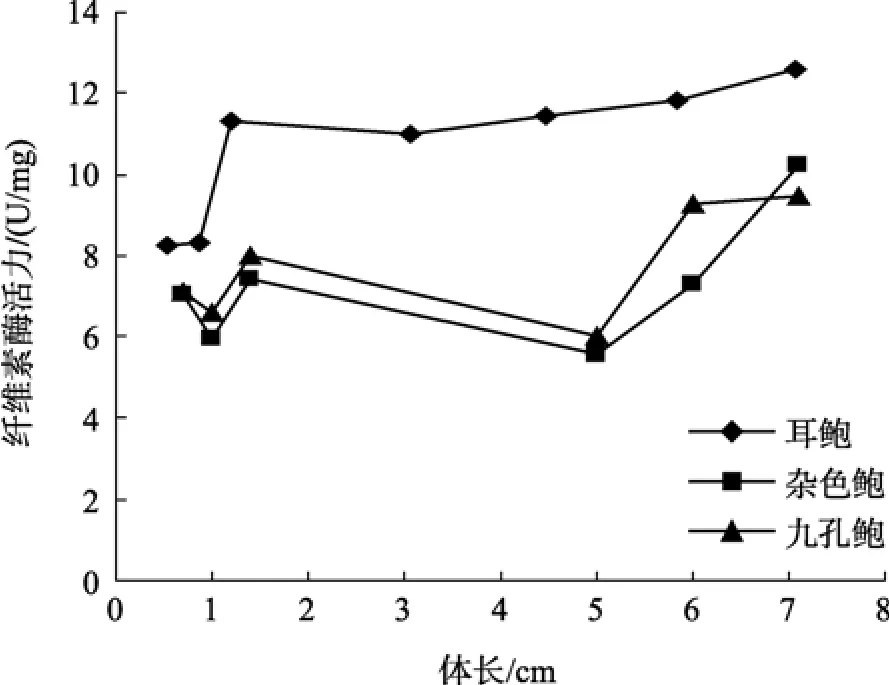
图2 耳鲍与杂色鲍、九孔鲍消化腺纤维素酶活力比较Fig. 2 Comparison of cellulase activity in digestive gland among H.asinina,H.diversicolor diversicolor and H.diversicolor aquatilis
耳鲍纤维素酶随着个体的生长而增大的模式表明, 随着体长的增大, 耳鲍对纤维素的消化能力增大, 从而对含纤维素食物的需求量也增加。同时我们注意到耳鲍纤维素酶活力的增加是与淀粉酶活力的减小相伴进行的, 所以在人工配制系列饵料时, 应注意纤维素的含量一定要随着个体的生长有所增加,淀粉的量则应该相应减小。耳鲍脂肪酶活力在不同生长阶段都很低, 说明耳鲍对动物性的食物没有特定的要求, 这与其日常对食物的要求相一致, 耳鲍以植物食性为主。
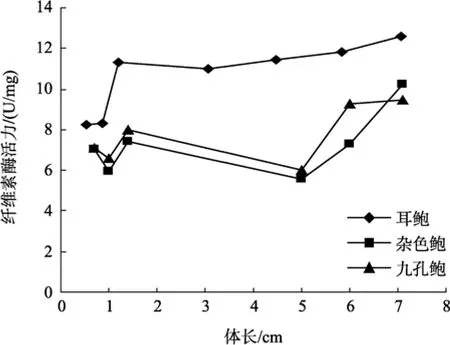
图3 耳鲍与杂色鲍、九孔鲍肠纤维素酶活力比较Fig. 3 Comparison of cellulase activity in intestines among H. asinina, H. diversicolor diversicolor and H. diversicolor aquatilis
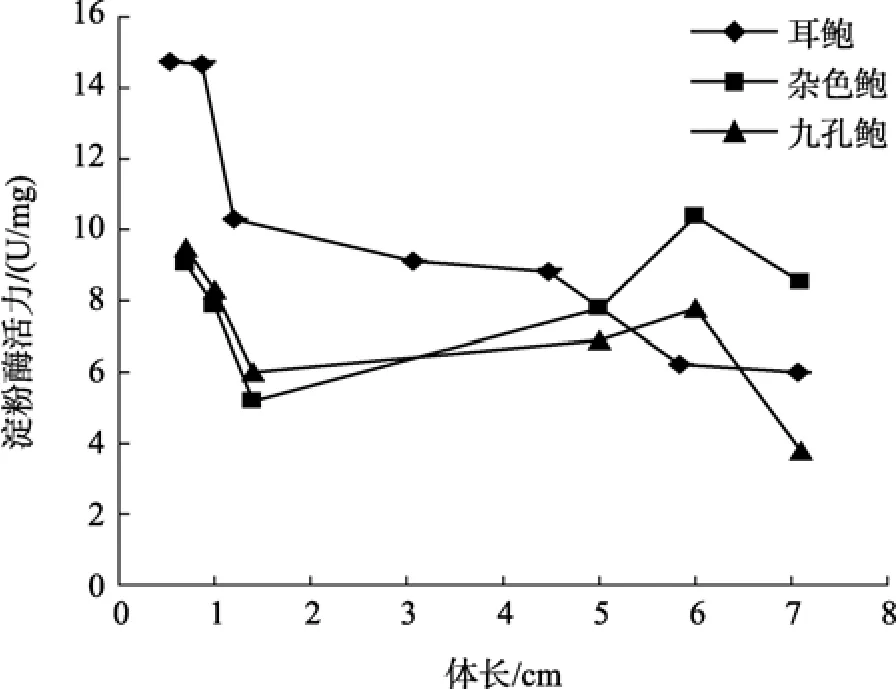
图4 耳鲍与杂色鲍、九孔鲍胃的淀粉酶活力比较Fig. 4 Comparison of amylase activity in stomach among H.asinina, H.diversicolor diversicolor and H. diversicolor aquatilis
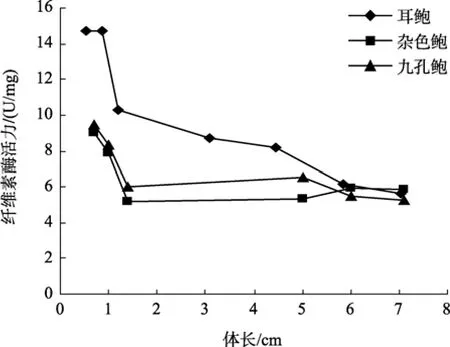
图5 耳鲍与杂色鲍、九孔鲍消化腺淀粉酶活力比较Fig. 5 Comparison of amylase activity in digestive gland among H.asinina, H.diversicolor diversicolor and H.diversicolor aquatilis
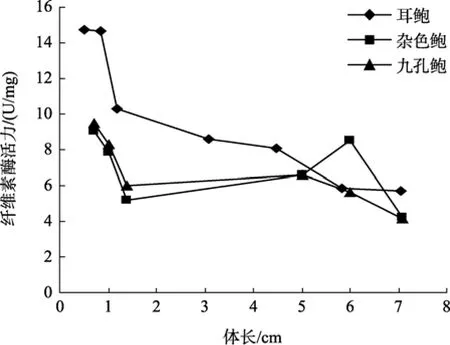
图6 耳鲍与杂色鲍、九孔鲍肠淀粉酶活力比较Fig. 6 Comparison of amylase activity in intestines among H.asinina, H.diversicolor diversicolor and H. diversicolor aquatilis
与杂色鲍、九孔鲍相比, 耳鲍消化酶活力与体长之间的相互变化趋势与前两种鲍相一致, 但在不同生长阶段, 耳鲍身体不同部位的纤维素酶活力都远远大于杂色鲍、九孔鲍; 淀粉酶的活力在多数情况下也是如此, 但在体长达到5 cm以上时, 耳鲍肠、消化腺淀粉酶活力与杂色鲍、九孔鲍相差无几, 而胃淀粉酶的活力要远远低于杂色鲍、九孔鲍, 这说明耳鲍比同是暖水性鲍类的杂色鲍、九孔鲍对纤维素食物有更强的消化能力。此外, 耳鲍的消化酶活力无论在哪个生长阶段, 基本上是 胃 > 消 化腺 > 肠, 而且胃中的消化酶活力与消化腺、肠在多数情况下存在显著性差异(P<0.05), 这说明耳鲍对食物的消化主要在胃中进行。
[1] 黄勃, 王小兵, 刘杰俊. 耳鲍人工养殖的可行性研究[J].海洋科学, 2002, 26(7): 40-41.
[2] 陈锤, 严立新, 颜海波. 鲍类养殖[M]. 广州: 广东科技出版社, 1998: 6-7.
[3] 岑利权, 顾小英, 尤仲杰, 等. 几种食用贝类淀粉酶活性的初步研究[C]//中国科学院海洋研究所. 海洋科学集刊, 1997, 39: 71-80.
[4] Chamilani N, Chulhong O. Mahanama D Z. Characteriza-tion of beta-1,4-endoglucanase as a polysaccharide-degrading digestive enzyme from disk abalone,Haliotis discus discus[J]. Aquacult Int, 2010, 8: 1061-1078.
[5] Nikapitiya C, Oh C, Whang I, et al. Molecular characterization, gene expression analysis and biochemical properties of a-amylase from the disk abalone, Haliotis discus discus.[J]. Comp Biochem Physiol Part B, 2009,152: 271-281.
[6] Tanaka R, Sugimura I, Sawabe T, et al. Gut microflora of abalone Haliotis discus hannai in culture changes coincident with a change in diet[J]. Fish Sci, 2003, 69:951-958.
[7] Suzuki K, Ojima T, Nishita K. Purification and cDNA cloning of a cellulase from abalone Haliotis discus hannai [J]. Biochem, 2003, 270: 771-778.
[8] Chiou T, Lai M, Shiau C. Seasonal variations of chemical constituents in the muscle and viscera of small abalone fed different diets[J]. Fish Sci, 2001, 67,146-156.
[9] Hsieh Meng-shun, Yin Li-jung, Jiang Shann-tzong.Purification and characterization of the amylase from a small abalone Haliotis sieboldii[J]. Fisheries Science,2008, 74: 425-432.
[10] Tsao C Y, Pan Y Z, Jiang ST. Purification and characterization of amylase from small abalone (Sulculus diversicolor aquatilis)[J]. Agric Food Chem, 2003, 51:1064-1070.
[11] Iehata S, Inagaki T, Okunishi S, et al. Colonization and probiotic effects of lactic acid bacteria in the gut of the abalone Haliotis gigantea [J]. Fish Sci, 2009, 75:1285-1293.
[12] Macey B M, Coyne V E. Colonization of the gastrointestinal tract of the farmed South African abalone Haliotis midae by the probionts Vibrio midae SY9,Cryptococcus sp. SS1, and Debaryomyces hansenii AY1[J]. Marine Biotech, 2006, 8: 246-259.
[13] Erasmus J H, Cook P A, Coyne V E . The role of bacteria in the digestion of seaweed by the abalone Haliotis midae[J]. Aquaculture, 1997, 155: 377-386.
[14] Sales J, Britz P J. Evaluation of the reference diet substitutionmethod for determination of apparent nutrient digestibility coefficients of feed ingredients for South African abalone (Haliotis midae L.)[J]. Aquaculture,2001, 207, 113–123.
[15] Britz P J, Hecht T, Knauer J. Gastric evacuation time and digestive enzyme activity in abalone Haliotis midae fed a formulated diet[J]. South African Journal of Marine Science, 1996, 17: 297-303.
[16] Shipton T A, Britz P J. Evaluation of an in vitro digestibility technique for the prediction of protein digestibility in the South African abalone, Haliotis midae L[J]. Aquaculture Nutrition, 2002, 8: 15-21.
[17] Edwards S, Condon C, Digestive protease characterization, localization and adaptation in blacklip abalone(Haliotis rubra Leach)[J]. Aquaculture Research, 2001,32: 95-102.
[18] Harris J O. A preliminary investigation of microbial impact on digestive physiology of the Greenlip abalone,Haliotis laevigata Donovan[D]. Launceston, Tasmania:University of Tasmania, 1994.
[19] Hernandez-Santoyo A, Hernandez-Arana A, Arreguin-Espinosa R, et al. Purification and characterization of several digestive proteases from the blue abalone Haliotis fulgens[J]. Aquaculture, 1998, 159:203-216.
[20] García-Carreño F L, Navarrete del Toro M A,Serviere-Zaragoza E. Digestive enzymes in juvenile green abalone,Haliotis fulgens, fed natural food[J].Comp Biochem Physiol, 2003, 134:143-150.
[21] 李太武, 聂丽萍, 刘金屏. 皱纹盘鲍消化酶研究[J].水产科学, 1995.14(5): 3-6.
[22] Fu Jinghua , Xu wei , Mai Kangsen ,et al. Effects of dietary menadione on the activity of antioxidant enzymes in abalone, Haliotis discus hannai Ino[J]. Chinese Journal of Oceanology and Limnology,2012,30(1):118-123.
[23] 黄勃, 王林桂, 李二超.杂色鲍与九孔鲍消化酶活力的比较[J]. 水产学报, 2003, 27(2): 119-123.
[24] 施特尔马赫.酶的测定方法[M]. 钱嘉渊. 北京: 中国轻工业出版社, 1992: 31-107.
[25] 朱俭, 曹凯鸣, 周润琦. 生物化学实验[M]. 上海: 上海科学技术出版社, 1981: 192-193.
[26] 潘鲁青, 王奎琪.三疣梭子蟹幼体消化酶活力及氨基酸组成的研究[J].水产学报, 1997, 21(3): 246-250.
Studies on digestive enzymes of Haliotis asinina
WANG Lin-gui1, WANG Xiao-bin2, HUANG Bo1
(1. Fishery Department, Hainan University, Haikou 570228, China; 2. College of Material Science and Chemical Engineering, Hainan University, Haikou 570228, China)
Jun.,11,2011
Haliotis asinine; digestive enzyme activity; digestive gland
The digestive enzyme activities of Haliotis asinina at different stage were investigated in this paper.. The results showed that the cellulase activities increased while the amylase activities decreased with the growth of H.asinina. There were no significant changes in lipase activities. The enzymatic activity order for different parts is:stomach>digestive gland> intestine. The ANOVA analysis showed that the amylase activities exhibited significant differences (P<0.05) between the stomach and intestine at the same stage, while no significant differences (P>0.05)between the digestive gland and intestine, the digestive gland and stomach, respectively. The activities of cellulase were significantly different (P<0.05)between the stomach and digestive gland, the stomach and intestine,while not significantly different (P>0.05) between the digestive gland and intestine.
Q556
A
1000-3096(2012)06-0078-06
2011-06-11;
2011-10-12
国家高技术发展计划项目 (2004AA603130); 国家自然科学基金项目(40366001); 海南省外国专家局项目(20031211); 海南大学植物学国家重点学科项目(071001)
王林桂(1978-), 男, 海南琼海市人, 研究方向: 海洋生物学,E-mail: linguiwang@126.com; 黄勃, 通信作者, E-mail: huangbohb1@163.com
(本文编辑:张培新)
