低剂量力达霉素对小鼠P19胚胎癌细胞的生长抑制作用及其机制
2012-10-10谭业辉甄红英
李 映,王 畅,谭业辉,甄红英,姚 程
(1.吉林大学第一医院肿瘤中心,吉林 长春130021;2.北京大学基础医学院细胞生物学系,北京 100191)
恶性肿瘤是严重危害人类健康的疾病之一,现已在我国疾病死亡中跃居首位。肿瘤的显著特征是无节制的生长,其细胞组成呈现异质性。肿瘤干细胞理论认为:原发肿瘤组织中仅有一小部分的未分化细胞移植在裸鼠中能够形成肿瘤,称为肿瘤干细胞,而其他大部分细胞不具备成瘤性[1]。对治疗反应敏感的肿瘤,传统的化疗和放疗虽能杀伤肿瘤中的大部分细胞,但如有极少数肿瘤干细胞残留,就会成为肿瘤复发和转移的根源,直接影响患者的生存率[2]。因此,肿瘤干细胞是肿瘤有效治疗的新靶点[3]。力达霉素(lidamycin,LDM)原名C1027,是从我国湖北省潜江县土壤中分离出的一株链霉菌StreptomycesglobisporusC-1027产生的大分子烯二炔类抗肿瘤抗生素[4]。已经证实力达霉素在体内外均可通过诱导细胞周期停滞和细胞凋亡,抑制大多数肿瘤细胞的生长[5]。但是,力达霉素抑制靶向细胞生长的分子机制仍不是很清楚。Oct4为Pit-Oct-Une(POU) 转录因子家族成员[6],这种DNA结合蛋白,通过结合保守结构域ATGCAAAT,在正常的成人干细胞、一些实体瘤细胞[3]和囊胚内细胞团细胞中高表达[7]。有研究[2]表明:过表达胚胎干细胞样基因Oct4与肿瘤干细胞和肿瘤预后有关。本文作者探讨力达霉素对小鼠胚胎癌P19细胞生长影响及其可能的作用机制,旨在为以肿瘤干细胞为靶点的肿瘤治疗提供依据。
1 材料与方法
1.1 药品及主要试剂力达霉素由中国医学科学院医药生物技术研究所甄永苏院士提供。阿霉素为美国Sigma公司产品。DMEM/高糖培养基为美国Gibco公司产品,胎牛血清为美国Hyclone公司产品,四氮甲唑蓝(MTT)为美国Sigma公司产品。
1.2 细胞培养小鼠胚胎肿瘤P19细胞在含有7.5%胎牛血清的DMEM高糖培养基中,置于5% CO2、 37 ℃培养箱内培养。
1.3 细胞生长分析将细胞以5×103个/孔接种于96孔板,培养24 h后,力达霉素和阿霉素分别在剂量为10-16~10-7mol·L-1及10-16~10-4mol·L-1浓度范围内处理细胞,48 h后MTT法进行检测。每孔加20 μL的MTT溶液(5 g·L-1)。在37℃孵箱中培养4 h后,加100 μL DMSO终止反应。每孔的吸光度(A)值可于酶标仪(BIOTEK,Rockville,Mass.,USA)490 nm处测得。将2~3×103个/孔P19细胞铺于96孔板中,根据剂量曲线选取力达霉素的3个浓度(0.001、 0.01和0.1 nmol·L-1)处理细胞,分别在加药前、给药后24、48、72、96和120 h行MTT法检测,绘制生长曲线。细胞存活率(%)=(处理组平均A值/对照组平均A值)×100%。
1.4 流式细胞术检测细胞凋亡与细胞周期①凋亡分析:将密度为5.0×104的P19细胞接种于60 mm 平皿中,在4、12、24、48和72 h分别给予1×10-11mol·L-1的力达霉素及0.5×10-6mol·L-1的阿霉素进行处理后收集细胞;首先保留培养上清液,用PBS清洗细胞2次,胰酶消化,将细胞收集在离心管中,并进行离心;PBS清洗细胞2次,每管加入AnnexinⅤ-FITC(北京宝赛生物技术有限公司),冰浴15 min,再加入PI后立即行流式细胞仪(BD,USA)检测。②细胞周期检测:2.0×104个P19细胞接种于60 mm皿中。在无血清的DMEM培养液中培养24 h,使其同步化。然后在培养液中加入7.5%血清,分别加入力达霉素和阿霉素继续培养24、48和72 h。收集细胞,PBS清洗细胞2次,然后加500 μL 的70%甲醇4℃放置1 h;PBS清洗细胞,加入含50 mg·L-1RNAase A的PBS重悬细胞,37 ℃孵育30 min后加入2 g·L-1PI,于流式细胞仪检测。
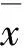
1.6 免疫荧光染色将P19细胞接种于24孔板里,加入非凋亡剂量的力达霉素和阿霉素处理,继续培养48 h;PBS清洗细胞后,4%多聚甲醛固定10 min,PBS清洗细胞后,加含0.2% Triton X-100的PBS打孔15 min,用PBS清洗后,加入适量2%牛血清白蛋白,37℃孵育30 min阻断非特异性反应。加入一抗Oct4 (1∶100) (Santa Cruz)和 SSEA1(1∶100) (Santa Cruz)室温孵育过夜。PBS清洗,加二抗,为抗兔TRITC标记的IgG(1∶100),避光,37℃放置1 h,PBS清洗,DAPI染核,共聚焦显微镜照相。
1.7 免疫印迹法用细胞裂解液(鼎国生物)裂解细胞后,将等量的蛋白于10%SDS-PAGE进行电泳,电转至硝酸纤维素膜(Pierce),5%奶粉/PBST封闭,用含1‰Tween的PBS(PBST)洗3次,加入特异性鼠源性抗体Oct4(1∶500)和Actin (Santa Cruz Biotechnology,CA) (1∶500),4℃过夜,PBST清洗3次后,加二抗羊抗鼠IgG抗体 (IRDye 700;LI-COR) 室温孵育1 h,然后于LI-COR Odyssey成像仪上显像。
2 结 果
2.1 力达霉素对P19细胞生长的抑制作用通过MTT法评价力达霉素对小鼠P19胚胎癌细胞生长的抑制作用,力达霉素对靶细胞生长抑制呈现剂量和时间依赖方式。见表1~3。分别用0.01 nmol·L-1力达霉素和0.5 μmol·L-1的阿霉素处理P19细胞后,流式细胞术检测凋亡时,仅在药物处理细胞的早期(4 h)可以看见凋亡细胞,12~72 h在上清液中均未检测到凋亡细胞(图1);流式细胞术检测细胞周期显示:0.01 nmol·L-1力达霉素处理P19细胞48~72 h可引起G1期阻滞;0.5 μmol·L-1阿霉素处理P19细胞可引起G2/M期阻滞,见表4。各时间点与0点时比较差异均有统计学意义 (P<0.05)。

表1 不同浓度力达霉素作用后P19细胞生长抑制的变化

表2 不同浓度阿霉素作用后P19细胞生长抑制的变化
2.2 低剂量力达霉素抑制胚胎干细胞样基因Oct4表达RT-PCR结果显示:与未加药处理和阿霉素处理过的P19细胞比较,力达霉素处理过的P19细胞中的Oct4基因表达明显下调。免疫印迹实验和免疫荧光染色实验均进一步从蛋白水平证实,与未加药物处理和阿霉素处理过的细胞比较,力达霉素处理过的P19细胞中的Oct4表达下调,差异均有统计学意义 (P<0.05)。见图2和3(插页三)。

表3 不同浓度力达霉素作用不同时间后P19细胞生长抑制的变化

表4 力达霉素和阿霉素作用不同时间后P19细胞周期的变化

图1 低剂量力达霉素作用后P19细胞凋亡及细胞周期的变化
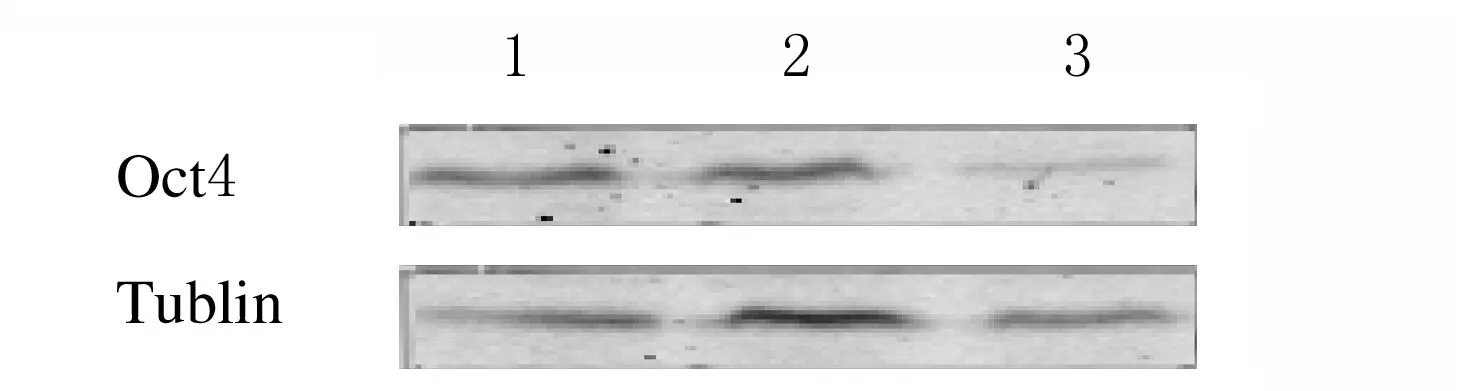
图2 各组P19细胞Oct4的表达水平
3 讨 论
力达霉素是一种由一个酸性蛋白和一个发色团组成的抗肿瘤抗生素,其不稳定发色团可以直接断裂DNA双链[8],酸性蛋白可作为载体靶向肿瘤组织[9]。力达霉素具有极强的杀伤肿瘤细胞的作用,本实验结果证实:力达霉素对靶细胞的生长抑制作用明显强于阿霉素,且较低浓度的力达霉素处理细胞后,仍可有效抑制P19胚胎癌细胞生长。P19胚胎癌细胞是从C3H/He鼠胚胎来源的畸胎瘤中分离得到的,具有与多能性的胚胎干细胞(embryonic stem cell,ES cell)极为相似的生物学特征,高表达囊胚内细胞团的标记物,如转录因子Oct4,是研究肿瘤及细胞分化的理想模型[10]。P19细胞在体外经视黄酸(retinoi acid,RA)或者DMSO诱导,具有向神经元及心肌分化的能力[11]。P19细胞经诱导分化后其胚胎干细胞的标志物Oct4表达降低。Oct4是维持胚胎干细胞自我更新和多能性的一种关键转录因子[12],其在全能性或多能性的干细胞及一些实体瘤细胞中高表达[13],但是在正常体细胞和正常成人干细胞分化的子细胞中不表达。本实验结果显示:应用低剂量的力达霉素处理小鼠P19胚胎癌细胞后,导致细胞生长周期在G0/G1期发生阻滞而不引起凋亡,RT-PCR、免疫印迹实验和免疫荧光染色实验进一步证实,经低剂量力达霉素处理过的小鼠P19胚胎癌细胞Oct4的表达水平下降,而阿霉素无此作用,结果表明低剂量力达霉素对小鼠P19胚胎癌细胞生长的抑制作用与其抑制胚胎干细胞样基因Oct4表达可能有关,这与RA作为一种公认的诱导分化剂下调靶细胞中Oct4表达水平作用相似,故认为低剂量力达霉素具有一定的诱导分化的作用。本研究结果也支持Oct4阳性细胞代表了一些肿瘤干细胞的特征以及以胚胎干细胞样基因Oct4作为肿瘤治疗靶点的观点,为力达霉素作为研究胚胎干细胞增殖和分化方面的有利工具提供可靠依据。目前,力达霉素抑制Oct4表达的机制仍不清楚,需在今后的研究中进一步探讨。
[参考文献]
[1]Vermeulen L,Sprick MR,Kemper K,et al.Cancer stem cells—old concepts,new insights[J].Cell Death Differ,2008,15(6):947-958.
[2]Gao MQ,Choi YP,Kang S,et al.CD24 (+) cells from hierarchically organized ovarian cancer are enriched in cancer stem cells[J].Oncogene,2010,29(18):2672-2680.
[3]Tai MH,Chang CC,Chang CC,et al.Oct4 expression in adult human stem cells: evidence in support of the stem cell theory of carcinogenesis[J].Carcinogenesis,2005,26(2):495-502.
[4]Hu JL,Xue YC,Xie MY,et al.A new macromolecular antitumor,C -1027 : Ⅰ.Dis-covery taxonomy of producing organism,fermentation and biological activity[J].J Antibiot,1988,41(11) :1575-1584.
[5]Zhen YZ,Lin YJ,Shang BY,et al.Enediyne lidamycin induces apoptosis in human multiple myeloma cells through activation of p38 mitogen-activated protein kinase and c-Jun NH2-terminal kinase[J].Int J Hematol,2009,90(1):44-51.
[6]郑鹏生,曹浩哲.Oct4基因的研究进展[J].西安交通大学学报:医学版,2010,31(5):521-526.
[7]Hong Y,Winkler C,Liu T,et al.Activation of the mouse Oct4 promoter in medaka embryonic stem cells and its use for ablation of spontaneous differentiation[J].Mech Dev,2004,121(7-8):933-943.
[8]Xu YJ, Zhen YS,Goldberg IH.C1027 chromophore,a potent new enediyne antitumor antibiotic,induces sequence-specific double-strand DNA cleavage [J].Biochemistry,1994,33(19):5947-5954.
[9]Cai L,Chen H,Miao Q,et al.Binding capability of the enediyne-associated apoprotein to human tumors and constitution of a ligand oligopeptide-integrated protein[J].J Biotechnol,2009,144(2):142-150.
[10]Blelloch RH,Hochedlinger K,Yamada Y,et al.Nuclear cloning of embryonic carcinoma cells[J].Proc Natl Acad Sci USA,2004,101(39):13985-13990.
[11]van der Heyden MA,Defize LH.Twenty one years of P19 cells: what an embryonic carcinoma cell line taught us about cardiomyocyte differentiation[J].Cardiovasc Res,2003,58(2):292-302.
[12]Diehn M,Cho RW,Clarke MF.Therapeutic implications of the cancer stem cell hypothesis[J].Semin Radiat Oncol,2009,19(2):78-86.
[13]Nichols J,Zevnik B,Anastassiadis K,et al.Formation of pluripotent stem cells in the mammalian embryo depends on the POU transcription factor Oct4[J].Cell,1998,95(3):379-391.
