HIV-1P24蛋白的原核表达及单克隆抗体的制备
2012-10-10汪龚泽刘朝奇杨建林覃晓琳吕佰瑞姚佳红
汪龚泽,刘朝奇,杨建林,覃晓琳,吕佰瑞,姚佳红
(三峡大学分子生物学研究所,湖北宜昌443002)
人类免疫缺陷病毒(human immunodeficiency virus,HIV)是艾滋病的病原体,主要通过性接触、血液和母婴传播。近年来,HIV感染呈上升趋势。中国自1985年发现第一例艾滋病患者以来,截至2009年10月底,累计报告艾滋病病毒感染者和患者319 877例,2009年当年新发HIV感染者4.8万人,中国艾滋病疫情形势严峻[1]。而目前检测血清HIV抗体是诊断HIV感染的常规方法,但该检测具有较大的局限性,这是因为:超过70%的HIV感染者在感染6个月后才能检测出抗体,在同性恋群体中,这个数字超过80%,检测抗体方法增加了HIV“窗口期”传播的危险[2];另外,新生儿产生 HIV抗体一般在出生1年后,来自母体的HIV抗体造成新生儿假阳性;由于HIV抗体在疾病过程中持续存在,到艾滋病晚期才消失,它无法作为治疗监测的稳定指标[3]。
P24是HIV病毒颗粒的主要结构蛋白,是结构基因gag的产物,在病毒的包装和成熟过程中发挥重要作用[4]。P24蛋白的氨基酸序列在HIV各毒株之间高度保守,缺失P24的病毒无法正常组装。P24蛋白特异性很强,与多数其他逆转录病毒无交叉反应。HIV感染人体后,感染者血液中首先出现的病毒标志物为病毒P24蛋白。由于从病毒感染到检出抗HIV抗体之间存在较长的窗口期,因此,HIV-1P24抗原检测在HIV感染的早期诊断、预后判断、抗HIV药物筛选及判断母婴传播等方面具有重要意义[5-6]。目前,人们在提高 HIV-1 P24抗原敏感性方面进行了不断的探索,dos Ramos Farías等[7]将婴儿的血清样本离心,可显著增加P24抗原检测的敏感性。瑞士逆转录病毒国家研究中心报道了一种缓冲液,在检测过程中使用该缓冲液可提高P24抗原的检测能力[8]。本课题组克隆表达P24蛋白,获得P24单克隆抗体细胞株,进行临床样本检测,为检测HIV感染提供实验基础。
1 材料与方法
1.1 主要试剂 实验所需限制性内切酶、T4DNA连接酶及TaqDNA聚合酶均购自Fermentas公司。菌株E.coli DH5α、E.coli BL21(DE3)、质粒pET28a(+)和 HIV-1hbx2重组质粒由本研究所保存。鼠抗聚组氨酸(histidine,His)标签抗体、辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗鼠IgG购自北京中杉金桥生物技术有限公司。Balb/c小鼠购自湖北省实验动物中心。聚乙二醇(polyethylene glycol,PEG)(MW1500)购自Fluka公司。小鼠骨髓瘤SP2/0细胞为本研究所保存。
1.2 pET28a(+)-p24基因重组质粒的构建 以 HIV-1hbx2基因为模板,聚合酶链反应(polymerase chain reaction,PCR)方法扩增p24基因。设计引物为:5′-CAG GAT CCC TAT AGT GCA GAA CAT CCA GG-3′;5′-CGA CTC GAG CAA AAC TCT TGC CTT ATG G-3′,其引物中分别引入酶切位点BamHI/XhoI。原核表达载体pET28a(+)用BamHI/XhoI双酶切将其线性化后,与p24目的基因的酶切产物于16℃连接过夜。5μL连接产物转入E.coli DH5α中,接种LB卡那霉素抗性固体培养基,37℃培养过夜,挑取单克隆至1.5mL卡那霉素LB培养基中,37℃培养过夜,次日提取质粒用于酶切和测序鉴定。
1.3 pET28a(+)-p24基因原核表达与鉴定 将构建好的重组质粒pET28a(+)-p24转化到宿主菌BL21(DE3)中,经异丙基-D-硫 代 半 乳 糖 苷 (isopropyl-beta-D-thiogalactopyranoside,IPTG)(终浓度1.0mmol/L)诱导表达,收集的细菌加入等体积2×十二烷基硫酸钠(sodium dodecyl sulfate,SDS)凝胶上样缓冲液,100℃煮沸3min,冰浴4min,室温下离心1min(离心半径8cm,12 000r/min),取20μL进行SDS-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)[9]。考马斯亮蓝染色,通过凝胶成像系统检测表达产量。Western blot检测重组pET28a(+)-P24蛋白,SDS-PAGE后转移硝酸纤维素膜,用5%脱脂奶粉封闭;加抗His标签单克隆抗体(1∶500)室温轻摇作用2h;TBST(Tris-buffered saline with Tween-20)洗涤3次;加入HRP标记的羊抗鼠IgG(1∶2 000)室温反应2h,洗涤同上;增强化学发光法(enhanced chemiluminecence,ECL)显色。
1.4 pET28a(+)-P24蛋白的纯化 质粒 pET28a(+)-P24阳性菌BL21(DE3)经IPTG诱导表达,离心收集菌体,将细菌重悬 于 BufferA(0.5mol/L NaCl,20mmol/L Tris-HCl,pH 8.0)中,4℃超声波破碎细菌,离心洗涤包涵体,8mol/L尿素变性增溶,经Ni-NTA琼脂糖亲和柱分离纯化目的蛋白。纯化蛋白经透析法复性,尿素浓度梯度依次为6.00、4.00、2.00、1.00、0.25、0.10及0.00mol/L,每个浓度透析时间为12h。
1.5 制备P24单克隆抗体 以50μg P24蛋白抗原与弗氏完全佐剂混合制成乳剂,经皮内多点注射进行免疫。1个月后,用相同剂量的抗原加弗氏不完全佐剂经小鼠尾静脉进行加强免疫3次,每次间隔2周。经免疫后小鼠脾细胞与小鼠骨髓瘤SP2/0细胞以50%PEG促融。培养至第10天,采用间接酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)法筛选阳性孔,有限稀释法克隆化3次至克隆生长孔100%阳性,克隆化后的细胞株经传代确定为稳定的细胞株后,液氮保存。每只Balb/c小鼠腹腔注射液体石蜡0.5mL,10d后每只小鼠腹腔注射杂交瘤细胞1×106个,制备腹水模型。取腹水单克隆抗体经饱和硫酸铵分级沉淀,用双蒸水溶解,收集,加等量无菌丙三醇,于-20℃保存。
1.6 P24单克隆抗体的鉴定及抗体效价的检测 Western blot鉴定P24单克隆抗体:取P24蛋白及阴性和阳性对照蛋白进行SDS-PAGE,制备抗原条带。用5%脱脂奶粉封闭,分别以His标签抗体、P24单克隆抗体或正常小鼠血清作为第一抗体(1∶500)室温轻摇作用2h;TBST洗涤3次,每次5min;加入HRP标记的羊抗鼠IgG(1∶2 000)室温反应2h,洗涤同上;ECL显色。ELISA法检测抗体效价:用碳酸盐缓冲液包被P24抗原(浓度为1μg/mL、每孔100μL)4℃包被16h,使用PBST(phosphate buffered solution with Tween-20)洗 涤ELISA板3次,37℃封闭1h。每块ELISA板分别以稀释倍数为1∶100、1∶500、1∶2 500、1∶12 500、1∶62 500、1∶312 500、1∶1 562 500的抗体作为第一抗体加入ELISA板,其中以PBST代替P24单克隆抗体作为阴性对照。37℃孵育1h后,用PBST洗涤ELISA板3次,并在洗涤后加入HRP标记的羊抗鼠IgG(1∶2 000)作为第二抗体,37℃孵育1 h后,洗涤同上,四甲基联苯胺显色,2mol/L H2SO4终止反应,在450nm波长处检测吸光度值。
1.7 血清P24含量的检测 采用竞争抑制ELISA方法,用碳酸盐缓冲液包被P24抗原(浓度为1μg/mL、每孔100μL),37℃封闭1h。每孔加入P24单克隆抗体(1∶200)和不同浓度的P24蛋白于37℃孵育1h,其中阴性对照不加P24单克隆抗体,阳性对照不加P24蛋白。洗涤后加入HRP标记的羊抗鼠IgG(1∶2000),37℃孵育1h,洗涤同上,四甲基联苯胺显色,检测吸光度值,绘制标准曲线。以P24蛋白为抗原包被,包被浓度同上,0.5%Triton X-100处理 HIV-1阳性的血清样本,1∶50稀释后,与1∶200稀释的P24单克隆抗等体积混合,37℃孵育1h,PBST洗涤3次,加入HRP标记的羊抗鼠IgG(1∶2 000),37℃孵育1h,洗涤,四甲基联苯胺显色,检测吸光度值。
2 结 果
2.1 重组质粒pET28a(+)-p24片段的构建 应用PCR方法从HIV-1基因中获得p24基因片段,经内切酶、连接酶将其插入pET28a(+)载体中,获得pET28a(+)-p24重组质粒。构建的重组质粒pET28a(+)-p24经BamHI/XhoI双酶切鉴定,得到693bp的目的条带,1%琼脂糖凝胶电泳结果与预期大小相同,见图1。DNA测序鉴定结果与本课题组设计的HIV-1 p24(hbx2)获取片段的核苷酸序列一致。
2.2 SDS-PAGE和 Western blot分析 将重组pET28a(+)-P24质粒转化至E.coli BL21(DE3)感受态细胞内。1.0mmol/L IPTG 诱导4~6h后,表达蛋白经12%SDSPAGE。诱导后的菌液在相对分子质量约为26 000处出现明显目的条带,未经诱导的菌液无相应条带,见图2左。蛋白凝胶分析图表明pET28a(+)-P24蛋白表达量约占全菌体总蛋白的19%。电泳分离的蛋白转印到硝基纤维膜条。以抗His标签抗体作为第一抗体,HRP标记的羊抗鼠抗体为第二抗体,对表达产物进行Western blot分析,得到的特异性蛋白的相对分子质量约为26 000,见图2右。

图1 重组质粒pET28a(+)-p24的构建
2.3 P24单克隆抗体效价及其特异性 将纯化的P24蛋白包被于ELISA板,纯化后单克隆抗体进行梯度稀释,ELISA检测显示抗体效价最高可达到30万倍,具有较高的效价和良好的量效关系,见图3。阴性对照孔吸光度值为0.136。将IPTG诱导的P24菌、未诱导菌作为阴性对照组,His标签蛋白作为阳性对照的3个样品经SDS-PAGE,转印到硝基纤维膜条上,分别用P24单克隆抗体、His标签抗体及正常血清作为第一抗体,HRP标记的羊抗鼠抗体为第二抗体进行反应,结果显示P24单克隆抗体能够特异性结合P24蛋白,具有很好的特异性,见图4。
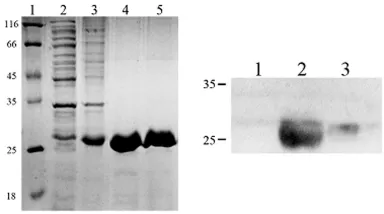
图2 HIV-1P24重组蛋白的鉴定
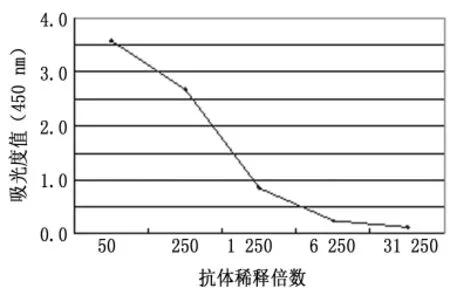
图3 HIV-1P24单克隆抗体的效价(ELISA)
2.4 ELISA法检测艾滋病患者血清的病毒载量 应用P24蛋白和制备的单克隆抗体建立竞争抑制ELISA法,首先建立标准曲线,其结果显示随P24蛋白浓度的增加其吸光值逐渐降低,二者呈高度负相关,r2=0.971 7,见图5。应用建立的ELISA方法检测HIV-1阳性患者血清P24含量,并与逆转录PCR法检测的患者血清病毒载量进行相关性分析,结果表明ELISA的吸光值与病毒载量也呈高度负相关(r2=0.847 7),这些结果提示制备的单克隆抗体能有效识别病毒P24抗原,见图6。
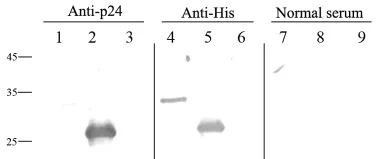
图4 HIV-1P24抗体的特异性(Western blot)

图5 HIV-1P24蛋白竞争抑制ELISA标准曲线

图6 病毒载量与P24吸光值的相关曲线(ELISA)
3 讨 论
目前临床可用于检测HIV感染并监测疾病进展的方法有HIV抗体检测、P24抗原检测、HIV核酸检测以及T淋巴细胞计数。总的来说,ELISA检测抗体和P24抗原的方法经济、省时。美国食品和药物管理局规定自1995年8月起,所有全血、成分血、白细胞和原料血清的献血员,在献血前必须进行HIV-1抗原的筛查。P24抗原更适合作为确定治疗开始时间以及治疗是否有效的标志物。美国艾滋病临床实验组认为,血清P24浓度下降一半表明抗病毒治疗有效,而P24浓度持续升高则表明缺乏有效治疗[10]。
P24蛋白作为结构基因gag的编码产物,其分子结构及其对机体的免疫作用机制已得到阐明,多种检测方法已用于临床,尤其是P24蛋白检测试剂盒已得到广泛应用,但由于其检出的假阳性率高,尚不能作为普查及评价艾滋病治疗效果的检测手段。本实验成功制备了P24抗原蛋白及其单克窿抗体,并对该抗体的效价及特异性进行了检验,结果显示制备的单克隆抗体具有很高的特异性,通过建立的ELISA竞争法检测HIV阳性的患者血清,并与检测的病毒载量进行相关性分析,证实二者具有显著相关性,表明本课题组建立的HIV检测法与PCR检测的效果相当,进一步说明制备的单克隆抗体特异性和敏感性较高,P24蛋白及相应的单克隆抗体可能为ELISA试剂盒检测艾滋病提供实验基础。
[1] 中华人民共和国卫生部.卫生部介绍中国艾滋病疫情现状[EB/OL].(2009-11-30)[2011-02-05].http://www.moh. gov. cn/publicfiles/business/htmlfiles/mohbgt/s3582/200911/44754.htm.
[2] Puchhammer-Stöckl E,Schmied B,Rieger A,et al.Low proportion of recent human immunodeficiency virus(HIV)infections among newly diagnosed cases of HIV infection as shown by the presence of HIV-specific antibodies of low avidity[J].J Clin Microbiol,2005,43(1):497-498.
[3] Ledergerber B,Flepp M,Böni J,et al.Human immunodeficiency virus type 1p24concentration measured by boosted ELISA of heat-denatured plasma correlates with decline in CD4cells,progression to AIDS,and survival:comparison with viral RNA measurement[J].J Infect Dis,2000,181(4):1280-1288.
[4] Reeves JD,Doms RW.Human immunodeficiency virus type 2[J].J Gen Virol,2002,83(Pt 6):1253-1265.
[5] Ondoa P,Dieye TN,Vereecken C,et al.Evaluation of HIV-1p24antigenemia and level of CD8+CD38+T cells as surrogate markers of HIV-1RNA viral load in HIV-1-infected patients in Dakar,Senegal[J].J Acquir Immune Defic Syndr,2006,41(4):416-424.
[6] Schüpbach J,Tomasik Z,Knuchel M,et al.Optimized virus disruption improves detection of HIV-1p24in particles and uncovers a p24reactivity in patients with undetectable HIV-1RNA under long-term HAART[J].J Med Virol,2006,78(8):1003-1010.
[7] dos Ramos Farías MS,Garcia MN,Dilernia D,et al.Centrifugation improves the detection of HIV-1p24antigen in plasma from children born to mothers infected with HIV-1[J].J VirolMethods,2009,158(1/2):6-10.
[8] Schüpbach J,Tomasik Z,Knuchel M,et al.Optimized virus disruption improves detection of HIV-1p24in particles and uncovers a p24reactivity in patients with undetectable HIV-1RNA under long-term HAART[J].J Med Virol,2006,78(8):1003-1010.
[9] 姚登兵,崔学芝.原核表达融合蛋白的亲和层析法纯化[J].交通医学,2001,15(2):149-151.
[10]Schüpbach J.Measurement of HIV-1p24antigen by signal-amplification-boosted ELISA of heat-denatured plasma is a simple and inexpensive alternative to tests for viral RNA[J].AIDS Rev,2002,4(2):83-92.
