硅酸钠分解白钨矿的热力学研究
2012-09-26曹才放赵中伟刘旭恒王小波
曹才放,赵中伟,,刘旭恒,,王小波
(1. 中南大学 冶金科学与工程学院,长沙 410083;2. 中南大学 粉末冶金国家重点实验室,长沙 410083;3. 中南大学 稀有金属冶金与材料制备湖南省重点实验室,长沙 410083)
硅酸钠分解白钨矿的热力学研究
曹才放1,赵中伟1,2,刘旭恒1,3,王小波3
(1. 中南大学 冶金科学与工程学院,长沙 410083;2. 中南大学 粉末冶金国家重点实验室,长沙 410083;3. 中南大学 稀有金属冶金与材料制备湖南省重点实验室,长沙 410083)
针对硅酸钠分解白钨矿的问题,对Ca-Si-W-H2O体系进行了热力学平衡分析,获得了一系列平衡关系图。理论分析表明,白钨矿可被硅酸钠分解,随着pH值升高,分解固相产物依次为CaSiO3和Ca3Si2O7。在低pH值的CaSiO3稳定区,白钨矿被硅酸钠分解,但溶液中钨浓度较低;在高pH值的Ca3Si2O7稳定区,氢氧化钠也参与了分解反应,钨浓度随pH值上升迅速增加。因此,硅酸钠分解白钨矿时可添加适量的氢氧化钠,以提高钨矿分解效果。分解实验验证了理论分析结果,实际分解效果变化的趋势与热力学分析一致。硅酸钠用量是影响浸出总体水平的重要因素,提高试剂浓度或添加氢氧化钠,能进一步提高钨的浸出率。对于WO3质量分数为55.0%白钨矿,在分解温度为180 ℃,分解时间为4 h,体系中硅与钨、氢氧根与钨、水与钨的摩尔比分别为2.0、0.5、35.3的条件下,钨的浸出率为96.9%。
硅酸钠;白钨矿;热力学;分解
氢氧化钠分解法是当前处理钨矿物原料的主流工艺[1]。在碱性体系中,矿物所含的磷、砷、硅、钼、锡等元素因不同程度地被浸出而成为粗钨酸钠溶液的主要杂质。李洪桂等[2]发现氢氧化钠分解钨矿时,原料含钙有利于抑制杂质磷、砷、硅的浸出,并且这些杂质的浸出率随着钙含量的增加而降低。这表明磷、砷、硅的含氧酸根可与钙形成难溶化合物,而且这些沉淀在白钨矿已被分解的条件下仍能稳定存在。正因为如此,在粗钨酸钠溶液净化过程中,加入适量的Ca(OH)2也能将上述3种杂质除去,磷、砷、硅沉淀率分别可达99.04%、96.94%、97.93%[3]。
既然磷、砷、硅的含氧酸根可与钙形成比白钨矿更为稳定难溶化合物,那么从本质上看,它们的含氧酸盐就能用作白钨矿的分解试剂。实际上,磷酸盐早已用于白钨矿的分解:谢牧谦等[4]采用磷酸铵−氨水溶液加压浸出法处理低品位白钨矿;柯家骏等[5]在氢氧化钠溶液中添加磷酸钠或磷酸来分解高钙钨矿中的白钨矿;宋善章[6]采用碱加磷酸钠两段压煮的方法分解白钨精矿。热力学分析及实验证实,在一定碱度下,白钨矿的分解产物为羟基磷灰石Ca5(PO4)3OH,其溶解度较钨酸钙的更小[7−9]。砷与磷属同一主族,其性质与磷相近,能与钙生成诸如Ca5(AsO4)3OH之类的难溶化合物[10]。从这个意义上看,砷也能有效分解白钨矿。但砷的毒性大,不具有工业应用的现实性。硅虽与磷性质差异较大,但其在钨的碱法冶金中的走向与磷的类似,因为它们均能与钙生成稳定的化合物。由此可见,硅酸钠也应具有分解白钨矿的可能性。从价格方面考虑,硅酸钠比磷酸钠、碳酸钠和氢氧化钠廉价。若能将其用于分解白钨矿,将可能开辟一条廉价的白钨矿分解途径。本文作者将通过热力学平衡计算,对白钨矿分解所涉及的Ca-Si-W-H2O体系进行理论分析,并结合实验探究硅酸钠分解白钨矿可能性。
1 热力学平衡图的绘制
钙的硅酸盐种类较多,但多数只有标准生成自由能数据,而没有相应溶度积。对于缺乏溶度积的硅酸盐,本研究由其溶解平衡反应的自由能变化ΔGΘ求得,公式如下:

式中:R为摩尔气体常数,取值为8.3145 J/(mol·K),温度T取298.15 K。计算涉及到的ΔfGΘ数据均列于表1。
利用表1中的数据,通过式(1)可算得各种硅酸钙盐溶解反应的平衡常数。表2所列为Ca-Si-W-H2O体系所涉及的反应及其平衡常数。需指出的是,在本研究中没有考虑低pH值时钨与硅形成杂多酸的反应,因为分解过程主要在碱性条件下进行,而且也缺少有关物质的热力学数据。另外,在缺少有关离子活度系数的情况下,计算均以浓度代替活度。

表1 Ca-Si-W-H2O体系部分物种的热力学数据Table 1 Thermodynamic data of some species in Ca-Si-WH2O system

本研究中关于Ca-Si-W-H2O体系的热力学研究主要考察不同总硅浓度和pH值下硅酸钠溶液溶解白钨矿的能力,这就意味着体系中白钨矿必须过剩,因而在所考察的pH值范围内均存在白钨矿的溶解平衡:

表2 25 ℃时Ca-Si-W-H2O体系的平衡反应及其平衡常数Table 2 Equilibrium reactions and constants for Ca-Si-W- H2O system at 25 ℃

在白钨矿的稳定区,由白钨矿溶解至溶液的钙和钨均没有形成其它沉淀,因此,溶液中总钙与总钨之比应等于白钨矿中钙与钨的化学计量比:

在酸性条件下,钨和硅可分别形成钨酸和硅酸沉淀。在强碱性条件下,钙以氢氧化钙的形态存在。由反应(2)~(4)可知,这些沉淀存在时,相关离子需满足相应的溶解平衡:


由先前的研究可知[9,16],随着pH值增加,碳酸盐分解白钨矿的固相稳定区依次为H2WO4、CaWO4、CaCO3、Ca(OH)2;而磷酸盐分解白钨矿的固相稳定区依次为H2WO4、CaWO4、Ca5(PO4)3OH、Ca(OH)2。因此,可初步推测硅酸钙的稳定区在CaWO4和Ca(OH)2之间。由于硅酸钙盐种类繁多,计算时采用逐步试算的方式。先选定CaSiO3为可能存在物,经过初步平衡计算发现:在CaSiO3与Ca(OH)2两稳定区的边界处,Ca3Si2O7可生成,这说明CaSiO3与Ca(OH)2稳定区之间至少存在Ca3Si2O7的稳定区;另外,当溶液总硅浓度设定为1.0 mol/L时,pH值小于12.0,体系中将有硅酸沉淀生成。在H4SiO4的稳定区,溶液总硅浓度取决于硅酸的沉淀溶解平衡,而不能达到1.0 mol/L的初始设定。因此,考虑Ca3Si2O7和H4SiO4稳定区的情况,在本文考察的总硅浓度范围内,通过数次的平衡计算,确定了6个固相稳定区,即随着pH值升高,它们依次为H2WO4+H4SiO4、CaWO4+H4SiO4、CaSiO3+ H4SiO4、CaSiO3、Ca3Si2O7、Ca(OH)2。这说明,硅酸钠分解白钨矿可能的固相产物为CaSiO3和Ca3Si2O7。参考反应(8)和(11),相关离子应满足方程:

在无硅酸存在的高碱度条件下,溶液中总硅浓度可在一定程度上变换。本研究计算了总硅为1.0 mol/L时Ca-Si-W-H2O体系的溶解平衡。当pH≥12.0时,溶液总硅满足方程式:

而当体系处于不同稳定区时,各溶解组分的浓度分别由不同方程组计算得到。在H2WO4+H4SiO4稳定区满足方程(2)~(9)、(11)和(12);在CaWO4+H4SiO4稳定区满足方程(2)~(9)、(10)和(12);在CaSiO3+H4SiO4稳定区满足方程(2)~(9)、(12)和(14);在CaSiO3稳定区满足方程(2)~(9)、(14)和(16);在Ca3Si2O7稳定区满足方程(2)~(9)、(15)和(16);在Ca(OH)2稳定区满足方程(2)~(9)、(13)和(16)。按以上平衡关系计算,可获得Ca-Si-W-H2O体系的各溶解组分的lgc—pH图(pH≥12.0,c(Si)=1.0 mol/L),如图1所示。并按此方法对总硅浓度分别为0.1、2.0、3.0、4.0、5.0 mol/L溶液的平衡进行了计算。图2和3所示分别为不同总硅条件下,溶液中总钨和的lgc(W)—pH图和溶液中总钨的c(W)—pH图。

图1 Ca-Si-W-H2O体系溶解组分的lgc—pH图Fig. 1 lgc—pH diagram for Ca-Si-W-H2O system (pH≥12.0,c(Si)=1.0 mol/L)

图2 不同总硅浓度时总钨与的lgc(W)—pH图Fig. 2 lgc(W)—pH diagram for total tungsten concentration andat different total silicon concentrations
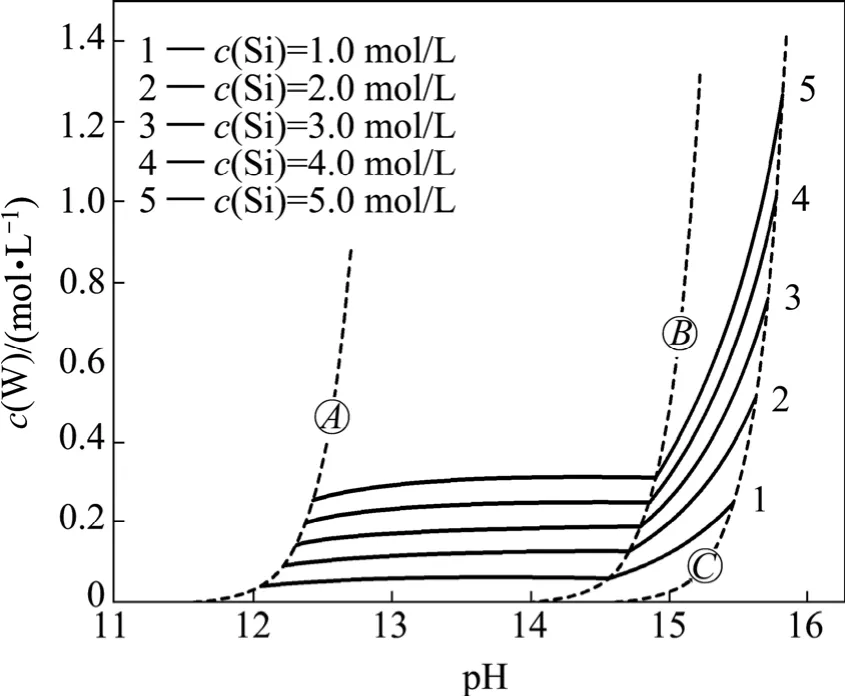
图3 不同总硅浓度时总钨的c(W)—pH图Fig. 3c(W)—pH diagram for total tungsten concentration at different total silicon concentrations
2 Ca-Si-W-H2O体系的热力学分析
图1所示为Ca-Si-W-H2O体系溶解组分的lgc−pH图。图1中线③为体系生成H4SiO4的临界线。线③以右的区域,溶液总硅浓度固定为1.0 mol/L;线③以左的区域,硅酸可稳定存在,此时溶液中总硅含量取决于硅酸的沉淀溶解平衡,而不能达到1.0 mol/L的预期浓度。线①、线③、线④和线⑤分别为生成H2WO4、CaSiO3、Ca3Si2O7和Ca(OH)2的临界线。线①以左为钨酸的稳定区,可被看作白钨矿的酸分解过程;线①与线②之间为白钨矿的稳定区,仅有微量钙和钨被溶解;线②与线④之间为CaSiO3的稳定区,白钨矿可被硅酸钠分解,线③以左,溶液中钨浓度随着pH值升高而增加,线③以右,由于的浓度变化趋于水平,溶液中钨含量也随之趋于水平;线④和线⑤之间为Ca3Si2O7的稳定区,由于OH−也参与了生成Ca3Si2O7的反应,因而溶液中钨的浓度随着碱度增加而增加。线(5)以右实际为碱分解过程,这时硅酸钙盐不能稳定存在,白钨矿的分解产物为Ca(OH)2。
为了更清楚地表示总硅浓度和pH值对白钨矿分解的作用规律,绘制了如图3所示的c(W)—pH图。线为硅酸生成的临界线,线表示CaSiO3转变为Ca3Si2O7的临界线,线为氢氧化钙生成的临界线。线以左由于硅酸的形成,溶液中钨浓度随pH值降低而迅速下降;线与线之间,白钨矿单纯由硅酸钠分解,但由于CaSiO3的溶解度较大,总钨浓度仍然偏低;线与线之间,白钨矿被硅酸钠和氢氧化钠联合分解,钨浓度随pH增加而迅速上升,并在线处达到最高值。对比不同总硅浓度在线处所能达到的总钨浓度可看出,溶液总硅浓度对与之平衡的钨浓度有着显著的影响。因此,硅酸钠若要有效分解白钨矿,一方面,需要添加氢氧化钠使反应在Ca3Si2O7稳定区内进行,另一方面,还要保证反应后溶液中仍然具有较高的浸出剂浓度。
3 硅酸钠分解白钨矿的试验
为了验证硅酸钠分解白钨矿的可能性,本研究采用WO3质量分数为55.0%的白钨矿为原料,在密闭反应器内进行分解试验。每次试验称取白钨矿100 g,并添加一定量的九水偏硅酸钠(Na2SiO3·9H2O)、氢氧化钠和蒸馏水。由此计算出反应体系中硅与钨的摩尔比n(Si)/n(W)、氢氧根与钨的摩尔比n(OH−)/n(W)、水与钨摩尔比n(H2O)/n(W),其中体系总水量包括了九水偏硅酸钠中的结晶水。分解温度控制为180 ℃,分解时间为4 h。试验条件及结果如表3所列。

表3 不同条件下白钨矿浸出的试验结果Table 3 Leaching results of scheelite under different conditions
由试验结果可见,白钨矿确实能被硅酸钠分解,并且在本试验的条件下钨的浸出率最高达到了96.9%。随着分解条件的不同,浸出效果有所差异。对比试验E-1和E-2可知,其它条件相同时,钨的浸出率随硅酸钠浓度增加而增加;对比试验E-2和E-3可知,加入一定量的氢氧化钠能提高钨的浸出率。由此可见,试验结果与前文热力学分析结果在趋势上是一致的。从试验E-1、E-2和E-3的浸出效果看,当n(Si)/n(W)为1.2时,白钨矿的浸出率最高为55.7%。而当增加硅酸钠用量,将n(Si)/n(W)提高至2.0,如试验E-4,在不加碱的情况下浸出率达到了88.2%,这说明硅酸钠用量是影响浸出总体水平的重要因素。试验E-5则添加一定量碱并降低了配水量,获得了96.9%的浸出率。
4 结论
1) 利用现有热力学数据,计算了各种硅酸钙盐溶解反应的平衡常数,并对Ca-Si-W-H2O体系进行热力学平衡计算,绘制了该体系各溶解组分的lgc−pH图、不同总硅浓度下总钨与的lgc−pH图以及总钨的c−pH图。
2) 热力学分析表明,白钨矿可被硅酸钠分解。随着pH值升高,分解固相产物依次为CaSiO3和Ca3Si2O7。在低pH值的CaSiO3稳定区,溶液中钨浓度较低;而在高pH值的Ca3Si2O7稳定区,氢氧化钠也参与了分解反应,钨浓度随pH值上升迅速增加。因此,硅酸钠分解白钨矿时应添加适量的氢氧化钠。
3) 实验验证了硅酸钠分解白钨矿的可能性。结果表明,硅酸钠用量是影响浸出总体水平的重要因素。提高试剂浓度以及添加一定量的氢氧化钠,能进一步提高浸出率。在分解温度180 ℃、分解时间4 h、n(Si)/n(W)=2.0、n(OH−)/n(W)=0.5、n(H2O)/n(W)=35.3的条件下,钨的浸出率为96.9%。
REFERENCES
[1]LI Hong-gui. Production of high purity APT from scheelite and complex tungsten raw material with high Mo content [J]. Transactions of Nonferrous Metals Society of China, 2004, 14(2): 366–369.
[2]李洪桂, 羊建高, 李 昆. 钨冶金学[M]. 长沙: 中南大学出版社, 2010: 62−66. LI Hong-gui, YANG Jian-gao, LI Kun. Metallurgy of tungsten [M]. Changsha: Central South University Press, 2010: 62−66.
[3]孙培梅, 李洪桂, 刘茂盛. 碱法热球磨分解白钨细泥的研究[J]. 稀有金属与硬质合金,1989, 27(2): 85−88. SUN Pei-mei, LI Hong-gui, LIU Mao-sheng. Study on mechanically activated leaching of scheelite slime with caustic soda [J]. Rare Metals and Cemented Carbides, 1989, 27(2): 85−88.
[4]赖高惠. 低品位钨精矿的处理方法[J]. 稀有金属, 1983, 7(5): 58−59. LAI Gao-hui. Processing of low-grade tungstenic ore [J]. Chinese Journal of Rare Metals, 1983, 7(5): 58−59.
[5]柯家骏, 蒙星辉, 龚建平. 含钙的钨矿物料的处理方法: 中国, 86100031[P]. 1986−09−10. KE Jia-jun, MENG Xing-hui, GONG Jian-ping. Processing of calcium-containing tungstenic ore: China, 86100031 [P]. 1986−09−10.
[6]宋善章. 一种分解白钨矿的方法: 中国, 03118385.9[P]. 2003−11−05. SONG Shan-zhang. Scheelite decomposing process: China, 03118385.9 [P]. 2003−11−05.
[7]吴建国, 柯家骏. 白钨矿添加磷酸盐苛性碱浸取的热力学分析[J]. 化工冶金, 1987, 8(3):1−6. WU Jian-guo, KE Jia-jun. Thermodynamical analysis of leaching of scheelite with caustic solutions containing phosphates [J]. Engineering Chemistry and Metallurgy, 1987, 8(3): 1−6.
[8]陈家镛. 湿法冶金的研究与发展[M]. 北京: 冶金工业出版社, 1998: 181−187. CHEN Jia-yong. Research and development of hydrometallurgy [M]. Beijing: Metallurgical Industry Press, 1998: 181−187.
[9]王识博, 赵中伟, 李洪桂. 磷酸盐浸出白钨矿的热力学分析[J]. 稀有金属与硬质合金, 2005, 33(1): 1−4. WANG Shi-bo, ZHAO Zhong-wei, LI Hong-gui. Thermodynamic analysis on phosphate decomposition of scheelite [J]. Rare Metals and Cemented Carbides, 2005, 33(1): 1−4.
[10]朱义年, 张 华, 梁延鹏, 刘辉利, 张学洪. 砷酸钙化合物的溶解度及其稳定性随pH值的变化[J]. 环境科学学报, 2005, 25(12): 1652−1660. ZHU Yi-nian, ZHANG Hua, LIANG Yan-peng, LIU Hui-li, ZHANG Xue-hong. Dependence of solubility and stability of calcium arsenates on pH value [J]. Acta Scientiae Circumstantiae, 2005, 25(12): 1652−1660.
[11]伊赫桑·巴伦. 纯物质热化学手册[M]. 程乃良, 牛四通, 徐桂英, 译. 北京: 科学出版社, 2003: 461−469, 759. BARIN I. Thermochemical data of pure substances [M]. CHENG Nai-liang, NIU Si-tong, XU Gui-ying, transl. Beijing: Science Press, 2003: 461−469, 759.
[12]DEAN J A. Lange’s handbook of chemistry [M]. New York: McGraw-Hill Press, 1999.
[13]林传仙, 白正华, 张哲儒. 矿物及有关化合物热力学数据手册[M]. 北京: 科学出版社, 1985: 36. LIN Chuan-xian, BAI Zheng-hua, ZHANG Zhe-ru. The handbook of mineral and the related compounds thermodynamic data [M]. Beijing: Science Press, 1985: 36.
[14]OSSEO-ASARE K. Solution chemistry of tungsten leaching systems [J]. Metallurgical Transaction B, 1982, 13(4): 555−564.
[15]VEREECKE G, LEMAITRE J. Calculation of the solubility diagrams in the system Ca(OH)2-H3PO4-KOH-HNO3-CO2-H2O [J]. Journal of Crystal Growth, 1990, 104(4): 820.
[16]赵中伟, 曹才放, 李洪桂. 碳酸钠分解白钨矿的热力学分析[J]. 中国有色金属学报, 2008, 18(2): 356−360. ZHAO Zhong-wei, CAO Cai-fang, LI Hong-gui. Thermodynamics on soda decomposition of scheelite [J]. The Chinese Journal of Nonferrous Metals, 2008, 18(2): 356−360.
(编辑 何学锋)
Thermodynamic study on decomposition of scheelite with sodium silicate
CAO Cai-fang1, ZHAO Zhong-wei1,2, LIU Xu-heng1,3, WANG Xiao-bo3
(1. School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China; 2. State Key Laboratory of Powder Metallurgy, Central South University, Changsha 410083, China; 3. Key laboratory of Hunan Province for Metallurgy and Material Processing of Rare Metals, Central South University, Changsha 410083, China)
In order to evaluate the feasibility of decomposing scheelite with sodium silicate, thermodynamics of Ca-Si-W-H2O system was studied and a series of equilibrium diagrams were obtained. Theoretical analysis shows that scheelite can be decomposed by sodium silicate under certain conditions and the solid reaction products are CaSiO3and Ca3Si2O7. At lower pH values, scheelite is decomposed to CaSiO3by sodium silicate, but W concentration in solution is lower. At higher pH values, it is jointly decomposed to Ca3Si2O7by sodium silicate and sodium hydroxide, thus the W concentration increases greatly with increasing the pH value. Therefore, it is beneficial to add sufficient sodium hydroxide to the system. Besides, several tests are performed to verify the feasibility of such decomposition, and the experimental results are consistent in trend with the thermodynamic analysis. The dosage of sodium silicate has a remarkable effect on the reaction. Increasing reagent concentration and adding sodium hydroxide can improve the decomposition efficiency. When the WO3mass fraction in scheelite is 55.0% and the molar ratios of Si to W, OH−to W and H2O to W in the system are 2.0, 0.5 and 35.3, respectively, the W leaching rate reaches 96.9% at 180 ℃ for 4 h.
sodium silicate; scheelite; thermodynamics; decomposition
TF111.31
A
国家重点基础研究发展计划资助项目(2007CB613603)
2011-09-06;
2012-12-18
赵中伟,教授,博士;电话:0731-88830476;E-mail: zhaozw@csu.edu.cn
1004-0609(2012)09-2636-06
