放射性碘-131标记酪氨酸*
2012-09-25李泽军褚泰伟
李泽军 褚泰伟
(北京大学化学与分子工程学院 北京 100871)
目前, 放射性标记技术已经被广泛应用于化学、生物学和医学等领域,例如化学反应机理的研究、放射性免疫分析以及疾病的早期诊断和治疗等。因此,在本科生综合化学实验中开展与放射化学相关的实验,让学生掌握该学科的基本知识和操作常识,是有意义的。
放射性碘-131具有半衰期短(8.02天),价格便宜,易于购买等优点。放射性碘标记化合物在生物学和医学中应用很广泛,是常用的示踪手段之一。常用的标记方法为利用氧化剂,如氯氨-T(Chloramine-T)、Iodogen、溴代琥珀酰亚胺(NBS)等将放射性碘负离子氧化为具有亲电活性的放射性碘,这些放射性碘进而和化合物中的苯环发生亲电取代反应以完成标记[1-5]。酪氨酸分子中有被羟基取代的苯环,易于发生亲电取代反应,易于被碘标记。如欲对蛋白质或其他化合物进行碘标记,需先将酪氨酸及其衍生物与蛋白质或其他化合物偶联,然后再完成放射性碘的标记[6]。本实验利用氯氨-T、Iodogen为氧化剂,氧化碘-131负离子(131I-)标记酪氨酸分子。研究了不同的标记条件,如:溶液pH、底物浓度、氧化剂用量、载体加入量对标记率的影响,从而寻找最佳标记条件。通过该实验,学生可以初步掌握放射性碘标记化合物的常用方法,同时训练放射化学操作的基本技能。
1 实验目的
(1) 了解放射性碘标记化合物的原理;
(2) 了解放射性碘标记化合物的两种常用实验技术与方法;
(3) 了解不同标记条件对标记率的影响。
2 实验原理
氯氨-T和Iodogen是碘标记化合物常用的氧化剂,其分子结构如图1所示。氯氨-T是水溶性的,在水溶液中生成HOCl,将放射性I-氧化为放射性的I2,放射性的I2进而和化合物的苯环发生亲电取代反应,制得碘标记化合物[3]。Iodogen标记化合物的原理和氯氨-T一致,但Iodogen不溶于水,标记化合物时可以减少与水溶性有机分子的接触从而减少其氧化损伤,所以氧化条件较为温和[7-8]。氯氨-T氧化标记法和Iodogen氧化标记法是碘标记化合物常用的两种方法。
酪氨酸由于分子内部有被羟基活化了的苯环,碘的亲电取代反应很容易在羟基的邻位发生。因此,很容易被碘标记成功。其反应式如图2所示。
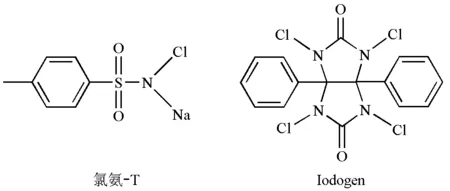
图1 两种常用氧化剂的分子结构

图2 放射性碘-131标记酪氨酸分子
本实验采取纸上色谱法来确定标记率。由于碘标记的酪氨酸分子和未被标记上的131I-性质不同,它们在固定相和流动相(展开剂)之间的分配比不同。因此,在流动相展开过程中,被标记的酪氨酸分子和未被标记上的131I-随溶剂的移动速度不同而被分离开,放射性被分布于纸带的不同区域。标记率即为标记化合物区域的放射性活度占整条纸带的放射性活度的百分比。
3 实验试剂和仪器
无载体Na131I溶液(原子高科股份有限公司),酪氨酸(上海康捷生物科技发展有限公司),氯氨-T(ACROS ORGANICS),Iodogen(Sigma),甲醇(分析纯),正丁醇(分析纯),冰醋酸(分析纯),Na2S2O5(分析纯),去离子水,85%磷酸(分析纯),KOH(分析纯),氯仿(分析纯),色谱用滤纸(宽1.5cm,长25.0cm),玻璃展开缸,FT-603井型γ闪烁探头和FH463A-自动定标器(中核(北京)核仪器厂)。
4 实验步骤
4.1 溶液配制和原料准备
(1) 0.1mol/L KOH水溶液用85%的磷酸溶液调pH=3、5、7、9、11。
(2) 将酪氨酸分别溶于pH 3~11的KOH-H3PO4溶液中,质量浓度为0.2mg/mL。
(3) 将酪氨酸溶于pH 7的KOH-H3PO4溶液中,质量浓度分别为0.05、0.1、0.15、0.2、0.3mg/mL。
(4) 配制氯氨-T水溶液,质量浓度分别为0、1、2、3、4mg/mL。
(5) 配制Iodogen的氯仿溶液,质量浓度分别为0、0.02、0.04、0.06、0.08mg/mL。分别取0.5mL上述溶液于离心管中,在通风橱中挥发干氯仿,Iodogen被涂于离心管内壁,制得不同Iodogen含量的离心管若干。
(6) 配制Na2S2O5水溶液,质量浓度为30mg/mL。
(7) 在距离滤纸条一端2cm处标记好点样位置,每隔1cm画一个标记,共画10cm。
(8) 配制85%甲醇展开体系,取适量展开剂于玻璃展开缸中。
4.2 色谱展开条件的选择
4.3 溶液pH对标记率的影响
以氯氨-T为氧化剂:分别取pH 3~11的酪氨酸溶液(0.2mg/mL)0.5mL于离心管中,加入10 μL氯氨-T溶液(2mg/mL),1.85MBq Na131I溶液,反应10分钟后加入50μL Na2S2O5溶液(30mg/mL)终止反应。
以Iodogen为氧化剂:取0.04 mg/mL Iodogen的氯仿溶液挥干溶剂后的离心管5支,分别加入pH 3~11的酪氨酸溶液(0.2mg/mL)0.5mL,加入1.85MBq Na131I溶液,反应10分钟后加入50μL Na2S2O5溶液(30mg/mL)终止反应。
用做好标记的滤纸条,对以上反应液点样分析。在正丁醇-冰醋酸-水的展开体系中展开10cm,记下溶剂前沿。风干后剪成1cm宽的纸片装入一次性塑料试管中,用FT-603井型γ闪烁探头测量其放射性,计算标记率。
4.4 底物质量浓度对标记率的影响
分别以氯氨-T和Iodogen为氧化剂,取质量浓度为0.05、0.1、0.15、0.2、0.3mg/mL的酪氨酸溶液0.5mL(pH 7),其他标记条件同4.3节,反应结束后分析产物,方法同4.3节。
4.5 氧化剂用量对标记率的影响
以氯氨-T为氧化剂:取酪氨酸溶液(0.2mg/mL,pH 7)0.5mL,分别加入10μL 0、1、2、3、4mg/mL的氯氨-T溶液,1.85MBq Na131I溶液,反应10分钟后加入50 μL Na2S2O5溶液(30mg/mL)终止反应。
以Iodogen为氧化剂:取酪氨酸溶液(0.2mg/mL,pH 7)0.5mL,分别加入由0.5mL 0、0.02、0.04、0.06、0.08mg/mL Iodogen的氯仿溶液挥干溶剂后的离心管,加入1.85MBq Na131I溶液,反应10分钟后加入50μL Na2S2O5(30 mg/mL)溶液终止反应。反应结束后分析产物,方法同4.3节。
4.6 载体加入量对标记率的影响
分别以氯氨-T和Iodogen为氧化剂,将0、50、100、500、1000μg载体KI与1.85MBq Na131I溶液混合后加入酪氨酸溶液(0.2mg/mL,pH 7),其他标记条件同4.3节。反应结束后分析产物,方法同4.3节。
5 结果与讨论
5.1 溶液pH对标记率的影响
研究了不同溶液pH对标记率的影响,结果如表1所示。分别以氯氨-T和Iodogen为氧化剂时,最大标记率均在pH 7(氯氨-T:80%,Iodogen:83%)。表明中性溶液为最佳的标记条件,酸性溶液和碱性溶液对碘标记不利。这可能是由于酪氨酸分子中的酚羟基和氨基结构随溶液pH变化影响碘标记所致。

表1 不同pH条件下的标记率
5.2 底物质量浓度对标记率的影响
研究了不同底物质量浓度对标记率的影响,结果表明分别以氯氨-T和Iodogen为氧化剂时,不同的底物质量浓度(0.05~0.3mg/mL)均可达到80%的标记率,这表明在0.05~0.3mg/mL范围内,底物质量浓度对标记率影响不大。
5.3 氧化剂用量对标记率的影响
研究了不同氧化剂用量对标记率的影响,结果表明分别以氯氨-T和Iodogen为氧化剂时(图3),用量为0.02mg即可达到最大标记率(氯氨-T:80%,Iodogen:83%);进一步增加氧化剂用量对标记率影响不大。因此,在标记化合物时,可将氧化剂用量控制在最低,这样有利于保护被标记的分子。
5.4 载体加入量对标记率的影响
研究了不同载体加入量对标记率的影响,结果表明分别以氯氨-T和Iodogen为氧化剂时,加入50μg载体KI即可使标记率明显下降(氯氨-T:50%,Iodogen:35%);载体加入量超过100μg,标记率降低至15%以下(图4)。这可能是由于载体I-与131I-之间的竞争所致。

图3 氧化剂用量对标记率的影响

图4 KI加入量对标记率的影响
6 结论
本实验探索了放射性碘-131标记酪氨酸分子不同的标记条件,结果表明:中性溶液有利于碘标记;增加氧化剂用量可以提高标记率,但应尽量将氧化剂用量控制在最低;少量的载体加入量即明显降低标记率。因此,溶液pH、氧化剂用量和载体加入量对标记率影响最大。
7 实验注意事项
因本实验涉及放射性实验操作,应注意以下事项:(1) 所有放射性操作应该戴乳胶手套进行,禁止戴手套触摸实验药品、公用仪器、门窗把手等。(2) 所有放射性操作应该在铺有吸水纸的搪瓷盘中进行,以防止污染。一旦发现污染应立即向老师汇报。(3)穿实验室统一配备的实验服,禁止将实验服带出实验室。(4) 实验废物和废液要统一回收处理,禁止乱扔乱倒。(5) 学生离开实验室前要洗手,并检测手和衣物是否被污染,确定无污染方可离开实验室。
本实验可作为大三或大四本科生的综合化学实验。如学时安排有限,可省略某些步骤。如:色谱展开条件的选择和底物浓度对标记率的影响;或者改为只利用一种氧化剂在不同标记条件下进行标记。学生通过本实验能初步掌握放射性的基本操作,增强对放射性及辐射防护基本知识的了解,这样有利于学生克服对放射性的恐惧心理,激发他们对放射化学的兴趣。
[1] Hunter W M,Greenwood F C.Nature,1962,194(4827):495
[2] Greenwood F C,Hunter W M,Glover J S.BiochemJ,1963,89(1):114
[3] Seevers R H,Counsell R E.ChemRev,1982,82(6):575
[4] Bakir M A,Eccles S A,Babich J W,etal.JNuclMed,1992,33(12):2154
[5] Li Z J,Chu T W,Liu X Q,etal.NuclMedBiol,2005,32(3):225
[6] Farah K,Farouk N.JLabelCompdRadiopharm,1998,41(4):255
[7] Petzold G,Coenen H H.JLabelCompdRadiopharm,1981,18(9):1319
[8] Salisburry J G,Graham J M.BiochemJ,1981,194(1):351
