圆形微通道反应器内2-乙基四氢蒽氢醌氧化反应
2012-09-11苏宏久YvesGonthier罗灵爱王树东
张 统,苏宏久,曹 彬,Yves Gonthier,罗灵爱,王树东
(1.中国科学院,大连化学物理研究所洁净能源国家实验室,大连 116023;2.法国萨瓦大学尚贝里工程师学院LOCIE实验室,Le Bourget-du-Lac Cedex, France 73376;3.中国科学院研究生院,北京 100049)
圆形微通道反应器内2-乙基四氢蒽氢醌氧化反应
张 统1,2,3,苏宏久1,曹 彬1,Yves Gonthier2,罗灵爱2,王树东1
(1.中国科学院,大连化学物理研究所洁净能源国家实验室,大连 116023;2.法国萨瓦大学尚贝里工程师学院LOCIE实验室,Le Bourget-du-Lac Cedex, France 73376;3.中国科学院研究生院,北京 100049)
以管径为900 µm的圆形微通道反应器内2-乙基四氢蒽氢醌(THEAQH2)的氧化反应为研究对象,研究了反应过程中气液两相的流动形态,考察了反应温度、反应压力、液体流速ULS、气液比rAS等因素对THEAQH2氧化反应的影响。研究表明,圆形微通道反应器内进行THEAQH2的氧化反应时可得到较高的气液两相接触比表面积;氧化反应随温度升高、压力增大和液体流速 ULS的增加而显著加快;THEAQH2的氧化反应在圆形微通道反应器内进行可得到较高的过氧化氢时空收率YSTY(Space-Time Yield),在温度50℃、压力0.29 MPa、液体流速0.052 m/s时,YSTY可达1 790 kg/(m3·h),高出常规反应器1~2个数量级。
微通道反应器 气液比表面积 气液流动 氧化反应
高效、环保、安全已经成为世界化化学工业发展的趋势[1],对新型化工技术的应用以及对化工工艺的革新探索,已经成为当前化学工业发展的主要方向。随着微加工技术的快速发展,以及对并行分布式生产理念认识的深入,作为一种化工领域革新型技术的微化工技术兴起已有二十余年,以其高效、灵活、安全等优点受到广泛关注,并逐步在化学工业的一些领域中得到应用,如制氢、有机合成、精细化工等[2]。
过氧化氢作为一种理想的、绿色的氧化剂,被广泛地应用于化学合成、医疗卫生、电子材料、污染物处理等行业。蒽醌法是目前生产过氧化氢的主要方法,主要由氢化、氧化和萃取三个步骤组成。蒽醌加氢后的氧化过程是蒽醌法制取过氧化氢工艺中不可或缺的重要步骤,影响着整个生产过程的效率。而现如今工业过氧化氢生产工艺中的氧化步骤普遍存在着效率低下的特点,尤其是在国内,此步骤多采用大型逆流式氧化反应鼓泡塔,生产效率低下、耗能高,技术改进的意义重大[3]。而微化工技术的高效、强化传热传质过程等优点,为其在过氧化氢生产过程氧化步骤中的应用提供契机。
本研究对圆形微通道反应器内2-乙基四氢蒽氢醌氧化反应进行了探索和研究,着重考察了反应温度、反应压力、液体流速、气液比等因素对反应的影响。
1 实验部分
1.1 实验装置及流程
实验所用的单通道微反应器是一根具有圆形截面的直石英玻璃管,内径为0.90mm,外径为6.92mm,长为30 cm,是由法国里昂的Verre et Séparation Technologies S. A.公司采用精确热拉伸法制得,经显微镜下观测可知,其内表面非常光滑,直径误差在2%以内。T型接头是不锈钢材质,其内径均为0.90mm,由大连南中精密模具加工有限公司用电火花加工制得。
为更接近工业条件,实验所用的工作液采自中国石化巴陵分公司双氧水生产车间的循环液,其中含有2-乙基蒽醌(EAQ)33.1 g/L和2-乙基四氢蒽醌(THEAQ)91.5 g/L[4]。在EAQ和THEAQ同时存在的情况下,在催化反应过程中加氢的是THEAQ,生成2-乙基四氢蒽氢醌(THEAQH2)[5],因此参与氧化反应的是THEAQH2,氢化反应和氧化反应表示为[6]:

实验装置如图1所示,实验过程中氧化气体氧气和氢化工作液经T型接头接触后进入微通道反应器进行氧化反应,气体流量由质量流量计(七星华创:D07-11C,0~500mL/min;D07-7A,0~100mL/min;D07-7A,0~30mL/min;D07-7B,0~2 L/min)精确控制,而参与氧化反应的氢化工作液流量则由精密柱塞泵(日本岛津公司,LC-15C,精度为0.001~10mL/min)控制,泵后安装两个缓冲罐,以消除柱塞泵脉冲,保证液体流速平稳。反应过程中用水浴精确控制工作液和微通道反应器的温度。实验过程中,用数码相机(Canon 5D Mark II,快门速度8 000-1s)拍摄反应过程中的气液两相流型照片。微通道反应器的两端连接一个压差传感器(麦克,MDM490, 0~70 kPa),以测量反应过程中压降。反应系统的整体压力则由分离罐后的压力传感器(麦克,MPM489, 0~1 MPa)和一个背压阀配合控制。工作液在氧化反应前用高纯氮气密封,防止与空气中的氧气接触反应;工作液离开反应器进入气液分离罐即用大量高纯氮气吹扫保护,防止进一步氧化,以保证分析结果即为微通道反应器内反应结果。
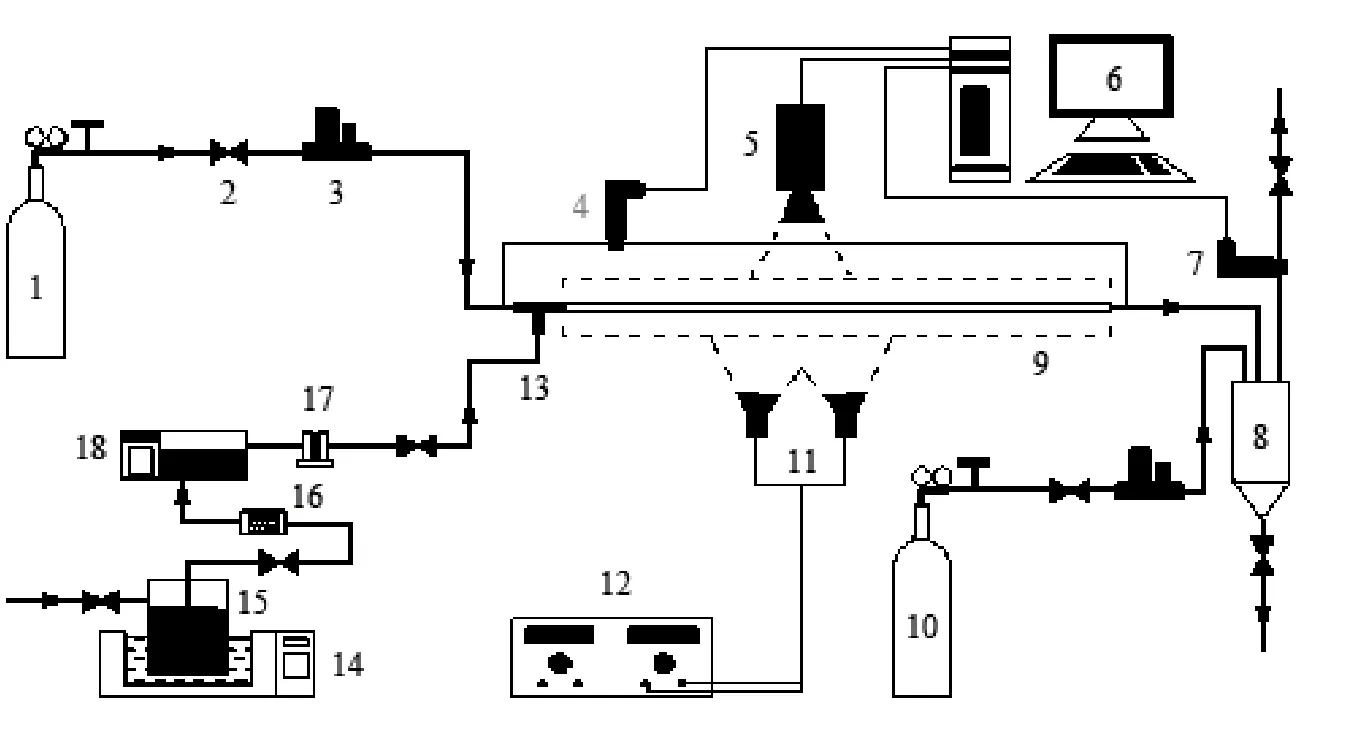
图1 实验装置Fig.1 Schematic diagram of experimental setup
1.2 分 析
氧化过程中所用工作液是经催化加氢反应过程所得到的蒽醌工作液,氢化的总氢化效率C0(进行完全氧化后所能得到工作液中过氧化氢的浓度),是氧化反应工作液的初始浓度。氧化反应后的工作液保存和分析过程中用高纯氮气进行严格保护以防止其离开反应器后的进一步氧化。取氧化反应后工作液5mL进行萃取,并用高锰酸钾溶液进行滴定分析测量,以确定氧化反应的量Coxy(氧化反应后所得工作液中过氧化氢的浓度),氧化反应的转化率可用η=Coxy/C0表示。滴定测量过氧化氢的质量浓度按下式计算:

2 结果与讨论
2.1 气液两相流型
氢化工作液中THEAQH2的氧化反应是一个典型的气液两相反应,而微通道反应器内的气液两相反应呈现出其独有的特征,尤为明显的一点是微通道内特有的气液两相流型,如泡状流、Taylor流、搅拌流、环流等[7],气液流型是影响气液两相压降、传质、反应的重要因素。在本实验中,由于气液比例、气液流速相对适中,微通道反应器内的气液两相流型呈现Taylor流,又称弹状流(Slug Flow),如图2所示。Taylor流中流动比较规则,气弹、液柱间隔有序,有环状薄液膜连接液柱,并隔开气弹跟微通道壁,气液反应过程中,气体通过气弹与液体的接触面,向液柱和液膜进行传质。

图2 氧化反应过程中微通道反应器内的气液两相流型Fig.2 Two-phase flow patterns in micro-channel reactor during experiments
由于所考察的微通道反应器截面为圆形,观察到的微通道内图像在径向,由于石英玻璃对光线的折射作用已被放大,图片中不失真的尺寸为轴向的长度和微通道的外径de。因此其径向尺寸无法直接由图像测得,而需根据轴向和外径的尺寸求得。又因为Taylor流比较规则,则可据图像可以求出微通道中气液两相接触面积。根据图3中所示,气弹的直径db可由下式计算

式中dc为微通道内径,m;Tf为Taylor流中环气弹液膜厚度,m。Tf由Aussillous and Quere[8]提出的公式求得

图3 Taylor流中的气泡模型Fig.3 Gas bubbles in Taylor flow

其中毛细管数(capillary number)Ca

式中σ为表面张力,N/m;µL为液体粘度,Pa·s;Ub是气弹实际速度,m/s。Ub可据Baten等[9]提出的公式求出

式中UGS为气体表观流速,m/s;εG为气含率,%。εG可由下式求得

式中Vb为气弹的体积,m3。由图3可知,气弹可近似看成一个圆柱体跟一个半球体的组合,其表面积SB可由下式表示

根据以上假设得到的气弹表面积与本实验中气弹的实际表面积的误差在10%以下。根据一个气弹的表面积可由下式求得反应器的比表面积

以上公式中,dc、de已知,LB可根据图2测得,UGS可根据气体流量求得,因此可求出图2中a、b、c、d四种情况下αi分别为4 560,4 840 ,4 960和5 040 m2/m3。如今工业过氧化氢生产过程中氧化反应器一般为鼓泡塔,其气液接触面积不超过200 m2/m3[10]。有较大的比表面积使微通道反应器在气液两相反应过程中有其独特的优势,也正是本实验能取得良好效果的重要原因之一。
2.2 温度对氧化反应的影响
图4显示的是温度对氢化工作液中THEAQH2氧化反应的影响。η为THEAQH2氧化反应转化率,rAS为气液标况体积比。由图4可知随着温度的上升η显著增加,即在同样的液体流速 ULS下,Coxy随温度的上升而提高。当 T为12℃、rAS为4.4、ULS为0.013 m/s时,η仅为13.2%,Coxy只有0.79 g/L。而当反应温度上升到70℃时,η上升到72.8%,Coxy增加到4.37 g/L。分析其原因主要有两方面,第一,氢化工作液中 THEAQH2的氧化反应被认为是一个中速自氧化气液两相反应,反应过程由反应动力学和气液传质两个步骤控制[6]。而反应速率会随温度的升高而显著加快。第二,就气液两相传质而言,首先,温度升高有利于气体的扩散,当反应温度升高时,气体在液相中的扩散系数随之增大,而液相传质系数(实验中氧化气体为纯氧,因此气相传质系数可忽略)与气体扩散系数的平方根成正比[11];温度的升高还会降低工作液的粘度,而粘度的降低加剧液相主体内的扰动并加快气液界面的表面更新速度,增大液相传质系数,因此液相传质系数随温度的升高而增大。其次,温度升高使反应速率加快,而液相反应速率加快会使气液两相间的传质加强。第三,工作液是以70%的重芳烃(分子量大于二甲苯的混合芳烃)和30%磷酸三辛酯混合液为溶剂,而氧气在一些带苯环的有机溶剂中的溶解度是随温度的升高而增大的[12],本实验中温度的升高可能会提高工作液中氧的平衡浓度,增大气液传质推动力,有利于传质过程的进行。虽然温度的升高会使气体体积变大而减小微通道反应内工作液的实际停留时间,但影响相对较小。总体而言,随温度的升高,氢化工作液中THEAQH2的氧化反应速度加快。

图4 反应温度对THEAQH2氧化反应的影响Fig.4 Effects of temperature on the oxidation
2.3 压力对氧化反应的影响
一般而言,反应压力是影响气液两相反应极其重要的因素。图5显示的是反应压力对氢化工作液中THEAQH2氧化反应的影响。由图可知反应压力对此反应的影响非常明显,η在0.49 MPa的反应压力(文中压力指表压)下比0.10 MPa时增大了接近两倍。前面提到氢化工作液中 THEAQH2氧化反应被认为是由反应动力学和液相传质两个步骤共同控制的,反应压力的增加提高了氧气的传质推动力,有利于氧气的传质。氢化工作液中THEAQH2氧化反应又是一个二级反应,跟工作液中THEAQH2浓度和氧气的浓度成正比[6],而反应压力的升高会增大氧气传质的推动力,加速氧气向液相的传质,同时压力的升高会提高液相中氧气的溶解平衡浓度,从而提高THEAQH2氧化反应速率,加快THEAQH2氧化反应。综上所述,升高反应压力会使氧气向液相的传质速度加快并能提高 THEAQH2氧化反应速率,因此能使氧化反应加快,得到较高的η。

图5 反应压力对THEAQH2氧化反应的影响Fig.5 Effects of pressure on the oxidation

图6 液体流速对THEAQH2氧化反应的影响Fig.6 Effects of liquid velocity on the oxidation

图7 液体流速对过氧化氢时空收率的影响Fig.7 Effects of ULSon the space-time yield of hydrogen peroxide
2.4 液体流速对氧化反应的影响
图6显示了其他反应条件不变的情况下,η随ULS的变化规律,表明了η随ULS的增加而降低。ULS增加,rAS不变,则气液两相在反应器内的停留反应时间减少了,C0也不变,这必然导致η的降低。然而,ULS的增加,增大了反应器单位时间内的处理量,微通道反应器内氢化工作液中的 THEAQH2进行氧化反应所得H2O2的时空收率YSTY随ULS的变化规律展示在图7中。由图可知,YSTY随ULS的增加有显著提高,究其原因,有以下两条:首先,ULS的增加会增大氧气的液相传质系数,加快氧气的传质速度,从而加快氧化反应;其次,较高的 ULS下,η保持在较低水平,则整个反应过程中 THEAQH2的平均浓度较高,THEAQH2的氧化反应速率较快,因此可得到较高的YSTY。
能得到较高的YSTY正是在THEAQH2氧化反应过程中应用微通道反应器的优势所在。在此反应过程中应用微通道反应器旨在强化过程以提高反应器的利用效率,减小能耗。如今工业过氧化氢生产过程的氧化步骤中,氧化反应器的H2O2时空收率低下,一般在15~36 kg/(m3·h)[13]。即使Kemira公司发明的较先进的管式反应器[14],采用氧气为氧化气,反应器的 H2O2时空收率也只能达到 254 kg/(m3·h),并且没有得到推广,没能使整个过氧化氢工业生产中氧化步骤的效率低下问题得到明显改善。而从图7中可得知,ULS在0.052 m/s时,微通道反应器的YSTY已达到1 790 kg/(m3·h),较传统的塔式氧化反应器和专利中的管式反应器都有显著提高,对过氧化氢工业生产中氧化步骤的技术改进有着重大的借鉴意义。
3 结 论
a) 在微通道反应器内进行THEAQH2的氧化反应可得到较大的气液比表面积,在本实验条件下可超过5 000 m2/m3,远高于常规的氧化反应器。
b) 实验表明,反应温度的升高、反应压力的增加都会使微通道反应器内THEAQH2的氧化反应速度显著加快。
c) 随着液体流速的增加,微通道反应器内THEAQH2的氧化反应转化率会有所降低,而H2O2的时空收率却有显著提高,说明随着液体流速的增加,氧化反应速度加快;在本实验条件下,微通道反应器内进行THEAQH2的氧化反应能得到的H2O2时空收率比常规氧化反应器高1~2个数量级,具有明显的优势,有良好应用前景。
[1] Charpentier J C. The triplet "molecular processes-product-process" engineering: the future of chemical engineering? [J]. Chemical Engineering Science, 2002, 57(22-23):4667-4690.
[2] Dietrich T. Microchemical engineering in practice [M]. Hoboken, New Jersey: John Wiley and Sons, 2009:129.
[3] 陈迪航, 李绵庆. 过氧化氢的应用领域与主要生产方法 [J]. 化工技术与开发, 2011, 40(3):32-35.Chen Dihang, Li Mianqing. Application and production technology of hydrogen peroxide [J]. Technology and Development of Chemical Industry, 2011, 40(3):32-35.
[4] 张建国. 蒽醌法制备过氧化氢加氢催化剂制备及其性能研究 [D]. 大连: 中国科学院大连化学物理研究所, 2008.
[5] Berglin T, Schoon N. Selectivity aspects of the hydrogenation stage of the anthraquinone process for hydrogen-peroxide production [J].Industrial and Engineering Chemistry Process Design and Development, 1983, 22(1):150-153.
[6] Santacesaria E, Ferro R, Ricci S et al. Kinetic aspects in the oxidation of hydrogenated 2-ethyltetrahydroanthraquinone [J]. Industrial and Engineering Chemistry Research, 1987, 26(1):155-159.
[7] Zhang T, Cao B, Fan Y L, et al. Gas-liquid flow in circular microchannel part I: influence of liquid physical properties and channel diameter on flow patterns [J]. Chemical Engineering Science, 2011, 66(23):5791-5803.
[8] Aussillous P, Quere D. Quick deposition of a fluid on the wall of a tube [J]. Physics of Fluids, 2000, 12(10):2367-2371.
[9] van Baten J M, Krishna R. CFD simulations of mass transfer from Taylor bubbles rising in circular capillaries [J]. Chemical Engineering Science, 2004, 59(12):2535-2545.
[10] Ehrfeld W, Hessel V, Löwe H. Microreactors: new technology for modern chemistry [M]. Weinheim, Germany: Wiley-VCH Verlag GmbH and Co KgaA, 2004:1-13.
[11] Lamont J C, Scott D S. An eddy cell model of mass transfer into the surface of a turbulent liquid [J]. American Institute of Chemical Engineers,1970, 16(4):513-519.
[12] 黄建彬. 工业气体手册 [M]. 北京: 化学工业出版社, 2002:48-59.
[13] 胡长诚. 蒽醌法制过氧化氢及产品浓缩、净化、安定化研发新进展 [J]. 化学推进剂与高分子材料, 2008, 6(3):1-9.Hu Changcheng. New progress of research and development of anthraquinone process for preparation of hydrogen peroxide and itsconcentration, purification and stabilization [J]. Chemical Propellants and Polymeric Materials, 2008, 6(3):1-9.
[14] 胡长诚. 国外过氧化氢生产装置和生产工艺现状 [J]. 化学推进剂与高分子材料, 2004, 2(3):1-4.Hu Changcheng. Current situation of foreign H2O2production plants and production technology [J]. Chemical Propellants and Polymeric Materials, 2004, 2(3):1-4.
Oxidation of Hydrogenated 2-Ethyltetrahydroanthraquinone in a Horizontal Circular Micro-Channel Reactor
Zhang Tong1,2,3,Su Hongjiu1,Cao Bin1,Yves Gonthier2,Luo Lingai2,Wang Shudong1
(1.Dalian National Laboratory for Clean Energy, Dalian Institute of Chemical Physics, Chinese Academy of Sciences,Dalian 116023, China; 2.Laboratoire Optimisation de la Conception et Ingénierie de l’Environnement (LOCIE),CNRS-UMR5271, Université de Savoie, Campus Scientifique, Savoie Technolac, 73376 Le Bourget-du-Lac Cedex, France;3.Graduate School of Chinese Academy of Sciences, Beijing 100039, China)
An experimental investigation on oxidation of hydrogenated 2-ethyltetrahydroanthraquinone(THEAQH2) is presented in a horizontal circular micro-channel reactor with inner diameter of 900 µm. The gas-liquid two-phase flow patterns in the reactor were visualized and recorded by a fast camera, and the gas-liquid contacting specific surface (αi) was calculated with the image of flow patterns. Moreover, the influence of temperature, pressure, liquid superficial velocity (ULS) and gas-liquid ratio (rAS) on the THEAQH2oxidation reaction were also investigated. The results show that αiin the micro-channel could be much higher than that in traditional reactors and the rate of THEAQH2oxidation reaction speeds up obviously with the temperature and pressure increase. Although the conversion (η) decreases with increasing of ULS, the space-time yield of hydrogen peroxide (YSTY) would increase. In addition, YSTYin the micro-channel reactor could reach 1 790 kg/(m3·h) under the conditions of temperature 50℃, pressure 0.29 MPa and liquid superficial velocity 0.052 m/s, much higher than that in traditional oxidation reactors.
circular micro-channel; hydrogen peroxide; gas-liquid flow; oxidation
TQ031.7
A
1001—7631 ( 2012) 03—0193—07
2012-04-23;
2012-05-23。
张 统(1983-),男,博士研究生;王树东(1965-),男,研究员,通讯联系人。E-mail:wangsd@dicp.ac.cn。
国家自然科学基金(20776138)。
