饲料铅污染对蛋鸡生产性能、蛋品质以及抗氧化性能的影响
2012-09-04张爱婷顾林英朱巧明邹晓庭
朱 莎 张爱婷 代 腊 顾林英 朱巧明 邹晓庭*
(1.浙江大学饲料科学研究所,动物分子营养学教育部重点实验室,杭州 310058;2.浙江欣欣饲料股份有限公司,嘉兴 314005)
铅是一种常见的灰黑色重金属元素,铅及其化合物侵入机体的主要途径是消化道和呼吸道,其毒性可损害神经系统[1]、生殖系统[2]以及肝脏、肾脏[3]等器官,且铅易在动物体内富集,最终可能通过食物链进入人体,威胁人类健康。国际癌症研究署(IARC)将铅及其化合物划分为2B族致癌物,其毒性已引起人们的普遍重视。有研究者提出,体内不存在任何铅的安全阈值[4]。国内外已有多起铅中毒的报道,儿童因铅中毒导致的智力下降也成为社会广泛关注的问题之一。近几十年来科研工作者在职业性铅暴露人群和鼠类等动物模型上对铅中毒进行了大量的研究,目前认为铅诱导自由基的过量产生而导致氧化应激是铅毒性作用的主要机制之一[5-8]。在畜禽生产中,铅污染还未受到重视,然而未引起中毒症状剂量的铅可能会降低畜禽的生产性能、免疫能力以及肉蛋品质等,而且也最终会通过食物链进入人体,对人体产生不良影响。
常见的矿物质添加剂硫酸锰和硫酸亚铁等是饲料中铅的主要来源,还有一部分来自含铅量高的饲料原料或牧草。我国饲料卫生标准(GB 13078—91)规定猪、鸡等配合饲料中铅的含量不得超过5 mg/kg,但由于原料购入把关不严以及检测手段跟不上,采用铅含量较高的饲料原料或预混料配制全价饲料,全价饲料中的铅含量就会大大高于国家标准。为此,本试验以蛋鸡为研究对象,通过模拟实际生产中可能存在于饲料中的铅的含量,人为地在饲粮中添加15、30和60 mg/kg铅,研究慢性铅暴露对产蛋高峰期蛋鸡生产性能、蛋品质以及与抗氧化相关指标的影响,并初步探讨其作用机制,以进一步认识铅污染的饲粮对蛋鸡的毒害作用,为研究铅致毒机理以及后期防治蛋鸡铅中毒提供理论依据。
1 材料与方法
1.1 试剂
试验用硝酸铅[Pb(NO3)2]购自上海吉沪化工有限公司,分析纯,硝酸铅含量大于99%。
1.2 试验动物与饲粮
试验选用40周龄生产性能相近的海兰褐蛋鸡576羽,采用单因子试验设计,将试验鸡随机分为4组:对照组、试验1组(T1组)、试验2组(T2组)、试验3组(T3组),每组4个重复,每个重复36羽。预试期1周,正试期8周。对照组饲喂基础饲粮,基础饲粮中铅的含量为3.57 mg/kg,T1、T2、T3组分别饲喂在基础饲粮中添加 15、30、60 mg/kg铅的试验饲粮。
基础饲粮参照NRC(1994)蛋鸡营养需要量配制,基础饲粮组成及营养水平见表1。
1.3 饲养管理
饲养试验在浙江省嘉兴市桐乡龙翔蛋鸡养殖场进行。3层全阶梯笼养(每个笼内3只鸡),采用人工光照与自然光照相结合的方法,每天光照16 h,采用机械通风与自然通风相结合,从而保证鸡舍内空气流通良好。蛋鸡自由饮水、采食,按常规免疫程序对其进行接种,定期对鸡舍消毒。
1.4 指标测定与方法
1.4.1 生产性能测定
试验期间,每天以重复为单位记录产蛋数和总蛋重,每周以重复为单位统计总采食量,计算产蛋率、平均蛋重、平均日采食量及料蛋比。
1.4.2 蛋品质测定
在试验中期(第4周末)和试验结束(第8周末)时,每组采集鸡蛋16枚(各重复4枚),用于测定蛋白高度、哈夫单位、蛋黄颜色、蛋壳厚度和蛋壳强度,以上指标均采用日本产DET6000蛋品质仪测定。
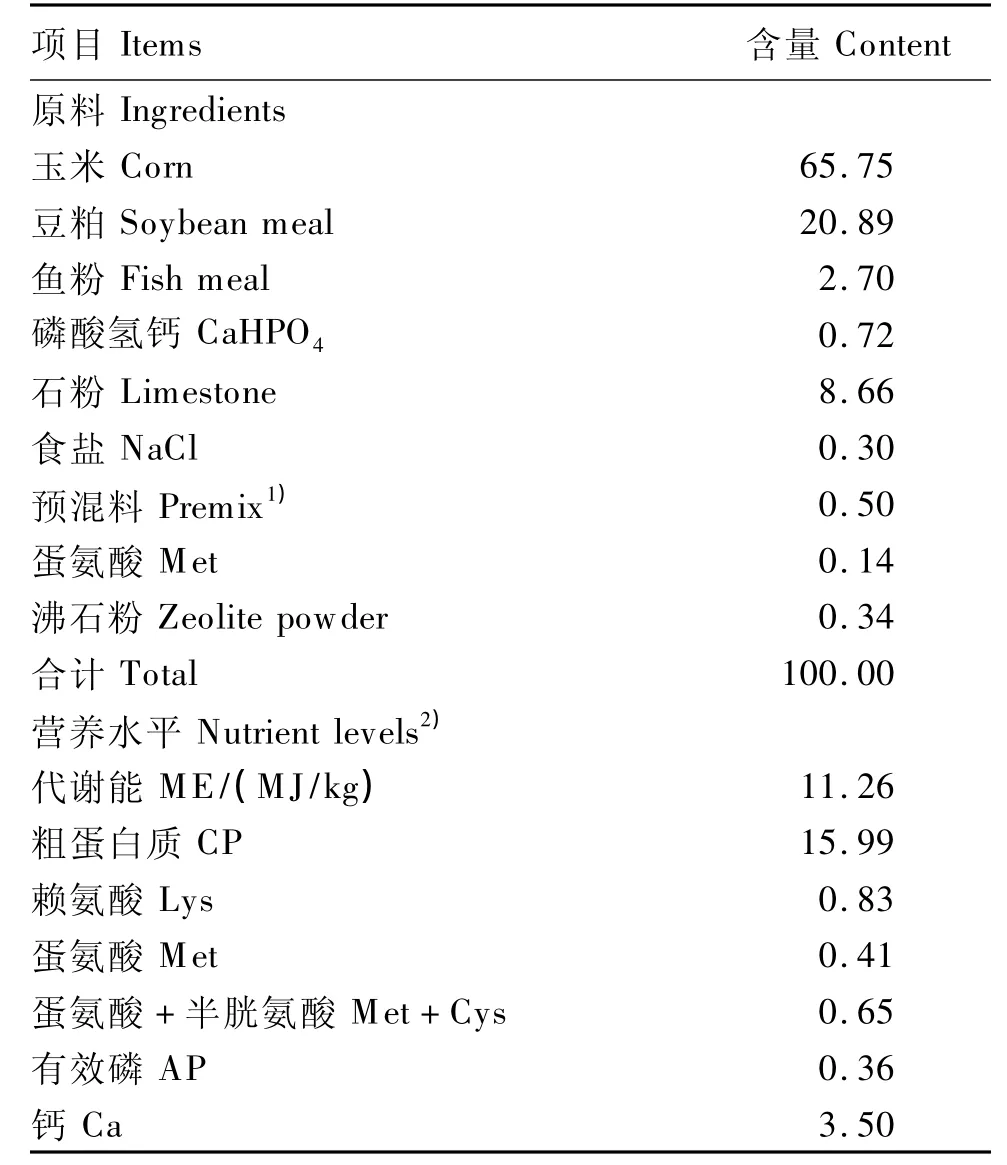
表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels ofthe basal diet(air-dry basis) %
1)预混料为每千克全价料提供The premix provided the following per kg of the diet:VA 7 000 IU,VD32 500 IU,VE 30 mg,VK31 mg,VB11.5 mg,VB24 mg,VB62 mg,VB120.02 mg,烟酸 niacin 30 mg,叶酸 folic acid 0.55 mg,泛酸pantothenic acid 10 mg,生物素 biotin 0.16 mg,氯化胆碱choline chloride 400 mg,Cu 20 mg,Fe 70 mg,Mn 100 mg,Zn 70 mg,I 0.4 mg,Se 0.5 mg。
2)营养水平为计算值。Nutrient levels were calculated values.
1.4.3 血清和肝肾抗氧化指标测定
饲养试验结束时,从每个重复随机选取3只蛋鸡,每组12只,禁食24 h后采血,并摘取肝脏和肾脏,制备血清以及肝脏、肾脏组织匀浆,备检与抗氧化性能相关的指标。
血清、肝脏和肾脏中总抗氧化能力(T-AOC)、总超氧化物歧化酶(T-SOD)活性、丙二醛(MDA)含量、谷胱甘肽过氧化物酶(GSH-Px)活性、还原型谷胱甘肽(GSH)含量均由购自南京建成生物工程研究所的试剂盒测定,试剂的配制和操作步骤均按说明书进行。
1.5 数据处理
试验数据采用SPSS(17.0版)进行单因子方差分析,均以“平均值±标准误”表示,各组间的平均值比较采用Duncan氏法多重比较进行差异显著性检验。以P<0.05作为差异显著性的标准。
2 结果
2.1 铅对蛋鸡生产性能的影响
由表2可知,在8周的试验期内,与对照组相比,各试验组产蛋率和料蛋比均无显著差异(P>0.05)。
1~8周各试验组平均蛋重在数值上均低于对照组,但仅T3组与对照组差异显著(P<0.05),3个试验组间差异不显著(P>0.05)。
除了1~4周T2组外,其余时间段内各试验组的平均日采食量在数值上均低于对照组,其中5~8周T2组下降程度最大,降低了11.83%(P<0.05),1 ~8 周 T1、T2、T3组平均日采食量与对照组相比分别降低了3.72%(P<0.05)、1.93%(P>0.05)、3.63%(P<0.05),3个试验组间无显著差异(P>0.05)。
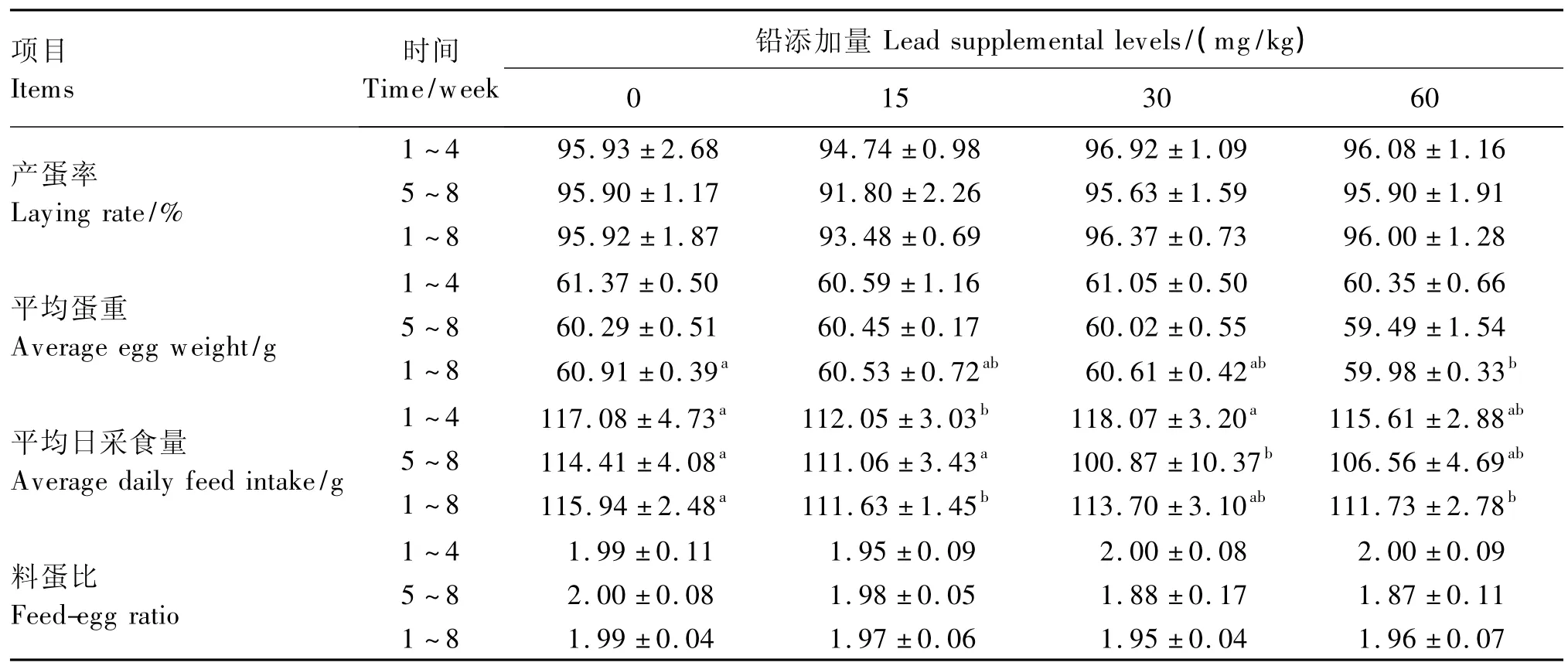
表2 饲粮中铅含量对蛋鸡生产性能的影响Table 2 Effects of dietary lead level on performance of laying hens
同行数据肩注字母不同表示差异显著(P<0.05),无肩注或肩注有相同字母表示差异不显著(P>0.05)。下表同。
In the same row,values with different letter superscripts mean significant difference(P<0.05),while with no or the same letter superscripts mean no significant difference(P>0.05).The same as below.
2.2 铅对蛋品质的影响
由表3可以看出,除了第4周时T1组蛋黄颜色高于对照组(P>0.05)以及T3组蛋白高度较对照组降低了23.89%(P<0.05)外,其余试验组蛋白高度、蛋黄颜色和哈夫单位均随着饲粮中铅含量的增加有降低趋势,但均差异不显著(P>0.05)。
饲粮中铅含量主要对蛋壳强度和蛋壳厚度有影响。第4周和第8周时的蛋壳强度均随着铅添加量的增加有降低趋势,蛋壳强度最小的T3组第4周和第8周时分别比对照组降低了21.89%、16.84%(P<0.05),T2组第4周时蛋壳强度比对照组降低了15.31%(P<0.05),其余试验组与对照组差异不显著(P>0.05)。蛋壳厚度的变化趋势与蛋壳强度类似,与对照组相比,第4周时T1、T2、T3组分别降低了 9.23%、9.98%、19.20%(P<0.05),第8周时分别降低了4.42%、8.44%、9.50%(P<0.05),呈现出明显的剂量-效应关系。
2.3 铅对蛋鸡血清和肝肾抗氧化指标的影响
由表4可以看出,3个试验组血清中T-AOC和T-SOD活性均在一定程度上低于对照组,但差异不显著(P>0.05)。对照组血清中GSH-Px活性为 2 848.66 μmol/L,比 T1、T2、T3组分别高出18.03%、27.08%、31.31%(P <0.05);T2组GSH含量最低,较对照组和T1组分别降低了41.39%、29.66%(P <0.05)。T1、T2、T3组 MDA 含量均在一定程度上高于对照组,其中T3组含量最高,较对照组升高了49.22%(P<0.05),3个试验组间差异不显著(P>0.05)。
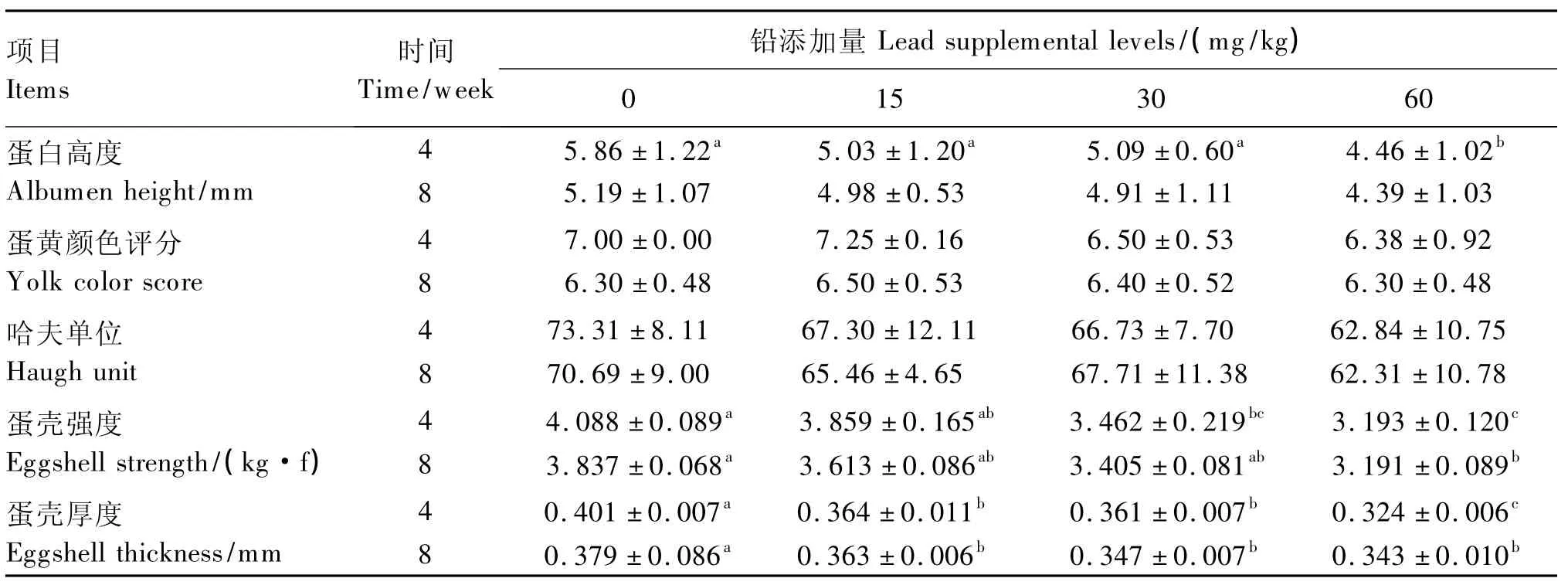
表3 饲粮中铅含量对蛋品质的影响Table 3 Effects of dietary lead level on egg quality
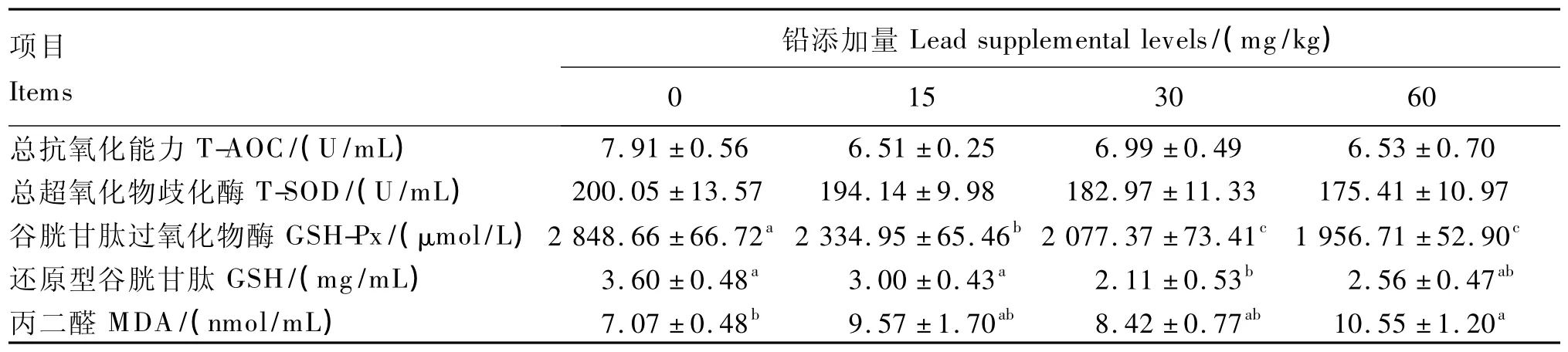
表4 饲粮中铅含量对蛋鸡血清抗氧化指标的影响Table 4 Effects of dietary lead level on antioxidant indices in serum of laying hens
由表5可以看出,饲料中铅污染对蛋鸡肝脏和肾脏抗氧化性能的影响主要体现在其对T-SOD和GSH-Px活性以及MDA含量有显著影响上。尤其是最高剂量组T3组,与对照组相比,肝脏、肾脏T-SOD和 GSH-Px活性均显著降低(P<0.05),MDA含量均显著上升(P<0.05)。T1、T2组肝脏中GSH-Px活性较对照组分别降低了19.09%、18.70%(P<0.05),肝脏其余指标无显著差异(P>0.05)。与对照组相比,肾脏 T1组 T-SOD、GSH-Px活性均显著降低(P <0.05),T1、T2组MDA含量均显著上升(P<0.05)。T-AOC和GSH含量均在一定程度上低于对照组,但差异不显著(P>0.05)。
3 讨论
3.1 铅对蛋鸡生产性能的影响
目前的研究还未发现铅对生物体有任何的营养生理功能[9],而众多研究都证实了铅污染对人和动物的生长发育会产生不良影响[10-12]。余东游[13]在体重33 kg左右猪的饲粮中添加10 mg/kg铅,猪表现出生长缓慢,采食量与日增重均显著降低。Shafiqur等[14]研究发现,在2~6周龄肉鸡的饮水中分别添加250、400 mg/kg醋酸铅均可显著降低肉鸡的平均采食量和日增重,但对饲料转换率无显著影响。Jeng等[15]研究表明,在家养蛋鸭饲粮中分别添加10、20 mg/kg铅对蛋鸭的体重没有显著影响,也没有观察到与铅毒性有关的症状,因此认为10和20 mg/kg铅在3个月的试验期内对蛋鸭没有临床上的毒性效果,这与Coburn等[16]在野生禽类上的报道存在一定的差异,可能是家养禽类较野生禽类可忍受更高剂量的铅。Hermayer等[17]报道,在蛋鸡饲粮中添加 100 mg/kg铅,56 d的试验期结束后未发现铅对蛋鸡生产性能有显著的影响。但Vodela等[18]研究发现,饮水含铅会降低肉鸡的日采食量和日增重,削弱免疫功能。本试验中,除了1~4周T2组平均日采食量外,T1、T2、T3组平均蛋重和平均日采食量均在一定程度上低于对照组,且随着试验时间的增加,产蛋率、平均蛋重和平均日采食量还有进一步降低的趋势,呈现一定的时间-效应与剂量-效应关系。从以上可以看出,试验结果不尽相同,可能是因为铅暴露的生物种类、暴露剂量、暴露时间及方式的不同所致。
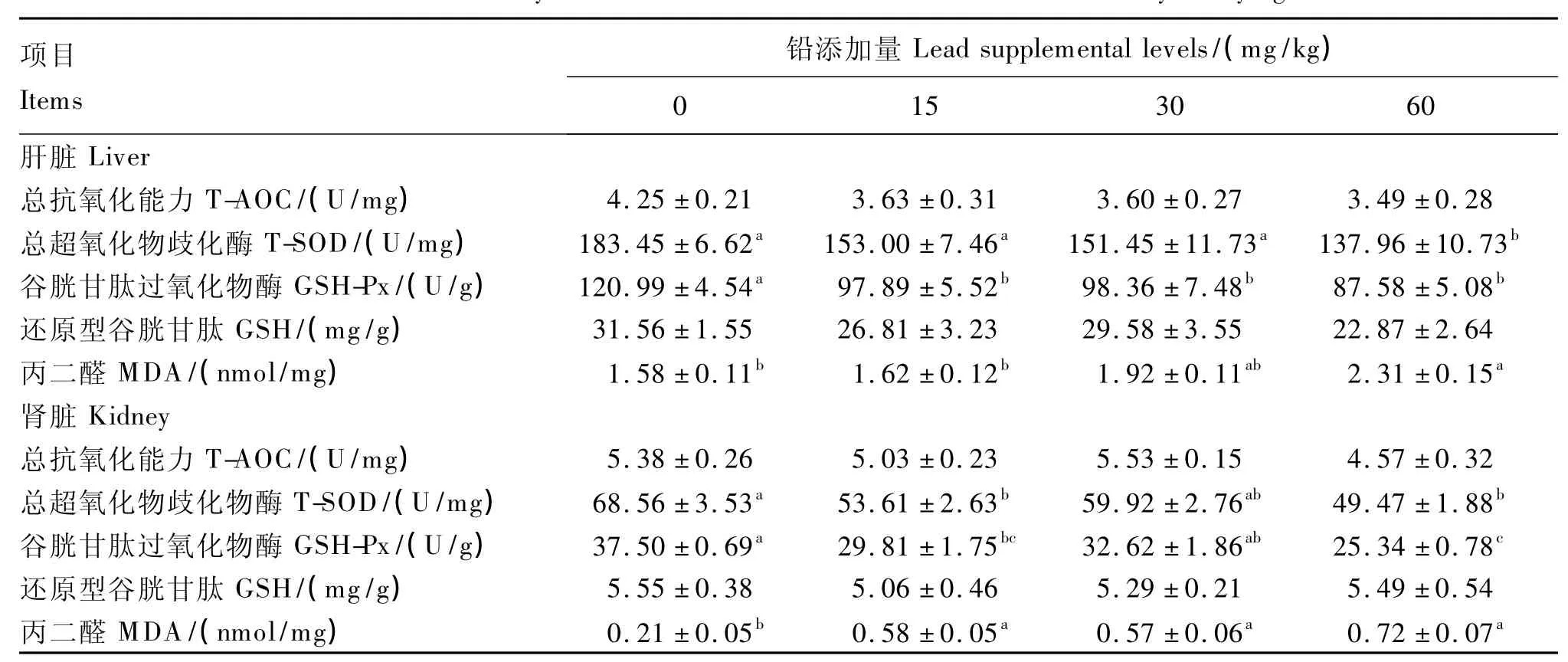
表5 饲粮中铅含量对蛋鸡肝肾抗氧化指标的影响Table 5 Effects of dietary lead level on antioxidant indices in liver and kidney of laying hens
3.2 铅对蛋品质的影响
国内外关于铅对蛋品质影响的研究报道甚少。蛋品质指标,如蛋白高度、哈夫单位等是评价鸡蛋品质的重要指标,蛋白高度越高,哈夫单位越大,说明蛋白越黏稠、品质越好。本试验结果表明,随着饲粮中铅添加量的增加,鸡蛋的蛋白高度、蛋黄颜色和哈夫单位有降低的趋势,但除了第4周时T3组蛋白高度较对照组显著降低外,其余指标均与对照组差异不显著,表明本试验所添加铅的剂量对鸡蛋的蛋白高度、蛋黄颜色和哈夫单位未造成较大影响,可能是由于本试验所用铅的剂量还未达到使蛋品质这3项指标发生显著性降低的水平。
蛋壳质量包括蛋壳厚度、蛋壳强度、蛋壳相对重等多项指标。良好的蛋壳质量有利于减少鸡蛋的破损率、提高种用蛋的孵化率。蛋壳的厚度发生微小的变化,蛋壳的破损程度便受到很大的影响。据报道,蛋壳的厚度在0.38~0.40 mm时,蛋的破损率一般为2% ~3%,而当蛋壳的厚度在0.30~0.32 mm时,蛋壳的破损率可高达10%[19]。一般来说,蛋壳厚度及强度直接影响鸡蛋的破损率。Nyholm[20]研究表明,重金属铅可以改变蛋壳的结构,干扰蛋壳钙的沉积和胚胎发育过程中钙的流动。蛋壳厚度降低是禽类受污染最重要的标志之一。赵立[21]在研究中发现随着饲料中铅沉积时间的延长,蛋壳厚度逐渐降低,且各组间差异显著,然而蛋壳强度未发生显著变化。本试验结果发现,铅对蛋品质的影响主要体现在降低蛋壳强度和蛋壳厚度方面,二者均随着铅添加量的升高和试验时间的延长出现了较为明显的降低,T3组的蛋壳强度显著低于对照组,T1、T2、T3组的蛋壳厚度均显著低于对照组。在蛋壳强度方面的变化与赵立[21]的研究结果不同,原因可能是蛋壳强度不仅由蛋壳厚度决定,蛋的形状、大小及蛋壳表面的状况等因素对其也有一定的影响。铅作为2价金属,与钙离子的转运机制相似,因而可通过与钙竞争直接抑制细胞对钙的主动转运,有试验报道铅中毒会引起体内钙水平降低,认为钙与铅有一定的拮抗作用[22]。蛋壳厚度及强度与蛋壳中的钙、磷及维生素D3等含量密切相关,钙、磷供应不足或比例失调及维生素D3缺乏均会对蛋壳厚度及强度造成一定的影响。维生素D3的前体是一种激素原,本身无活性,需先在肝脏中代谢成25-羟胆钙化醇,再在肾脏进一步羟基化后才形成有活性的维生素D3。由于肝脏和肾脏是铅毒性作用的主要靶器官,铅可能通过对肝肾功能的损伤进而间接影响维生素D3的合成,具体的作用机制还有待进一步深入研究。
3.3 铅对蛋鸡血清和肝肾抗氧化指标的影响
T-AOC是衡量机体抗氧化系统功能状况的综合指标。它的大小可以反映机体抗氧化酶系统[T-SOD、GSH-Px和过氧化氢酶(CAT)等]和非酶系统(GSH、维生素E、半胱氨酸和葡萄糖等)对外来刺激的代偿能力以及机体自由基代谢的状态。本研究结果显示,蛋鸡血清、肝脏和肾脏中T-AOC随着饲粮中铅含量的增加总体呈降低趋势,但各组间均差异不显著。
T-SOD和GSH-Px是体内清除氧自由基的主要抗氧化酶,前者能歧化超氧阴离子自由基(O-·)生成HO,后者可以使有害的过氧化物
2
22还原为无害的羟基化合物,同时促进H2O2分解。GSH-Px可以与T-SOD协同构成防止活性氧损伤的有效防御体系。这些酶的活性与其清除自由基的能力成正比。本试验结果表明,血清以及肝肾T-SOD和GSH-Px活性明显受饲粮中铅含量的影响,这与金海丽[23]、余东游[13]在猪上的试验,Shyam等[24]在小鼠上的试验结果一致。铅对这些抗氧化酶的影响可能基于2个方面的原因,一方面T-SOD和GSH-Px都是含金属离子的蛋白酶,而铅离子(Pb2+)可与这些酶中发挥活性作用的铜离子(Cu2+)、锌离子(Zn2+)等2价金属离子产生拮抗作用[25];此外,许多研究也证实,铅易与这些抗氧化酶上的巯基(—SH)结合,破坏酶的空间构象[26],进而使酶的活性降低,甚至失活。
GSH是体内最主要的、含量最丰富的含巯基的低分子肽,一方面它可以直接清除自由基,另一方面,GSH也是GSH-Px和谷胱甘肽 S-转移酶(GST)2种酶作用的底物,为这2种酶分解过氧化物 所 必 需[27]。 戴 伟[28]研 究 发 现,饲 喂 含 铅800 μg/g的饲粮60 d后,罗非鱼肝脏和肾脏GSH含量均较对照组显著降低,Nuran等[29]以及Jeng[30]在小鼠上也得到了类似的结果。在本试验中,3个试验组蛋鸡血清以及肝肾中GSH含量都较对照组有不同程度的降低,这与前人研究结果一致。
自由基攻击不饱和脂肪酸发生过氧化作用而形成脂质过氧化物,而MDA就是脂质过氧化产物之一,其含量可以间接反映脂质过氧化损伤程度[31]。本试验结果表明,3个试验组蛋鸡血清及肝肾中MDA含量均不同程度地高于对照组,且有一定的剂量-效应关系,T3组血清及肝肾中MDA含量均较对照组显著上升。可见,铅可以造成蛋鸡体内脂质过氧化物的过量产生,使机体受到脂质过氧化损伤。Emrah等[32]在大鼠饮水中添加2 000 mg/kg的铅后发现其血清中MDA的生成量显著高于对照组,其他研究人员也有过类似的报道[33-34]。由上可以得出,铅使氧化应激增强,致使MDA过量产生,进而对机体造成损害。
饲料铅污染增加了蛋鸡血清和肝肾中MDA含量,降低了T-SOD、GSH-Px等抗氧化酶的活性,二者的协同性证明了饲料铅污染造成了蛋鸡机体与肝肾组织的氧化损伤。此外,我们还发现,饲料中铅及其含量对蛋鸡肾脏抗氧化相关指标的影响高于肝脏,可导致蛋鸡较强的肾毒性,究其原因,可能是肝脏的主动调节能力和代偿能力较强,对铅毒性有较大的调节和适应能力。
4 结论
①饲料铅污染显著降低了蛋鸡平均日采食量,但对产蛋率和料蛋比无显著影响。
②饲料铅污染可以使蛋白高度、哈夫单位有降低的趋势,降低蛋品质,对蛋壳强度和蛋壳厚度影响显著,且随着时间的增加,这种降低的效应会越来越明显。
③ 饲料铅污染可以使抗氧化酶,如SOD、GSH-Px等活性降低,诱发蛋鸡脂质过氧化,脂质过氧化产物MDA含量增加。
[1] ADEMUYIWA O,UGBAJA R N,ABAM E,et al.E-rythrocyte acetylcholinesterase activity as a surrogate indicator of lead-induced neurotoxicity in occupational lead exposure in Abeokuta,Nigeria[J].Environmental Toxicology and Pharmacology,2007,24(2):183-188.
[2] ROBIN G,LARRY A,ELLEN K.Lead:male-mediated effects on reproduction and development in the rat[J].Environmental Research,1999,80(4):355 -363.
[3] JOHNY C P,OSCAR P M,ROLANDO H M,et al.Protective effects of spirulina maxima on hyperlipi-demia and oxidative-stress induced by lead acetate in the liver and kidney[J].Lipid in Health and Disease,2010,9:35 -42.
[4] WIGLE D T,LANPHEAR B P.Human health risks from low-level environmental exposure:no apparent safety thresholds[J].Reproductive Toxicology,2007,24(2):131-138.
[5] LEE D H,LIM J S,SONG K,et al.Graded associations of blood lead and urinary cadmium concentrations with oxidative-stress-related markers in the US population:results from the third National Health and Nutrition Examination Survey[J].Environmental Health Perspective,2007,114(3):350 -354.
[6] JURCZUK M,MONIUSZKO-JAKONIUK J,BRZOSKA M M.Involvement of some low-molecular thiols in the peroxidative mechanisms of lead and ethanol action on rat liver and kidney[J].Toxicology,2006,219(1/2/3):11-21.
[7] GURER H,ERCAL N.Can antioxidants be beneficial in the treatment of lead poisoning? [J].Free Radical Biology and Medicine,2000,29(10):927 -945.
[8] SIVAPRASAD R,NAGARAJ M,VARALAKSHMI P.Combined effects of lipoic and 2,3-dimercaptosuccinic acid against lead-induced lipid peroxidation in rat liver[J].The Journal of Nutritional Biochemistry,2004,15(1):18 -23.
[9] TERESA A G,LAURA C.Biochemical changes in the kidneys after perinatal intoxication with lead and/or cadmium and their antagonistic effects when coadministered[J].Ecotoxicology and Environmental Safety,2004,57:184 -189.
[10] 成军,高丰,潘耀谦,等.仔猪试验性铅中毒的病理学研究[J].中国兽医学报,2004,24(4):372-375.
[11] BAKALLI R I,PESTI G M,RAGLAND W L.The magnitude of lead toxicity in broiler chickens[J].Veterinary and Human Toxicology,1995,37(1):15-23.
[12] DILSHAD A K,SHAZIA Q,SHAHID S,et al.Lead exposure and its adverse health effects among occupational worker’s children[J].Toxicology and Industrial Health,2010,26(8):497 -504.
[13] 余东游.纳米级硅酸盐结构微粒-PBAA-驱除猪饲料铅效果及其机理研究[D].博士学位论文.杭州:浙江大学,2005.
[14] SHAFIQUR R,JOSHI M V.Effect of lead toxicity on growth and performance of broilers[J].Journal of Veterinary and Animal Science,2009,5(2):59 -62.
[15] JENG S L,LEE S J,LIU Y F,et al.Effects of lead ingestion on concentrations of lead in tissues and eggs of laying Tsaiya ducks in Taiwan[J].Poultry Science,1997,76:13 -16.
[16] COBURN O R,METZLER D W,TREICHLER R.A study of absorption and retention of lead in wild waterfowl in relation to clinical evidence of lead poisoning[J].The Journal of Wildlife Management,1951,15(2):186-192.
[17] HERMAYER K L,STAKE P E,SHIPPE R L.Evaluation of dietary zinc,cadmium,tin,lead,bismuth and arsenic toxicity in hens[J].Poultry Science,1977,56(5):1721-1722.
[18] VODELA J K,RENDEN J A,LENZ S D,et al.Drinking water contaminatants(arsenic,cadmium,lead,benzene and trichloroethylene).Interaction of contaminants with nutrional status on general performance and immune function in broiler chickens[J].Poultry Science,1997,76:1474 -1492.
[19] 王修启,郑海刚,安汝义,等.影响蛋壳质量的因素及改善措施[J].中国家禽,1999,21(7):39-41.
[20] NYHOLM N E I.Influence of heavy metal exposure during different phase of the ontogeny on the development of pied flycatchers,Ficedula hypoleuca,in nature populations[J].Archives of Environmental Contamination and Toxicology,1998,35(4):632 -637.
[21] 赵立.饲料中铅在鸡种蛋和胚胎中的沉积及其对鸡胚肝肾毒性机理的研究[D].博士学位论文.南京:南京农业大学,2006.
[22] 徐健,颜崇淮,沈晓明,等.铅神经发育毒理的分子机制及相关研究进展[J].中国公共卫生,2005,21(2):231-233.
[23] 金海丽.PBAN吸附猪日粮中重金属铅效果的研究[D].硕士学位论文.杭州:浙江大学,2003.
[24] SHYAM S C,ANAND K.Protective effects of vitamin E against lead-induced deterioration of membrane associated type-Ⅰ iodothyronine 5'-monodeiodinase(5'-D-Ⅰ)activity in male mice[J].Toxicology,1997,124(3):203 -209.
[25] ABDELRAHIM A,HUNAITI M.Effect of lead concentration on the level of glutathione,glutathione S-transferase,reductase and peroxidase in human blood[J].The Science of the Total Environment,2000,248:45-50.
[26] HUNAITI A,SOUD M,KHALIL A.Lead concentration and level of glutathione, glutathione S-tranaferase,reductase and per-oxidase in the blood of some occupational workers from Irbid city,Jordan[J].The Science of the Total Environment,1995,170:95-100.
[27] SAXENA G,PATHAK U,FLORA S J.Beneficial role of monoester of meso-2,3-dimercaptosuccinic acid in the mobilization of lead and recovery of tissues oxidative injury in rats[J].Toxicology,2005,214(1/2):39-56.
[28] 戴伟.饲料铅对罗非鱼的毒性及硅酸盐纳米级微球减轻其毒害影响的研究[D].博士学位论文.杭州:浙江大学,2008.
[29] NURAN E,PIYANEE T,TERESE C,et al.In vivo indices of oxidative stress in lead-exposed C57BL/6 mice are reduced by treatment with meso-2,3-dimercaptosuccinic acid or N-acetylcysteine[J].Free Radical Biology and Medicine,1996,21(2):157 -161.
[30] JENG M H.Lead toxicity as related to glutathione metabolism[J].The Journal of Nutrition,1981,111:26-33.
[31] GARCIA-FERNANDEZ A J,BAYOUMI A E,PEREZPERTEJO Y,et al.Alterations of the glutathione-redox balance induced by metals in CHO-K1 cells[J].Comparative Biochemistry and Physiology and Physiology Part C:Toxicology Pharmacology,2002,132(3):365 -373.
[32] EMRAH C,METIN A,IHSAN H.Antioxidant effects of methionine,α-lipoic acid,N-acetylcysteine and homocysteine on lead-induced oxidative stress to erythrocytes in rats[J].Experimental and Toxicology Pathology,2008,60(4/5):289 -294.
[33] NEHRU B,KANWAR S S.N-acetylcysteine exposure on lead-induced lipid peroxidative damage and oxidative defense system in brain regions of rats[J].Biological Trace Element Research,2004,101(3):257 -264.
[34] JIN X,LING-JUN L,CHEN W,et al.Lead induces oxidative stress,DNA damage and alteration of p53,Bax and Bcl-2 expressions in mice[J].Food and Chemical Toxicology,2008,48(5):1488 -1494.
