外源油菜素内酯对番茄铜胁迫的缓解效应
2012-08-31王秀峰姜春辉李晓云崔秀敏
尹 博,王秀峰,姜春辉,李晓云,崔秀敏*
(1山东农业大学资源与环境学院,山东泰安271018;2山东农业大学园艺科学与工程学院,山东泰安271018)
铜是植物正常生命活动所必需的微量矿质元素,广泛参与各种生命活动。但植物对铜的需求很低,稍过量就会对植物造成伤害,大部分作物以土壤有效铜含量低于5 mg/kg为缺乏临界值。铜过量会导致一系列生物代谢过程的紊乱,并最终抑制植物生长而致作物减产[1]。目前铜矿的开采和冶炼厂三废的排放、含铜农业化学物质(杀真菌剂、杀虫剂和化肥)和有机肥(高铜猪粪、鸡粪和厩肥)的施用可使农田土壤,特别是温室土壤铜含量达到原始土壤的几倍乃至几十倍[2-3],温室土壤重金属污染变得日益严峻[4-5]。因此,研究重金属毒害的缓解机理已成为农业可持续发展中亟待解决的问题。
表油菜素内酯(Epibrassinolide,简称 EBR),是一类具有高活性的甾醇内酯类结晶物,是植物正常生长和发育所必需的,被公认为第六大类植物激素,具有促进作物生长,提高含糖量,增加产量和增强对寒、旱、涝、盐等多种逆境抵抗能力的作用。近年来,一些研究表明,油菜素内酯能够提高植物对铝、镍等重金属的抗性[6-7],但对重金属铜胁迫的效应还未见报道。
本文主要以番茄为试验材料,研究外源EBR对铜胁迫下番茄的缓解效应,为利用常规作物进行生物修复治理重金属污染提供一定的科学依据。
1 材料和方法
1.1 供试材料
供试番茄为“改良毛粉802F1”。Hoagland营养液组 成:Ca(NO3)2·4H2O、KNO3、NH4NO3、KH2PO3、MgSO4、铁盐、微量元素,以上试剂均为分析纯,用蒸馏水配制适宜浓度待用。0.1 mg/L EBR:准确称取一定量的EBR,用少量无水乙醇溶解,用蒸馏水定容到一定体积,4℃保存待用。
1.2 试验设计
种子经55℃温汤浸种消毒15 min,然后在润湿的吸水纸上26℃催芽。待种子露白后,播于洗净的蛭石中,萌发后用1/4 Hoagland营养液浇灌。当幼苗长出3~4片真叶时,挑选生长一致的植株洗净根系,移栽于4L塑料桶中,用厚度为3 cm的泡沫塑料板做成圆形盖子,覆盖在塑料桶顶部,每盆栽4株,先用1/2 Hoagland营养液培,1周后换成完全营养液,此后每3d更换一次营养液。营养液栽培期间用电动气泵24 h连续通气,待番茄植株长至5~6片真叶时进行铜胁迫处理,处理期间,对相应处理每天均匀细雾喷施0.1 mg/L的EBR溶液(以叶面滴水为止),对照喷等量清水。试验用水全部为蒸馏水。
试验设4个处理:1)完全营养液(CK);2)50 μmol/L CuCl2,铜胁迫处理 (CK+Cu);3)50 μmol/L CuCl2+0.1 mg/L EBR,油菜素内酯缓解处理(CK+Cu+EBR);4)0.1 mg/L EBR,油菜素内酯对照(CK+EBR)。每个处理三次重复,温室内随机排列。用低浓度的KOH或者HCl调节pH至5.5±0.2,处理8 d后,分别收获各处理植株,分成不同部位,液氮速冻,置于-80℃左右贮存备测。
1.3 测定项目与方法
叶绿素含量的测定用80%丙酮提取法;根系活力用 TTC 法测定[8]。
抗氧化酶系比活力测定的样品制备,取0.5g叶片加3 mL 50 mmol/L PBS缓冲液(含2%PVP,0.2 mmol/L EDTA,提取液中加入5 mmol/L ASA),于冰浴中研磨提取,匀浆液于12000 r/min下低温离心20 min。上清液用于酶比活力和丙二醛含量测定。
植物叶片和根系中 Cu、Fe、Mn、Zn含量的测定采用HNO3-HClO4消解—原子吸收分光光度法。
1.4 数据处理
采用Microsoft Excel软件对数据进行处理及绘图,采用DPS统计软件对平均数进行多重比较。
2 结果与分析
2.1 外源EBR对铜胁迫下抗氧化酶系统的影响
2.1.1 外源EBR对铜胁迫下SOD比活力的影响
超氧化物歧化酶(SOD)是植物体内以氧自由基为底物的酶,在活性氧代谢中处于重要地位,可淬灭超氧负离子的毒性,终止由超氧负离子启动的一系列自由基连锁反应所造成的生物膜损伤。图1表明,单独铜胁迫处理使番茄叶片和根系SOD比活力分别比对照降低了68.1%和86.6%,差异达极显著水平;与CK+Cu处理相比,CK+Cu+EBR处理的番茄叶片和根系SOD比活力显著升高,根系达到铜胁迫处理的2.8倍,而叶片提高了1倍。这表明外源EBR能够显著缓解铜胁迫对SOD比活力的抑制。正常营养液培养条件下,外施EBR降低了叶片SOD的比活力,对根系SOD比活力影响不显著。
2.1.2 外源EBR对铜胁迫下番茄POD比活力的影响 过氧化物酶(POD)广泛存在于植物体不同组织中,能够反映植物生长发育的特点、体内代谢状况以及对外界环境的适应性。POD活性的升高是植物应对环境胁迫的一种适应性反应。一定浓度的重金属胁迫能够诱导植物组织中POD活性升高,这是植物对所有非生物胁迫的共同响应[14]。POD活性的增加可能是由于重金属胁迫诱导产生了一些对植物体有害的过氧化物,POD利用H2O2催化对自身有害的过氧化物(POD底物)的氧化和分解,POD活性随着重金属毒害的增加而逐渐增加[15-16]。图1还看出,番茄叶片与根系POD比活力对铜胁迫的响应趋势不尽一致。与对照相比,CK+Cu处理使番茄叶片POD比活力降低了10%,而使根系POD比活力提高了81.5%,达显著水平;而CK+Cu+EBR与CK+Cu处理相比,叶片中POD比活力提高了27.6%,根系POD比活力降低了14.6%。对正常供应营养液的番茄而言,外源EBR显著提高了叶片POD的比活力,对根系POD的比活力影响不显著。
2.1.3 外源EBR对铜胁迫下番茄CAT比活力的影响 过氧化氢酶(CAT)主要存在于植物过氧化物酶体与乙醛酸循环体中,是清除H2O2的主要酶类之一。过氧化氢酶可催化如下反应:2H2O2→O2+2H2O,但对H2O2的亲和力较弱。酶的亚细胞分布表明,过氧化氢酶主要清除光呼吸中产生的H2O2,但因为H2O2可以穿过膜扩散,而非严格的区域化。研究表明,CAT是C3植物中H2O2清除的关键酶,而且是C3植物耐受胁迫所必需的。图1显示,与对照相比,番茄叶片和根系CAT比活力在单独铜胁迫处理下分别降低了53.3%、36.4%;而CK+Cu+EBR处理的番茄叶片和根系CAT比活力比CK+Cu处理有显著升高,叶片提高 39.5%,根系提高41.6%,均达到显著水平。正常营养液培养的番茄喷施外源EBR后对叶片和根系CAT比活力没有显著影响。
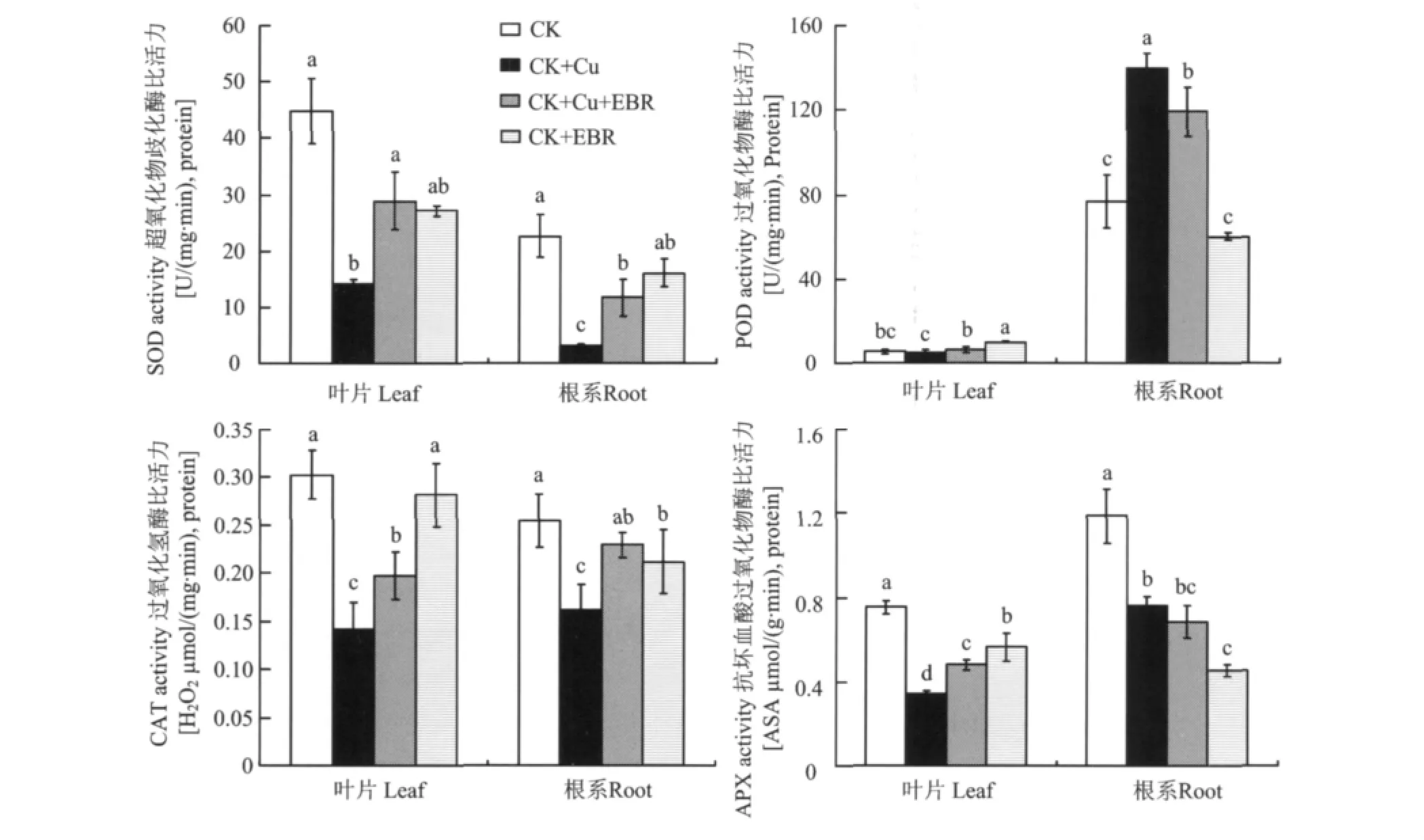
图1 外源EBR对铜胁迫下番茄叶片和根系SOD、POD、CAT和APX比活力的影响Fig.1 Effects of the exogenous EBR on SOD,POD,CAT and APX activities in tomato leaves and roots under the copper stress
2.1.4 外源EBR对铜胁迫下番茄APX比活力的影响 抗坏血酸过氧化物(APX)酶位于细胞质中或与细胞壁结合,与其它氧化还原反应相偶联起到末端氧化酶的作用,能催化抗坏血酸的氧化,具有抗衰老等作用,其对H2O2的亲和力远远大于CAT,在植物体的物质代谢中具有重要的作用。与对照相比,单独铜胁迫处理分别使番茄叶片APX比活力降低54.9%,根系APX比活力降低36%;而喷施EBR后,与CK+Cu处理相比,番茄叶片APX比活力提高41.4%,根系APX比活力降低10%。正常营养液培养的番茄幼苗喷施外源EBR对叶片和根系APX比活力有一定的抑制作用(图1)。
第二,实现企业管理会计与全面预算管理整合,能够在企业内部进行动态预算管理,及时准确的掌握预算有关的动态信息,并结合企业经营管理的实际情况,对预算进行调整完善,以进一步强化对企业整体管控的效果。
2.2 外源EBR对铜胁迫下番茄MDA含量的影响
丙二醛(MDA)是植物受到逆境胁迫时的指示指标,MDA含量越高说明植物受到的胁迫程度越高。图2表明,与对照相比,单独铜胁迫分别提高了番茄叶片和根系的MDA含量,提高幅度为17.4%和34.1%;与CK+Cu处理相比,CK+Cu+EBR处理的植株叶片和根系MDA含量分别降低了12.5%和36.6%,几乎恢复到CK处量的水平。正常营养液培养的番茄喷施外源EBR对叶片和根系MDA含量没有明显影响。
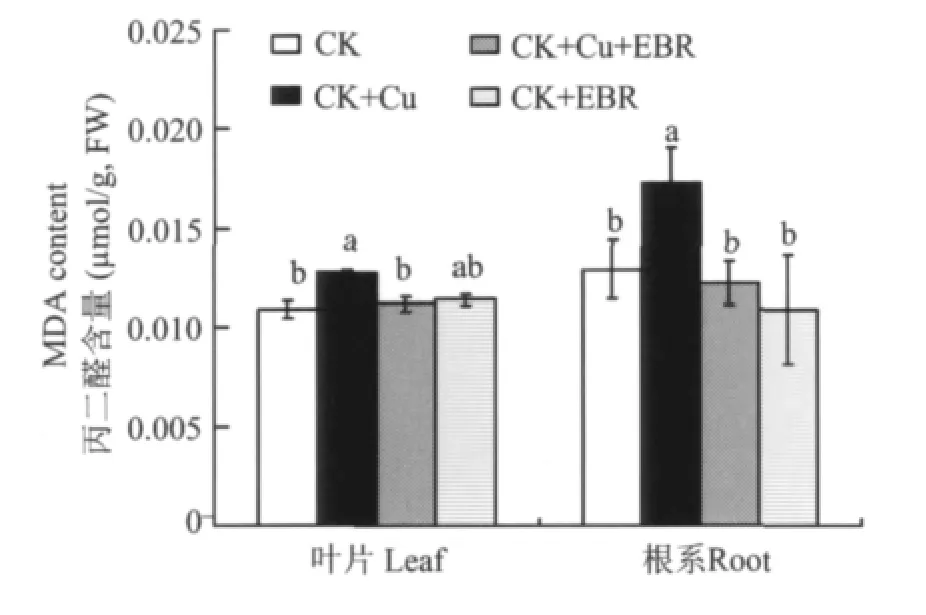
图2 外源EBR对铜胁迫下番茄叶片和根系MDA含量的影响Fig.2 Effects of the exogenous EBR on MDA contents of tomato leaves and roots under the copper stress
2.3 外源EBR对铜胁迫下番茄铜、铁、锌、锰吸收的影响
铜是植物正常生长所必需的,广泛参与植物的各种生理代谢活动,是细胞色素氧化酶、多酚氧化酶、抗坏血酸氧化酶、多胺氧化酶、Cu-Zn-SOD等蛋白质的重要辅因子,主要参与呼吸代谢中的氧化还原反应。然而过量铜能抑制光合作用暗反应中的几个关键酶Rubsic和PEPC活性,损伤光合细胞器、破坏类囊体结构、抑制光合链电子传递,还导致植株叶片铁元素含量的大幅度下降。
图3表明,铜胁迫下番茄叶片和根系铜的吸收显著增加,与对照相比,CK+Cu处理番茄叶片和根系铜含量分别提高41.5%和3.4倍。而CK+Cu+EBR比CK+Cu处理明显降低番茄对铜的吸收与转运,番茄叶片铜含量降低15.4%,根系降低36.3%,差异显著;而单独喷施EBR对植株铜含量的影响不显著。
铜胁迫显著影响番茄对带有同等电荷的铁、锌、锰的吸收与转运。与对照相比,CK+Cu处理的番茄植株叶片铁、锌、锰元素的含量分别降低了12%、21.2%、13.2%;根系铁、锌含量分别升高97.3%、25.3%,而锰含量降低48.2%,差异显著;与CK+Cu处理相比,CK+Cu+EBR处理番茄叶片铁、锌、锰含量分别提高了10%、23.3%、15.9%;根系铁、锌、锰含量则分别降低了22.6%、31.5%、40%,均达到显著水平。
2.4 外源EBR对铜胁迫下番茄叶绿素和根系活力的影响
叶绿素作为植物进行光合作用的主要色素,其含量高低可以直接反映光合作用能力的强弱。过量铜会使植株铜元素含量上升而铁元素含量的大幅下降,植株叶片铁缺乏引起细胞代谢紊乱,从而使叶绿素的合成受到抑制。
图4表明,与对照相比,铜胁迫处理番茄叶片叶绿素含量降低了41.4%,而外源EBR能在一定程度上缓解此伤害。与CK+Cu处理相比,CK+Cu+EBR处理的植株叶绿素含量提高32.2%,单独施EBR对叶绿素含量有所提高,但差异不显著。就根系活力来说,与对照相比,单独铜胁迫处理使番茄根系活力降低了56.4%,而喷施外源EBR后,CK+Cu+EBR处理的番茄植株根系活力比CK+Cu处理提高了92.7%。
2.5 外源EBR对生物量的影响
图5可以看出,铜胁迫对番茄幼苗生物量有显著影响,与对照相比,单独铜胁迫处理单株生物量下降了32%;而CK+Cu+EBR处理则显著缓解了这种抑制,番茄幼苗的单株重量提高了20.9%,达显著水平,但没有恢复到对照水平。单独喷施EBR反而抑制了番茄的生长。
3 讨论与结论
铜胁迫能够诱发膜脂过氧化、膜透性上升、离子大量外渗,且MDA大量积累,根系活力受到抑制。正常情况下,植物自身能通过抗氧化酶系统清除自身产生的活性氧,缓解其对植物自身的伤害;其中SOD作为植物抗氧化系统的第一道防线,清除细胞中多余的超氧阴离子,POD、CAT、APX也是清除过氧化物和H2O2的主要酶类。本研究铜胁迫下SOD、CAT、APX等的比活力明显受到抑制,而外加EBR后其比活力显著升高,并且MDA含量显著下降,说明铜胁迫下EBR一定程度上可以通过调控抗氧化酶的活性来缓解铜胁迫。而铜胁迫下根系POD的比活力明显提高,施入EBR后POD比活力下降,但仍比对照高,原因可能是EBR作为生物活性分子激活了POD的活性。这与王友保和刘登义报道的铜胁迫在小麦上的效应一致[17],可能是由于铜胁迫通过一系列生理生化反应,使POD底物浓度增加、POD比活力被刺激所致;铜胁迫后SOD、POD、CAT、APX的变化趋势并非完全一致,这些现象可能与不同氧化酶类对铜胁迫处理下铜的不同适应时间和浓度有关系。
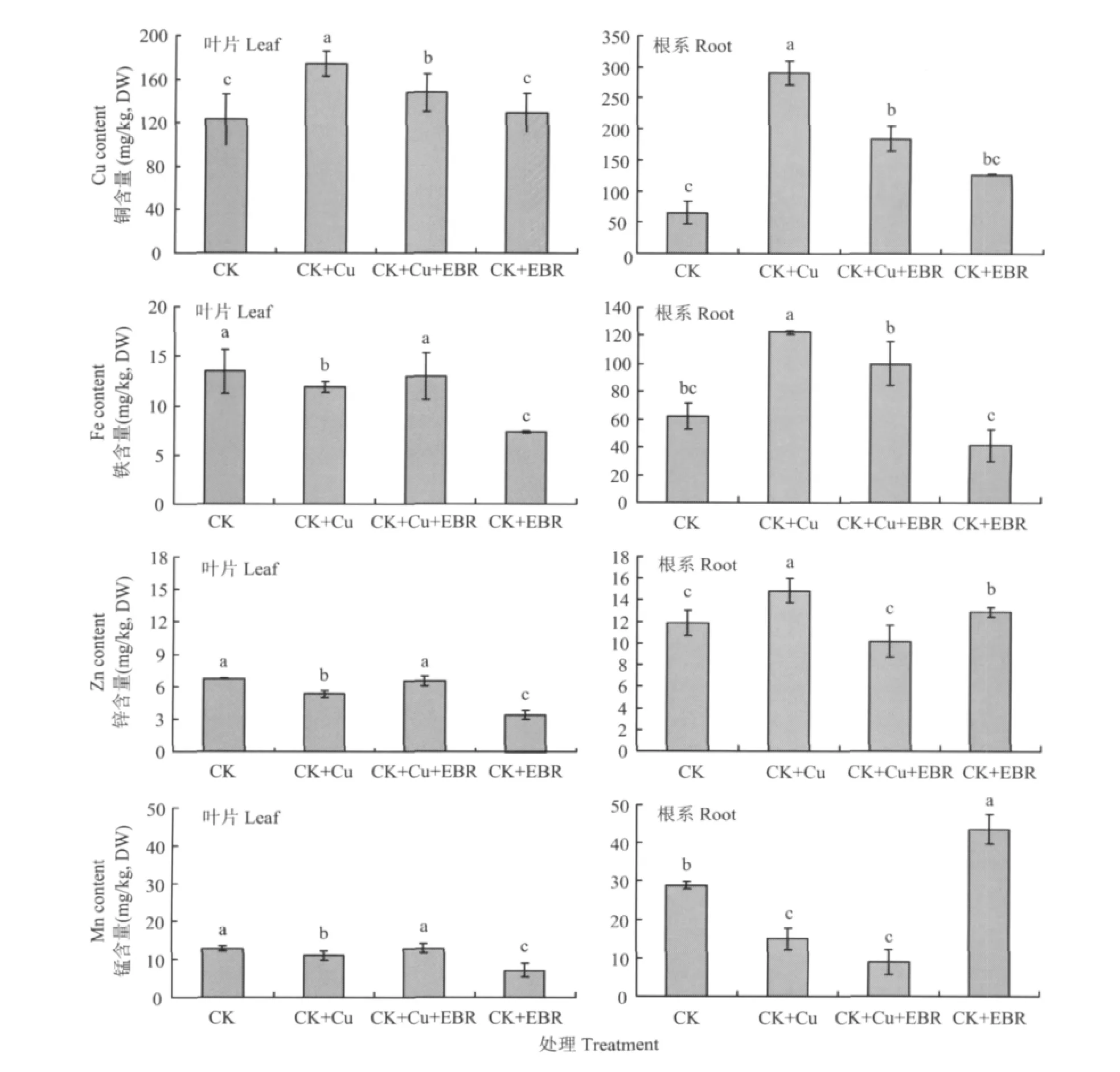
图3 外源EBR对铜胁迫下番茄叶片和根系铜、铁、锌、锰含量的影响Fig.3 Effects of the exogenous EBR on Cu,Fe,Zn and Mn contents of tomato leaves and roots under the copper stress
叶绿素作为主要的光合色素,参与光能的吸收、传递和转化。铜胁迫下番茄叶绿素含量显著下降。一方面,铜进入植物体内可使叶绿素酶活性比例失调,致使叶片叶绿素分解加快;另一方面,由于铜局部积累过多,与叶绿素蛋白质的-SH结合或取代其中铁、锌、锰等,使得叶绿素蛋白中心离子组成发生变化,破坏了叶绿素的结构和功能。此外,高浓度铜胁迫通过抑制根系生长,使根系的养分吸收能力下降,造成铁缺乏,也会导致叶绿素合成降低。而外加EBR后,叶绿素的含量有明显提高,原因一方面可能是EBR激活了在铜胁迫下的叶绿素合成过程中的某些酶的活性;另一方面也可能是EBR阻止了铜与叶绿素的接触;外源EBR提高了番茄铜胁迫下的根系活力,增加了叶片铁、锌等元素的含量,在一定程度上也减缓了对叶绿素的破坏。

图4 外源EBR对铜胁迫下番茄叶绿素含量和根系活力的影响Fig.4 Effects of the exogenous EBR on the chlorophyll contents and root activities of tomato under the copper stress

图5 外源EBR对铜胁迫下番茄生物量的影响Fig.5 Effects of the exogenous EBR on the plant weight of tomato under the copper stress
适应植物体正常生长的铜含量范围很窄,稍微过量的铜便会干扰细胞代谢和离子平衡对植物产生毒害作用。Patsikka等认为[18],铀胁迫提高光系统Ⅱ(PSⅡ)对光的敏感性,原因是过量铜处理使铁含量大幅度下降,植株叶片铁缺乏引起细胞代谢紊乱,叶绿素合成受到抑制。由图3可以看出,50 μmol/L铜处理一周后番茄铜含量显著升高,铁含量显著降低,而外施EBR能有效地降低番茄铜含量,叶片中铁含量几乎恢复到正常水平。外源EBR同样对铜胁迫下番茄叶片锌和锰的含量有调节作用,锌、锰含量几乎恢复到了正常水平;而铜胁迫下根系中铁、锌的吸收与叶片趋势相反,与铜胁迫处理相比,施加外源EBR显著降低了根系铁、锌含量,对锰的影响不显著,这与以往研究结果不太一致[19],有待进一步探索。
从抗氧化酶活性、矿质元素、根系活性、生物量等指标看,同正常营养液处理相比,外源EBR在铜胁迫逆境条件下更能发挥作用,说明外施EBR在铜胁迫的缓解方面有显著的作用。
[1]Wojcik M,Tukiendorf A.Response of wild type ofArabidopsis thalianato copper stress[J].Biol.Plantarum,2003,46(1):79-84.
[2]Brun L A,Maillet J,Hinsinger Pet al.Evaluation of copper availability to plants in copper-contaminated vineyard soils[J].Environ.Pollut.,2001,111:293 -302.
[3]Kaplan M.Accumulation of Cu in soils and leaves of tomato plants in greenhouses in Turkey[J].Plant Nutr.,1999,22:237 -244.
[4]黄治平,徐斌,张克强,杨秀春.连续四年施用规模化猪场猪粪温室土壤重金属积累研究[J].农业工程学报,2007,23(11):239-243.
Huang Z P,Xu B,Zhang K Q,Yang X C.Accumulation of heavy metals in the four years’continual swine manure-applied greenhouse soils [J].Trans.Chin.Soc.Agric.Eng.,2007,23(11):239-243.
[5]曾希柏,李莲芳,白玲玉,等.山东寿光农业利用方式对土壤砷累积的影响[J].应用生态学报,2007,18(2):310-316.
Zeng X B,Li L F,Bai L Y.Arsenic accumulation in different agricultural soils in Shouguang of Shandong Province[J].Chin.J.Appl.Ecol.,2007,18(2):310 -316.
[6]Abdullahi B A,Gu X G,Gan Q L,Yang Y H.Brassinolide amelioration of aluminium toxicity in mung bean seedling growth [J].Plant Nutr.,2003,26:1725 -1734.
[7]Alam M M,Hayat S,Ali B,Ahmad A.Effect of 28-homobrassinolidetreatment on nickel toxicity inBrassica juncea[J].Photosynthetica,2007,45:139-142.
[8]Arnon D I.Copper enzymes in isolated chloroplast:Polyphenoloxidase in Beta vulgaris[J].Plant Physiol.,1949,24:1 -15.
[9]Gong H J,Zhu X Y,Chen K Met al.Silicon alleviates oxidative damage of wheat plants in pots under drought[J].Plant Sci.,2005,169:313–321.
[10]Cakmak I,Marschner H.Magnesium deficiency and highlight intensity enhance activities of superoxide dismutase,ascro bate peroxidase,and glutathione reductase in bean leaves[J].Plant Physiol.,1992,98(4):1222 -1227.
[11]Giannopotitis C N,Ries S K.Superoxide dismutase:I.Occurrence in higher plants[J].Plant Physiol,1977,59:309 -314.
[12]Nakano Y,Asada K.Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloropasts[J].Plant Cell Physiol.,1981,(22):867 -880.
[13]赵世杰,许长成,邹琦.植物组织中丙二醛测定方法的改进[J].植物生理学通讯,1994,30(3):207-210.
Zhao S J,Xu C C,Zou Q.Improvements of method for measurement of malondialdehvde in plant tissues[J].Plant Physiol.Comm.,1994,30(3):207-210.
[14]Mishra S,Srivastava S,Tripathi R Det al.Lead detox-ification by coontail(Ceratophyllum demersumL.)involves induction of phytochelatins and antioxidant systemin response to its accumulation[J].Chemosphere,2006,65:1027-1039.
[15]Piechalak A,Tomaszewska B,Baralkiewicz Det al.Accumulation and detoxification of lead ions in legumes[J].Phytochemistry,2002,60:153-162.
[16]Ruley A T,Nilesh S C,Sahi S V.Antioxidant defense in a lead accumulating plant,Sesbania Drummond [J].Plant Physiol.Biochem.,2004,42:899-906.
[17]王友保,刘登义.Cu,As及其复合污染对小麦生理生态指标的影响[J].应用生态学报,2001,12(5):773-776.
Wang Y B,Liu D Y.Effect of Cu,As and their combination pollution on ecophysio logical index of wheat[J].Trans.Chin.Soc.Agric.Eng.,2001,12(5):773 -776.
[18]Patsikka E,Kairavuo M,Season Fet al.Excess copper predisposes photosystemⅡto photoinhibitionin vivoby out competing iron and causing decrease in leaf chlorophyll[J].Plant Physiol.,2002,129:1359 -1367
[19]张义凯,韩小娇,崔秀敏,等.外源NO对铜胁迫下番茄光合、生物发光特性及矿质元素吸收的影响[J].植物营养与肥料学报,2010,16(1):174-180.
Zhang Y K,Han X J,Cui X Met al.Effects of exogenous nitric oxide on photosynthetic,bioluminescent characteristics and mineral element contents in tomato under copper stress[J].Plant Nutr.Fert.Sci.,2010,16(1):174 -180.
