设施菜田土壤剖面中的反硝化特征
2012-08-28宋贺徐新超王敬国陈清郭景恒王进闯
宋贺,徐新超,王敬国,陈清,郭景恒,王进闯
(中国农业大学资源与环境学院,农业部植物营养学重点实验室,北京 100193)
生物反硝化过程是农田氮素损失的重要途径[1],它产生的N2O、NO等气体会对臭氧层产生危害[2-3],并会产生一定的温室效应[4]。该过程受到氧分压、含水量、有机碳和含量等因素的影响[5-6]。农田管理措施中,灌溉会通过增大土壤的含水量,改变土壤通气状况和氧分压影响反硝化过程。当土壤孔隙含水量超过60%时,反硝化过程会受到强烈的影响[7]。施肥则是通过为反硝化微生物提供能源、电子供体和底物来影响反硝化过程[8]。总的来说,水肥投入将会促进反硝化过程的进行[9-10]。
农业实践中,常会给菜田特别是设施菜田投入过量的水肥。随着种植结构的调整,设施蔬菜种植已逐渐成为我国蔬菜的主导产业,其种植面积已从上个世纪八十年代初的0.7万公顷,增加到了2008年的334.7万公顷,增加了近500倍[11-12]。但大部分的设施菜田,每年化肥氮和有机肥的投入量多会超过每公顷1200 kg和10 t,灌溉量也常会超过1000 mm[13-15]。过量的有机碳、氮和水投入,将促进反硝化的进行,增大 N2O、NO等气体的排放。Ryden和Lund研究发现,菜田的反硝化损失可高达14%~52%,而N2O排放则占整个反硝化损失的13% ~20%[1]。在这种长期的大水大肥高投入的条件下,整个土体的反硝化特征,比如反硝化潜势等可能会发生改变,不同土层之间的反硝化特征也可能会存在差异。
目前对反硝化潜势等特征的研究多集中在粮田的表层土壤[16-17],对设施菜田不同土层土壤研究较少。在设施菜田中,除了表层土壤进行反硝化外,底层土壤也可能会进行反硝化,因为高投入的碳、氮会淋洗到底层,为反硝化微生物提供底物。忽略对下层土壤的研究可能会低估土壤氮素的反硝化损失。此外,现在对氮素反硝化的研究,多采用田间表层通量研究,很少与剖面观测同步,这可能会低估反硝化产物量,因为表层土壤除了向空气中排放N2O和NO等气体外,还可能同时会向底层土壤扩散。
国内外研究反硝化过程的方法,多数是采用乙炔抑制法和示踪法,这些方法在一定条件下为研究反硝化过程提供了有效途径,但它们一般不能连续恒压检测,且无法准确地定量N2,从而很难精确追踪反硝化过程。本研究采用引进的自动连续在线培养体系(Robot系统)进行相关研究[18]。该系统可连续在线实时恒压监测反硝化过程中N2O、NO、N2、O2和CO2的浓度变化,密封性较好,可准确定量N2。因此,本研究以中国农业大学在山东寿光的大棚蔬菜地的长期定位试验点土壤为研究对象,采用原位土壤硅胶管测定法和自动连续在线培养体系(Robot系统)研究剖面原位N2O浓度变化和各土层反硝化产物的产生特征,为准确定量地测定设施菜田土壤反硝化损失、N2O和NO的排放量提供理论依据。
1 材料与方法
1.1 试验地点概况
本试验田是中国农业大学在山东省寿光市罗家村(36o55'N,118o45'E)的一个长期定位试验点。该试验点建于2004年,每年种植两季番茄。所选温室为该地区典型的传统冬温式日光温室,采用后土墙(3.5 m),水泥柱和竹架结构,种植土地宽7.8 m,长84 m,种植面积为655 m2,常年覆盖乙烯–醋酸乙烯(EVA)多功能复合膜。当地的自然年降水量为558 mm,平均温度12.4℃。试验初始时,0—10 cm土层土壤有机质含量为18.3 g/kg,全氮1.37 g/kg,-N 112 mg/kg,速效钾 299 mg/kg,速效磷299 mg/kg,容重1.44 g/cm3。有关试验点的更多细节参考 Ren 等[19]。
1.2 试验设计和方法
试验分为田间原位测定和室内培养试验两个部分。
1.2.1 田间原位测定 试验从2010年3月21日开始,到2010年5月28日结束,包括2010年冬春季的所有6次追肥时期。试验处理包括:1)空白对照处理(CK),不施用有机肥和化学氮肥;2)农民传统施肥处理(CN),即在实验开始前,施风干鸡粪8 t/hm2,相当于N 146 kg/hm2,均匀撒入作为基肥。化学氮肥作为追肥和灌溉水一起施用。追肥时间根据作物的生长发育情况由农户决定,每次用量为N 120 kg/hm2,共6次,共施 N 720 kg/hm2。6次追肥时间分别为3月26日、4月7日、4月22日、4月30日、5月10日和5月19日,每次灌溉量约为50 mm。小区面积为7.8 m ×5.6 m,3次重复。
采用硅胶管法对土壤剖面的N2O浓度进行观测[20]。在每个小区的50 cm和90 cm处,埋下水平缠绕成圈形的硅胶管,硅胶管的一端封闭,另一端连接Teflon小管。Teflon小管内径2 mm,外径4 mm,另一端连接三通阀,三通阀露出地表10 cm。硅胶管壁厚3 mm,内径10 mm,长1.3 m,内部集气体积约100 mL。采气时,用60 mL注射器连接三通阀,抽大约40 mL气体。采气后,打开三通阀使它与大气相通,以便平衡里面气压,随后关闭。在施肥前采气一次,施肥后约每隔一天采气一次。
1.2.2 室内培养试验 在作物生长季,施肥灌水前(2010年5月9日),在每个小区的0—20 cm、20—40 cm、40—60 cm、60—80 cm和80—100 cm处各取200 g土样,过2 mm筛后,在4℃下储藏备用。取土样12 g放入120 mL培养瓶中,加去离子水25 mL,瓶中加有磁力搅拌器,每次搅拌时间为30 s,停顿10 s,以使气液相平衡。用充气抽真空清洗系统(帅恩科技,北京)抽真空后,用He气充满,反复冲洗3次。最后培养瓶中的He气压约为1.5个大气压,然后在瓶塞上插入一个没有活塞的注射器,里面放有少量水,用来平衡瓶内气压。随后放在恒温18℃的水浴培养,由自动连续在线培养体系(Robot系统,挪威生命科学大学研发)自动进样[18],测量里面N2O,O2,CO2,NO和 N2等气体的变化。为了避免的不足,在培养至48 h时,每个培养瓶注入1 mL浓度为140 mmol/L的-N。为监测碳源对反硝化过程的影响,培养至184 h时,注入1 mL浓度为87 mmol/L的-N和145 mmol/L的葡萄糖。整个培养时间为330 h,在此期间Robot系统每8 h持续地记录 NO、N2O、O2和 N2浓度的变化情况。
1.3 样品采集和测定
1.3.1 气样的采集和测定 田间试验气体采样后,在24h内上气相色谱测量N2O浓度。该气谱采用装有微池电子捕获检测器(HP 6890 Miceo-ECD)的美国产Agilent 6890气相色谱仪,柱温为55℃,检测器温度330℃。载气为纯度99.999%的高纯氮气,流速25 mL/min。
室内培养试验的 N2O、O2、CO2、NO和 N2等气体的变化由Robot自动培养系统测定。自动培养系统包括自动进样模块和气体分析模块。自动进样模块包括顶空自动采样器(CTC GC-Pal)和双向旋转的蠕动泵(Gilson Minipuls 3)组成。气体分析模块由气相色谱仪(Agilent GC 7890A,美国)和氮氧化物分析仪(TAPI Model 200E)组成,其中气相色谱内安装有3个检测器(ECD、TCD、FID)和4根分离柱(填充柱和毛细柱各2根),能够分离和测定N2O(ECD)、N2(TCD)、O2(TCD)和 CO2(TCD)。
1.3.2 其他参数的测定 培养前后,用0.1 mol/L的KCl进行浸提,用连续流动分析仪(TRACCS2000,德国产)测定各层土壤样品中和的含量。采用碳、氮分析仪(vario MACRO CN)测定不同土层土壤中的有机碳和全氮含量。
1.4 数据处理
试验数据采用SPSS 11.5分析软件进行单因素方差分析,显著水平为P<0.05。
2 结果与分析
2.1 追肥后剖面原位N2O浓度的变化特征

图1 追肥后设施菜田土壤剖面50 cm处N2O的变化Fig.1 The N2O dynamics at 50 cm soil depth in the greenhouse vegetable cropping system after the side-dressing
追肥后设施菜田剖面N2O浓度的变化特征见图1和图2。由图1和2可见,每次灌溉追肥后,CN处理剖面原位50 cm处和90 cm处的N2O的浓度都会出现一个浓度峰值,且每次50 cm处的N2O浓度的峰值都高于90 cm处。CN处理剖面50 cm处的N2O 变化在 2.15 ~50.77 μL/L 之间,平均为 9.92 μL/L。相对于50 cm处,CN处理剖面90 cm处的N2O 浓度变化幅度较小,在 2.57 ~14.05 μL/L 之间,平均为5.64 μL/L。与CN处理相比,CK处理的剖面原位N2O浓度却几乎不受灌溉的影响,50 cm处和90 cm处的N2O浓度的变幅较小,在1.43~2.75 μL/L 之间。

图2 追肥后设施菜田土壤剖面90 cm处N2O的变化Fig.2 The N2O dynamics at 90 cm soil depth in the greenhouse vegetable cropping system after the side-dressing
2.2 不同土层N2O产生的潜势
从图3可以看出,不同土层产生N2O的潜势不同,在开始的48 h内,CK和CN处理0—20 cm土层产生的N2O的量均迅速增加,但CK处理产生的N2O排放峰值远低于CN处理。CK处理产生的N2O峰值为N2O 20.6 nmol/g土,而CN处理产生N2O量的峰值则高达 315.0 nmol/g土(图 3 a)。20—40 cm土层,从开始到添加葡萄糖前,CN处理的N2O产生量一直增加,但增加速度并没有0—20 cm土层快,而CK处理N2O的产生量变化却较小(图3 b)。在开始的48 h内,40—60 cm,60—80 cm和80—100 cm三个土层,CK和CN处理的N2O产生量都较小(图3 c,d,e),添加KNO3后,这三个土层的N2O的产生量并没有较大改变。
在184 h注入硝酸钾和葡萄糖后,CN处理的0—20 cm和20—40 cm土层土壤并没有产生N2O,甚至开始消耗N2O(图3 a,b),这与在反硝化活性较强的土壤中,增加碳源将促进N2O还原有关[21]。而40—60 cm,60—80 cm和80—100 cm的土壤两个处理却都开始产生N2O,并和CN处理20—40 cm土层土壤类似,在264 h左右出现一个小的排放峰值,与反硝化过程较强烈有关(图4)。
2.3 不同土层的反硝化潜势
从图4可以看出,不同土层土壤的反硝化潜势有很大差别。在培养开始的48 h内,CK和CN处理的0—20 cm土层土壤的反硝化产物不断的增加,其中CN处理高于CK处理的(图4 a)。其他各层CK和CN处理的反硝化产物均较少(图4 b,c,d,e)。在加入充足的后,两个处理的0—20 cm土层的反硝化产物仍然不断增加,且远高于其他各层。两个处理在20—40 cm土层的反硝化产物也有不断增加的趋势,但增加趋势相对0—20 cm土层较慢(图4 a,b)。在添加的条件下,40—60 cm,60—80 cm,80—100 cm的反硝化产物的量却几乎没有增加(图4 c,d,e),这说明土壤反硝化过程主要发生在0—20 cm和20—40 cm土层。184 h时,随着碳源葡萄糖的加入,CK和CN两个处理0—20 cm土层土壤的反硝化产物迅速地增加,其中CN处理增幅比CK大,产生的氮(N)从184 h的5045.4 nmol/g,增加到 264 h 的 28006.1 nmol/g,增加了近6倍。而其他各层的两个处理,在添加碳源后反硝化产物却没有立即迅速增加,而是经过约48 h的滞后期后,即在232 h时开始迅速的增加,直到达到稳定的N2浓度平台。
2.4不同土层土壤性状及培养前后-N和-N的变化
由表1结果看出,在0—20和20—40 cm土层土壤中,CN处理的有机碳和有机氮显著高于CK处理,40—60 cm,60—80 cm 和80—100 cm 的土层土壤中,CN和CK处理之间没有显著性差异。此外,在相同处理条件下,上层(0—40 cm)土壤的机碳和有机氮含量显著高于底层(60—100 cm)土壤。

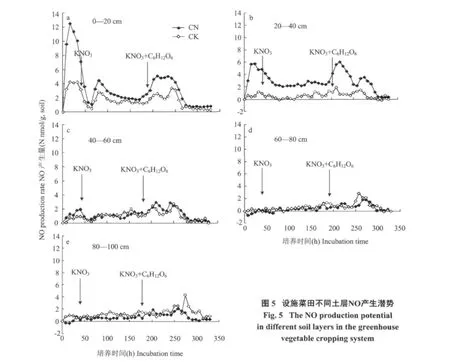
2.5 不同土层NO产生的潜势
反硝化过程中,土壤除了会产生N2O和N2等气体外,还会产生NO。从图5可以看出,在开始的16 h内,CK和CN处理0—20 cm土层产生NO的量都迅速增加,但CN处理产生的NO量远高于CK处理。CN处理产生的NO峰值为每克土产生12.6 nmol的NO,而CK处理产生的峰值则为每克土4.2 nmol的NO(图5 a)。在20—40 cm土层,从开始到添加葡萄糖前,CN处理的NO产生量一直增加,而CK处理的NO浓度却变化较小(图5 b)。从开始到添加KNO3,40—60 cm,60—80 cm和80—100 cm 三个土层,CK和CN处理的NO的产生量均较小(图5 c,d,e)。当加入碳源后,各土层都会出现一个短暂的NO的排放小峰,这与反硝化过程的强烈进行有关(图4)。
3 讨论
设施菜田土壤剖面N2O的浓度高出粮田的几十倍[23],这主要和设施菜田碳、氮和水的高投入有关。与传统的施肥处理相比,不施肥的对照处理土壤剖面N2O浓度较低,且几乎不受灌水的影响,说明碳、氮的投入为反硝化过程提供了底物,在此基础上,灌水会增加嫌气区域,促进反硝化过程的进行。但如果土壤中缺少底物碳和氮,即使在灌水厌氧条件下,反硝化过程进行的也相对较弱。
反硝化和N2O产生能力较强的均是上层(0—40 cm)土壤,而40—100 cm的底层土壤受碳源限制,反硝化较难进行,不太可能产生高浓度的N2O。田间检测到的底层土壤的高浓度N2O可能是来源于表层土壤N2O的扩散,本研究结果中,50 cm处N2O浓度远高于90 cm也支持了这一推测,说明通常的田间表层通量观测会低估N2O的排放量。而这些高浓度的N2O,最终是长期滞留在土壤底层还是会被上层土壤再次还原成N2,还需要进一步的研究。

与范晓晖和朱兆良对三种农田土壤的研究结果类似,设施菜田反硝化也主要发生在表层,因为表层的土壤有机碳较高,为反硝化微生物提供了能源[24]。底层土壤的微生物可利用的有机碳较少,反硝化活性一般较弱。但加入碳源后,其反硝化潜势在经过一个滞后时期后迅速增加,并达到与表层土壤产生的反硝化潜势相当的程度。这说明当有足够的碳源时,反硝化微生物活性会迅速增强。在田间条件下,有机碳和硝酸盐的向下移动,可能会促进底层土壤反硝化的进行,但目前人们通常取表土来定量反硝化损失[25-26]。在大田条件下,由于有机肥施用量较低,灌水次数较少,下层土壤的反硝化损失或许可以忽略。然而在设施菜田中,化肥和有机肥的大量投入以及频繁的灌水[27-28],将为底层土壤提供一定的碳源和硝酸盐,对反硝化有促进作用。不考虑这部分土壤的反硝化损失,有可能低估氮素气态损失量。
综上所述,在田间条件下,虽然设施菜田土壤反硝化过程主要发生在表层,但是施肥和灌溉后,N2O有向剖面下部迁移的趋势,田间的通量观测有可能低估N2O的产生量。同时,底层土壤也有一定的反硝化潜势,在定量研究土壤氮素的反硝化损失时,应当予以考虑。
表1不同土层土壤的性状及培养前后-N和-N的变化Table 1 Soil characteristics,measured N -species at the start and end of the incubation in different soil layers

表1不同土层土壤的性状及培养前后-N和-N的变化Table 1 Soil characteristics,measured N -species at the start and end of the incubation in different soil layers
注(Note):*表示相同土层CK和CN处理之间的差异显著(P<0.05)Significant difference for CK and CN treatments in the same soil layers(P<0.05);不同字母表示相同施肥处理不同土层差异显著(P<0.05)The different letters in the same treatment mean significant difference for different soil layers(P <0.05).
处理Treatment土层Layer(cm)有机碳Organic C(g/kg)有机氮Organic N(g/kg)培养前Start NH+4-N(mg/kg)培养前Start NO-3-N(mg/kg)培养后End NH+4-N(mg/kg)培养后End NO-3-N(mg/kg)CK 0—20 8.9 ±0.5 a 1.2 ±0.0 a 6.1 ±0.3 a 22.3 ±1.3 a 31.9±3.1 a 0.7 ±0.4 a 20—40 4.3 ±0.2 b 0.6 ±0.0 b 2.5 ±0.5 c 4.2 ±1.5 b 30.7 ±2.3 a 0.9 ±1.0 a 40—60 3.7 ±0.4 bc 0.6 ±0.0 b 5.8 ±0.3 a 6.0 ±3.0 b 27.0 ±0.7 a 1.0 ±0.8 a 60—80 2.9 ±0.2 cd 0.4 ±0.0 cd 5.3 ±1.2 ab 6.3 ±0.7 b 9.6 ±3.1 b 1.5 ±0.7 a 80—100 2.2 ±0.3 d 0.4 ±0.0 d 3.4 ±0.5 bc 5.2 ±1.5 b 12.0 ±2.5 b 0.9 ±0.6 a CN 0—20 12.2 ±0.3*a 1.7 ±0.1*a 5.7 ±0.9 a 107.0 ±15.5*a 44.0 ±2.8 a 1.0 ±0.7 a 20—40 6.3 ±1.1*b 0.9 ±0.1*bc 2.7 ±0.7 b 47.2 ±7.4*b 31.6 ±12.2 ab 0.9 ±0.7 a 40—60 4.9 ±0.5 bcd 0.7 ±0.1 cd 5.0 ±0.9 a 36.5 ±4.2*b 31.2 ±2.5 ab 0.8 ±0.7 a 60—80 3.5 ±0.3 cd 0.5 ±0.0 d 4.7 ±1.2 a 31.5 ±5.5*b 25.5 ±0.2*bc 0.7 ±0.2 a 80—100 2.9 ±1.1 d 0.5 ±0.1 d 4.1 ±0.3 a 36.3 ±3.8*b 13.3 ±3.5 c 0.4 ±0.6 a
[1] Ryden J C,Lund L J.Nature and extent of directly measured denitrification losses from some irrigated vegetable crop production units[J].Soil Sci.Soc.Am.J.,1980,44:505-511.
[2] Cicerone R.Changes in stratospheric ozone[J].Science,1987,237:35-41.
[3] Logan J A.Nitrogen oxides in the troposphere:global and regional budgets[J].J.Geophys.Res.,1983,88:10785-10807.
[4] Bouwman A F.Exchange of greenhouse gases between terrestrial ecosystems and the atmosphere[A].Bouwman A F(ed).Soils and the greenhouse effect[C].New York,USA:Wiley,1990.61-127.
[5] Luo J,Tillman R W,Ball P R.Factors regulating denitrification in a soil under pasture[J].Soil Biol.Biochem.,1999,31:913-927.
[6] Philippot L, Hallin S, Schloter M.Ecology of denitrifying prokaryotes in agricultural soil[J].Adv.Agron.,2007,96:249-305.
[7] Grundmann G,Rolston G E.A water function approximation to degree of anaerobiosis associated with denitrification[J].Soil Sci.,1987,144:437-441.
[8] Knowles R,Denitrification[J].Microbiol.Rev.,1982,46:43-70.
[9] Mulvaney R L,Khan S A,Mulvaney C S.Nitrogen fertilizers promote denitrification[J].Biol.Fert.Soils.,1997,24:211-220.
[10] Valé M,Mary B,Justes E.Irrigation practices may affect denitrification more than nitrogen mineralization in warm climatic conditions[J].Biol.Fert.Soils.,2007,43:641-651.
[11] 张真和.我国蔬菜产业发展中的问题与对策[J].中国农业科技导报,2001,3(4):57-60.
Zhang Z H.Problems and countermeasures concerning the development of vegetable production in China[J].J.Agric.Sci.Technol.,2001,3(4):57-60.
[12] 张真和,陈青云,高丽红,等.我国设施蔬菜产业发展对策研究(上)[J].蔬菜,2010,(5):1-4.
Zhang Z H,Chen Q Y,Gao L Het al.Countermeasures concerning the development of vegetable production in China[J].Vegetables,2010,(5):1-4.
[13] Zhu J H,Li X L,Christie Pet al.Environmental implications of low nitrogen use efficiency in excessively fertilized hot pepper(Capsicum frutescensL.)cropping systems[J].Agric.Ecosyst.Environ.,2005,111:70-80.
[14] 郭全忠.安康市设施蔬菜施肥现状及土壤养分累积特性研究[J].安徽农业科学,2007,35(20):6194-6195.
Guo Q Z.Study on fertilizer application status and soil nutrient accumulation of greenhouse vegetable in Ankang City[J].J.Anhui Agric.Sci.,2007,35(20):6194-6195.
[15] 曾希柏,白玲玉,李莲芳,等.山东寿光不同利用方式下农田土壤有机质和氮磷钾状况及其变化[J].生态学报,2009,29(7):3737-3746.
Zeng X B,Bai X L,Li L Fet al.The status and changes of organic matter, nitrogen, phosphorusand potassium under different soil using styles of Shouguang of Shangdong Province[J].Acta Ecol.Sin.,2009,29(7):3737-3746.
[16] Meleroa S,Pérez-de-Morab A,Murillo J Met al.Denitrification in a vertisol under long-term tillage and no-tillage management in dryland agricultural systems:key genes and potential rates[J].Appl.Soil Ecol.,2011,47(3):221-225.
[17] Loubet B,Laville P,Lehuger Set al.Carbon,nitrogen and greenhouse gases budgets over a four years crop rotation in northern France[J].Plant Soil,2011,343:109-137.
[18] Molstad L,Dörsch P,Bakken L R.Robotized incubation system for monitoring gases(O2,NO,N2O,N2)in denitrifying cultures[J].J.Microbiol.Meth.,2007,71:202-211.
[19] Ren T,Christie P,Wang J Get al.Root zone soil nitrogen management to maintain high tomatoyields and minimum nitrogen losses to the environment[J].Sci.Hotric-amsterdam.,2010,125:22-33.
[20] Kammann C,Grünhage L,Jäger H J.A new sampling technique to monitor concentrations of CH4,N2O and CO2in air at welldefined depths in soils with varied water potential[J].Eur.J.Soil Sci.,2001,52:297-303.
[21] Morley N,Baggs E M.Carbon and oxygen controls on N2O and N2production during nitrate reduction[J].Soil Biol.Biochem.,2010,42:1864-1871.
[22] Baggs E M.A review of stable isotope techniques for N2O source partitioning in soils:recent progress,remaining challenges and future considerations[J].Rapid Commun.Mass Spectrom.,2008,22:1664-1672.
[23] 梁东丽,同延安,Emterdy O,等.黄土性土壤剖面中N2O排放的研究初报[J].土壤学报,2002,139(16):802-809.
Liang D L,Tong Y D,Emterdy Oet al.In-situ measurement of N2O emissions from profile of loess soil[J].Acta Pedol.Sin.,2002,139(16):802-809.
[24] 范晓晖,朱兆良.农田土壤剖面反硝化活性及其影响因素的研究[J].植物营养与肥料学报,1997,3(2):97-103.
Fan X H,Zhu Z L.Investigations on denitrification potential in agricultural soil as related with affected factors[J].Plant Nutr.Fert.Sci.,1997,3(2):97-103.
[25] Menneer J C,Ledgard S,McLayc Cet al.Animal treading stimulates denitrification in soil under pasture[J].Soil Biol.Biochem.,2005,37:1625-1629.
[26] Cao B,He F Y,Xu Q Met al.Denitrification losses and N2O emissions from nitrogen fertilizer applied to a vegetable field[J].Pedosphere,2006,16(3):390-397.
[27] He F F,Chen Q,Jiang R Fet al.Yield and nitrogen balance of greenhouse tomato (LycopersicumesculentumMill.) with conventional and site-specific nitrogen management in Northern China[J].Nutr.Cycl.Agroecosys.,2007,77:1-14.
[28] He F F,Jiang R F,Chen Qet al.Nitrous oxide emissions from an intensively managed greenhouse vegetable cropping system in Northern China[J].Environ.Poll.,2009,157:1666-1672.
