长叶点地梅愈伤组织诱导和植株再生
2012-08-20张彦妮陈素波
张彦妮,陈素波
(东北林业大学园林学院,黑龙江 哈尔滨150040)
长叶点地梅(Androsace longifolia)又称矮葶点地梅,为报春花科点地梅属多年生草本,叶丛生,线性,灰绿色,花冠白色,喉部紫红色,5月开花[1]。点地梅属约有100种,分布于北半球温带,其中青藏高原地区和欧洲的阿尔卑斯山脉是该属的两个分布中心。中国有73种,7变种,主要分布在青藏高原,有部分种类分布在西北至内蒙古、东北以及秦岭以南各省区。长叶点地梅的植株较矮小,单朵花虽小,但花色清新,开花较早,具有很高的观赏价值。长叶点地梅的叶呈丛生状,铺地,适应性较强,能够在中国东北、内蒙古、蒙古高原[2],草原、半干旱石质山地的油松-沙棘混交林林下[3],多石质山坡生长,可用于岩石园、园林地被及盆栽观赏及灌木丛旁作地被材料。长叶点地梅还具有一定的生态效益,可以降低地表湿度、减少尘土飞扬和防止水土流失,因而它又是一种不可多得的草坪植物和优良的地被植物,对丰富东北地区景观植物多样性、推动园林事业以及绿地建设具有一定的实用价值。同时,野生花卉是构成多样化的生态环境和自然植被的重要组成部分,也是研究和培育花卉新品种的重要种源和进行园林绿化的优秀材料[4]。
长叶点地梅虽有诸多优势,但目前园林应用极少,同时随着生存环境的恶化,其生存状况不断受到威胁,资源受到破坏。快繁技术是保护野生花卉种质资源的有效途径之一,但点地梅属植物组织培养方面的研究迄今还是很少。聂勇[5]对点地梅叶片进行了愈伤组织的诱导,李承花等[6]采用层析法对点地梅的化学成分进行分离纯化,秦向菁[7]对点地梅进行了药理分析试验认为点地梅在抗肿瘤方面具有一定作用。而对于野生花卉长叶点地梅的相关研究却鲜见报道,因此本试验对长叶点地梅进行愈伤组织诱导和再生体系的建立,以期为长叶点地梅种质资源的保护、园林应用和培育新品种等奠定基础。
1 材料与方法
1.1 材料 本试验的研究材料为长叶点地梅无菌实生苗。
1.2 方法
1.2.1 不同培养基对长叶点地梅下胚轴愈伤诱导的影响 将培养皿中萌发的长叶点地梅转接于添加不同激素6-BA(0、0.1、0.3mg·L-1)、NAA(0、0.1 mg·L-1)的MS培养基中,每组20株,观察生长状况,30d后统计生长状况及诱导率。
1.2.2 愈伤组织的诱导及增殖 试验中长叶点地梅的愈伤组织有两种来源:一种是由叶片诱导而来;另一种是由萌发苗下胚轴基部产生。将叶片切为0.5 cm左右的小块,接到添加不同种类、不同浓度的TDZ(0.1、0.2、0.3mg·L-1)、NAA(0.01、0.02、0.03mg·L-1)的MS培养基中,进行愈伤组织诱导,之后选择最佳培养基进行愈伤继代增殖。将两种不同的愈伤组织继代两次(每次周期为30d),下胚轴产生愈伤后,将愈伤组织与苗分离后再进行继代增殖,之后进行愈伤组织的分化。30d后统计分化外植体数、诱导率和形态指标。
1.2.3 愈伤组织的分化与植株再生 将继代后的愈伤组织转接到添加不同激素的6-BA(0.5、1.0、2.0 mg·L-1)、NAA(0.1、0.2、0.4mg·L-1)分化培养基中,待分化出芽后,将芽接入芽伸长培养基中,芽伸长培养基为 MS+0.1mg·L-16-BA+0.2 mg·L-1KT。30d后统计愈伤分化数、分化率和平均分化芽数。
1.2.4 组培苗的生根及移栽 参照葛蓓孛[8]的移栽法,将幼苗在生根培养基中进行生根培养。生根培养基为添加不同浓度IBA(0.5、1.0、2.0mg·L-1)的MS和1/2MS培养基中,两种培养基均加入1 g·L-1的活性炭,每组20株苗,待根长为3~4cm时,将小苗移出组培室,在温室中不打开封口膜放置4~5d,让组培苗适应温度的变化,然后半开封口膜缓苗3d,再将小苗取出,用自来水冲洗掉附着在根上的培养基,将苗移栽于基质中(基质为已灭菌的蛭石),30d后统计平均苗根数、平均根长、生根率、成活率及生长状况。本试验无特殊说明外,均为MS培养基,pH 值为5.8,高压灭菌(1.1MPa,121 ℃)15min。
1.2.5 数据统计

2 结果与分析
2.1 不同培养基对长叶点地梅下胚轴愈伤诱导的影响 植株在不同培养基上的生长状况不同。在不加激素的培养基中植株叶片发黄,长势一般,植株下胚轴基部无愈伤组织产生,但有极少量根发生,而在添加不同浓度6-BA的培养基中,植株叶片呈绿色或黄绿色,植株下胚轴基部有愈伤产生;只添加NAA的植株也有少量根产生,无愈伤产生,说明NAA有利于无菌苗根的发生。其中产生大量愈伤、长势好的培养基为 MS+0.3mg·L-16-BA+0.1mg·L-1NAA,诱导率达85%(表1)。本试验获得的植株下胚轴基部的愈伤组织可作为愈伤诱导芽的材料。
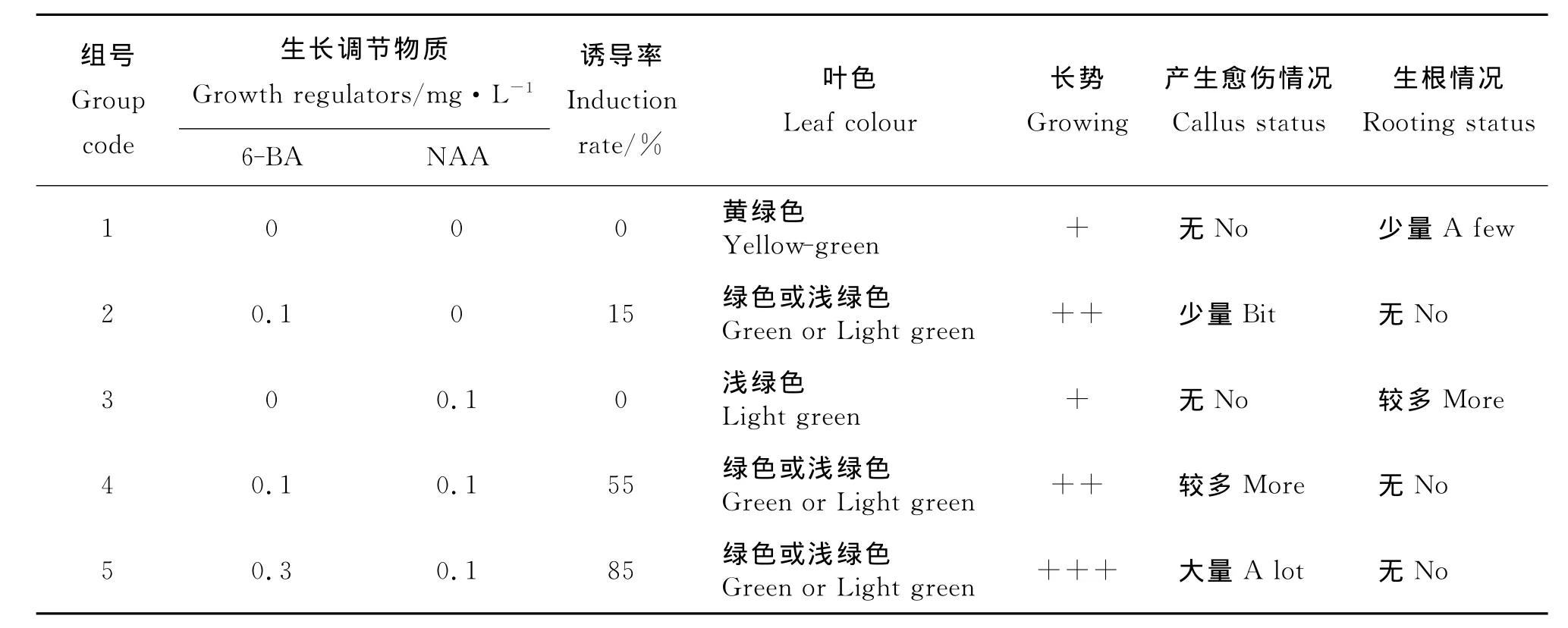
表1 不同培养基对长叶点地梅下胚轴愈伤诱导的影响Table 1 Effects of various mediums on hypocotyl callus induction
2.2 叶片愈伤组织的诱导及继代 不同浓度TDZ和NAA组合对长叶点地梅叶片愈伤组织诱导的影响显著(表2)。无激素的MS培养基不能诱导叶片愈伤组织,在添加不同浓度NAA和TDZ组合的培养基中诱导叶片愈伤组织大部分呈绿色,结构紧实的愈伤长势一般,结构疏松的愈伤长势相对较好。当NAA浓度为0.02mg·L-1、TDZ浓度为0.3mg·L-1时,愈伤启动期为12d,愈伤颜色为淡绿色,结构疏松,长势好,诱导率达80%;所以诱导叶片愈伤的最佳NAA和TDZ组合为0.02 mg·L-1NAA +0.3mg·L-1TDZ。
2.3 愈伤组织诱导再生芽 以两种来源不同的愈伤组织诱导芽分化,结果表明(表3),苗基部愈伤组织的分化率明显大于由叶片诱导的愈伤。当6-BA浓 度 为 1.0mg·L-1、NAA 浓 度 为 0.2 mg·L-1时,叶片愈伤的分化效果最好,分化率为82.5%,平均分化芽数为4.3。当6-BA浓度为0.5 mg·L-1、NAA浓度为0.2mg·L-1时,苗基部愈伤的分化效果最好,分化率为92.5%,平均分化芽数为6.1。来自下胚轴的愈伤组织的平均分化芽数高于叶片愈伤平均分化芽数,主要是由于下胚轴的胚性愈伤形成率高于叶片的胚性愈伤形成率。因此,苗下胚轴基部愈伤为诱导芽的最佳愈伤,最佳激素比为0.5mg·L-16-BA+0.2mg·L-1NAA。
2.4 组培苗的生根及移栽 将在芽伸长培养基上生长为3~4cm的无菌苗转接到生根培养基中,进行生根诱导。在生根试验中发现(表4),添加不同浓度IBA的MS和1/2MS两种培养基,前者的生根率均达到100%,移栽后的成活率及状况相对最好;前者的平均苗根数最多为7.3,平均根长最长为2.7,成活率达95%,移栽后植株长生新叶较多,后者的平均苗根数最多为4.9,平均根长最长为1.8,成活率达89.5%,移栽后产生的新叶相对较少。因此,组培苗的最佳生根培养基为 MS+1.0mg·L-1IBA。
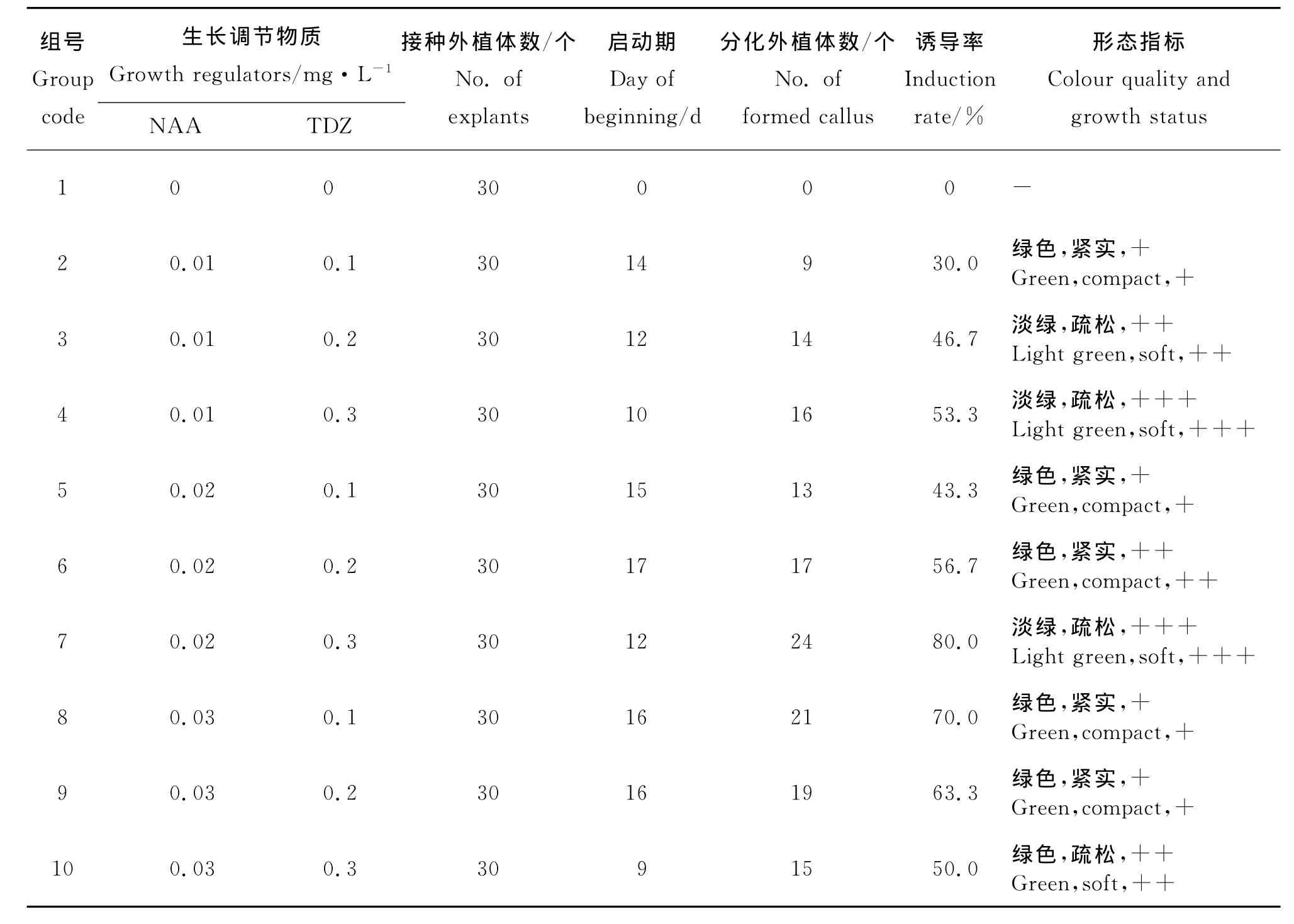
表2 不同浓度TDZ和NAA组合对长叶点地梅叶片愈伤组织诱导的影响Table 2 Effects of different combinations of TDZ and NAA on callus induction from leaf

表3 不同浓度6-BA和NAA组合对愈伤诱导芽的影响Table 3 Effects of different combinations of 6-BA and NAA on bud induction
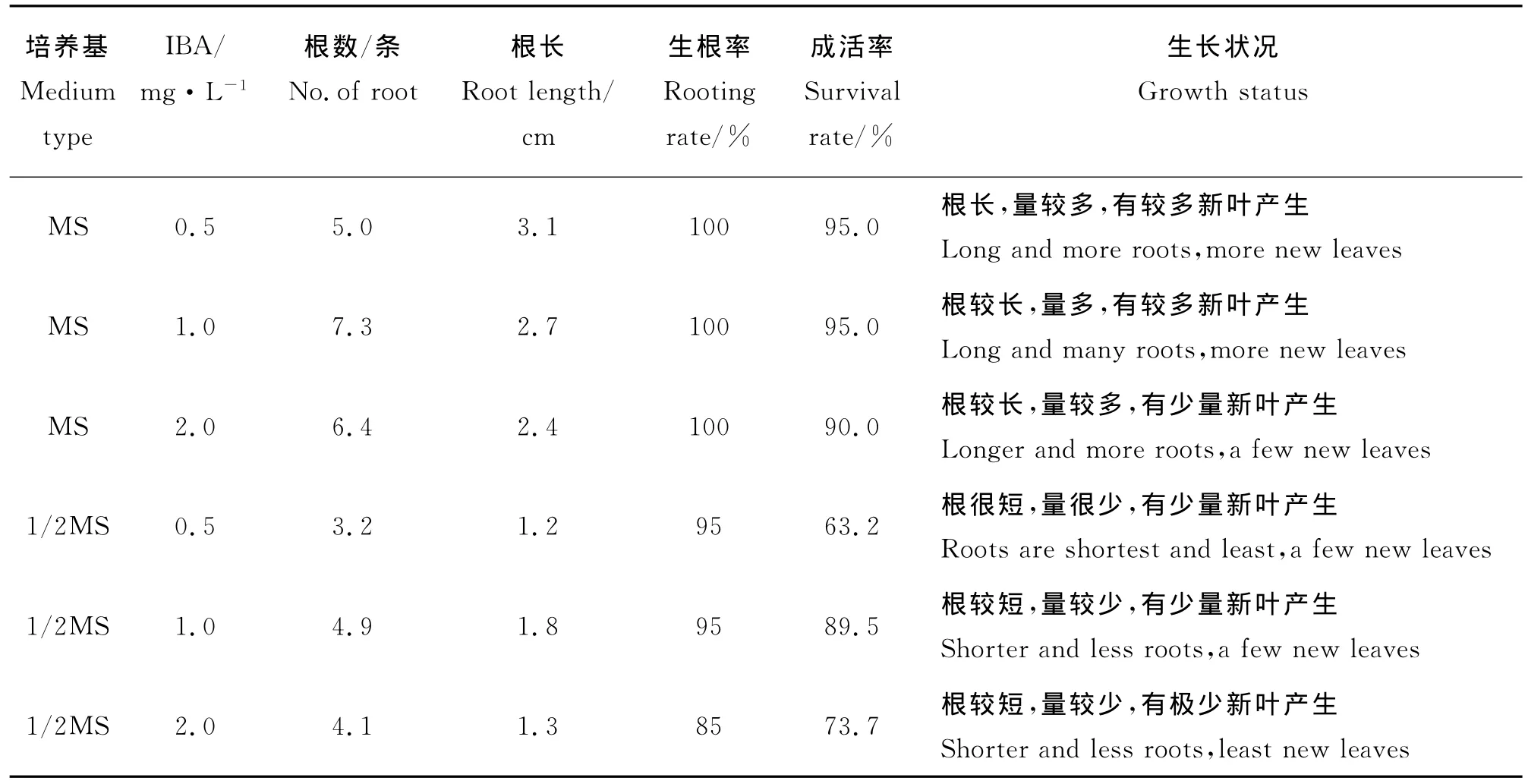
表4 组培苗的生根及成活状况Table 4 Status of plant rooting and survival

图1 叶片愈伤的诱导(A)、增殖(B)、分化(C),下胚轴愈伤的诱导(D)、分化(E)、增殖(F)和组培苗的生根(G)及移栽(H)Fig.1 Callus induced from leaves(A),multiplication of callus(B)and differentiation(C),callus induced from hypocotyl(D),multiplication of hypocotyl callus(E)and differentiation(F),rooting(G)and transplanting(H)
3 讨论与结论
本研究以长叶点地梅的实生苗及其叶片来诱导愈伤组织,初步建立植株再生体系,实现长叶点地梅的快繁(图1)。不同植物激素对幼苗的生长影响不同,只添加NAA的植株19d后下胚轴周围少膨大,变褐色,25d后有少量根产生,说明NAA有利于无菌苗根的发生,但不能诱导其产生愈伤组织。当6-BA与NAA共同作用时,无根发生,植株下胚轴基部均出现愈伤组织,说明6-BA能够促进愈伤的形成,其中发生愈伤效果最佳的培养基为 MS+0.3 mg·L-16-BA+0.1mg·L-1NAA。
目前,TDZ在愈伤组织诱导[9-12]、体胚细胞发生[13]、丛生芽诱导[14-15]、内源激素水平[16]等方面都有所应用。本研究在叶片诱导愈伤的过程中,高浓度的TDZ和NAA都会在一定程度上抑制愈伤组织的发生,在培养基 MS+0.02mg·L-1NAA和0.3mg·L-1TDZ上诱导出的愈伤淡绿疏松、长势好,因此,为叶片诱导愈伤的最佳培养基。在愈伤组织分化试验中,植株下胚轴基部产生的愈伤其分化能力优于叶片愈伤,在最佳培养基 MS+0.5 mg·L-16-BA+0.2mg·L-1NAA 上,愈伤分化率最高,达92.5%,平均分化芽个数最高达6.1。有的植物的不同部位产生的愈伤,其分化能力也会有一定的差别,如莴苣(Lactuca sativa)子叶和真叶诱导产生的愈伤组织和再生苗频率与下胚轴相比会相对较低[17]。通过下胚轴基部的愈伤建立植株再生体系已经在豆科牧草沙打旺(Astragalus adsurgens)等植物中研究应用[18-19],是建立再生体系的有效途径。在诱导生根的试验中发现,MS培养基更有利于植株的生根成活,IBA浓度过高或过低都会影响植株的根数、根长及移栽苗的成活率,当IBA浓度为1.0mg·L-1IBA时,植株的根较长,量多,有较多新叶产生,为最佳生根培养基。
本试验以长叶点地梅种子为外植体,通过叶片愈伤及下胚轴愈伤诱导芽,并进行生根培养,从而建立起完整的再生体系,为以后的组培快繁等相关研究奠定基础。
[1] 柳参奎.中国东北盐碱地植物原色图鉴[M].哈尔滨:东北林业大学出版社,2006:123.
[2] 岳秀贤.蒙古高原种子植物区系研究[D].呼和浩特:内蒙古农业大学,2011:153-154.
[3] 李杰.半干旱石质山地不同造林模式适应性研究[D].呼和浩特:内蒙古农业大学,2010:24-25.
[4] 周涛,朴永吉,林元雪.中国野生花卉资源的研究现状及展望[J].世界林业研究,2004,17(4):45-48.
[5] 聂勇.2,4-D和6-BA 对点地梅愈伤组织诱导的影响[J].阿坝师范高等专科学校学报,2006,23(4):126-128.
[6] 李承花,殷志琦,黄晓君,等.点地梅的化学成分[J].中国天然药物,2008,6(2):123-125.
[7] 秦向菁.抗乙型肝炎病毒藏药及活性部位的研究[D].北京:军事医学科学院放射医学研究所,2004:16-28.
[8] 葛蓓孛.细叶百合组织培养及多倍体诱导研究[D].哈尔滨:东北林业大学,2010:9-17.
[9] Van Le B,Nhut D T,Van K T T.Plant production via shoot regeneration from thin cell layer pseudo-bulblet explants of Lilium longiflorum in vitro[J].Plant biology and Pathology,1999,322:303-310.
[10] Loretta B,Patrizio C R,Claudia B,et al.Adventitious shoot regeneration from leaf explants and stem nodes of Lilium[J].Plant Cell,Tissue and Organ Culture,2003,74:37-44.
[11] 姜新超.百合悬浮细胞体系的建立及植株再生[D].北京:中国农业科学院,2010:3-31.
[12] 蒋晶,窦美安,孙伟生.菠萝花药愈伤组织诱导及褐变影响因素[J].中国农学通报,2010,26(11):366-369.
[13] Sheibani M,Nemati S H,Davarinejad G H,et al.Induction of somatic embryogenesis in saffron using thidiazuron(TDZ)[J].Pakistan Journal of Biological Sciences,2007,739:259-267.
[14] 高翔,罗鸿源.芸苔丛生芽诱导和快速繁殖[J].植物生理学通讯,1995,31(6):429-435.
[15] 顾地周,高捍东,冯颖,等.不同激素对黄檗腋芽丛生芽苗诱导及种质试管保存的影响[J].中国农学通报,2010,26(9):255-258.
[16] 马光,郭继平.TDZ和6-BA对芜菁离体再生过程中内源激素水平的不同影响[J].浙江大学学报(农业与生命科学版),2010,36(3):237-245.
[17] 高辉,苟晓松,邓运涛,等.莴苣‘红帆’品种下胚轴愈伤组织诱导与植株再生[J].园艺学报,2002,29(5):486-488.
[18] Luo J P,Jia J F.Callus induction and plant regeneration from hypocotyl explants of the forage legume Astragalus adsurgens[J].Plant Cell Reports,1998,17:567-570 .
[19] Shang A Q,Cai H,Yan X J,et al.Plant regeneration fromin vitro cultured of hypocotyl explants of Euonymus japonicus Cu zhi[J].Agricultural Sciences in China,2006,5(3):196-201.
