低温保护剂和降温速率对猪关节软骨压缩杨氏模量的影响
2012-08-13吕娅胥义孙慧君王丽萍
吕娅 胥义 孙慧君 王丽萍
(上海理工大学生物系统热科学研究所,上海 200093)
引言
关节软骨能为关节活动提供低摩擦、低磨损和吸收力学冲击等重要功能。由于关节软骨没有血管、神经和淋巴管提供营养,自身修复能力很差,所以一旦损伤后,常常引发各种关节疾病,严重影响着人们的生活质量[1]。软骨移植是修复关节软骨损伤的一种非常可靠的治疗手段,而有限的关节软骨供体来源及其保存问题,一直是制约关节软骨移植手术得以推广的主要原因。近年来,国内外许多学者都在探索关节软骨的低温保存技术[2-7],期望能建立关节软骨低温保存组织库,为临床应用提供丰富的材料来源,同时也便于医生有足够的时间,进行术前更准确的尺寸和形状匹配以及充分的病毒学和细菌学检测等工作[8]。但 Muldrew等的研究发现,低温冷冻软骨移植后出现了软骨组织纤维化、软骨基质断裂以及机械力学性能显著降低[9-11]。程杰平等也发现,病变的关节软骨的各项力学性质指标均明显低于正常组的相关指标[12]。Jomha曾将用于羊关节软骨上还算比较成功的低温保存方案应用于人关节软骨的保存,发现效果并不理想[13]。
由此看来,尽管人们针对关节软骨进行了大量的深入研究,但从临床应用的角度来讲,人类关节软骨的低温保存技术远未成熟,低温保存过程中的诸多损伤机理还有待进一步探索和研究。从现有的文献调研来看,有关关节软骨低温保存过程中的生物力学性能变化的研究还很少,其生物力学性能的低温损伤机理至今不明确,也是目前关节软骨组织尚未完全成功保存的重要原因之一。
为此,笔者采用动态热机械分析法(DMA),系统地研究了低温保护剂种类、浓度以及降温速率等对冷冻关节软骨杨氏模量的影响,有助于深入认识关节软骨低温保存过程中的生物力学性能损伤机理。
1 实验设备与方法
1.1 实验设备
1.1.1 动态热机械分析仪(DMA)
实验采用的动态热机械分析仪为DMA-Q800(TA,美国)。根据试验需要,采用静态压缩模式,预载荷为0.01 N,在37℃恒温的环境下,将经过预处理后的关节软骨样品以2 N/min的速率加载至17 N即停止测试。得出应力应变曲线后,由 DMA自动处理数据得到杨氏模量。
1.1.2 程序降温装置
实验采用的程序降温装置为自制程序降温仪,其工作原理是利用液氮容器中液氮蒸汽的纵向温度梯度,用微机控制微电机的转向和转速,再通过牵引绳来调节样品在液氮蒸汽中的位置,使样品处于程序所设置的温度(-196℃)。本研究模拟慢速降温和快速降温,以1℃/min和20℃/min两种降温速率从室温降至-196℃,并恒温10 min。
1.2 实验方法
选取上海本地成年猪,取整根有两瓣半月板覆盖的白色软骨的猪大骨。用手术剪将半月板剪去,并用专用工具(冲头)制备直径为5 mm的软骨测试样品。用格林氏液将样品表面的滑液冲洗掉,再分别置于体积浓度为10%、30%、60%和80%的二甲基亚砜(DMSO)(分析纯,上海国药集团化学试剂有限公司)、甘油(分析纯,上海国药集团化学试剂有限公司)以及1,2丙二醇(分析纯,上海国药集团化学试剂有限公司,以下简称“丙二醇”)中进行2.5 h的充分渗透,即用低温保护剂将软骨内的水分充分置换。经低温保护剂充分渗透后的样品用程序降温仪以1℃/min和20℃/min两种不同的降温速率降温至-196℃,恒温10 min后,将 -196℃的样品快速置于37℃恒温水浴箱中,快速复温5 min。
将以上方法处理好的样品分为两部分,一部分直接用于DMA仪器测量,在降温速率相同的条件下,分析低温保护剂的种类和浓度对关节软骨杨氏模量的影响,此方法称为方法1;另一部分用pH值为7.4的 PBS,将样品中的低温保护剂洗脱,再用DMA仪器测量样品的杨氏模量,此方法称为方法2。洗脱是为了排除低温保护剂的干扰,研究降温速率对关节软骨杨氏模量的影响。为了确保实验数据的有效性,每一种实验条件做3个平行样。
2 实验结果与分析
2.1 低温保护剂种类及浓度对杨氏模量的影响
如图1所示,降温速率为20℃/min时用方法1处理过的样品的杨氏模量。从图中可以明显看出两个特点:一是在相同的浓度下,DMSO的杨氏模量大于甘油的杨氏模量、大于丙二醇的杨氏模量;二是3种低温保护剂均随其浓度的增加,杨氏模量也增加。
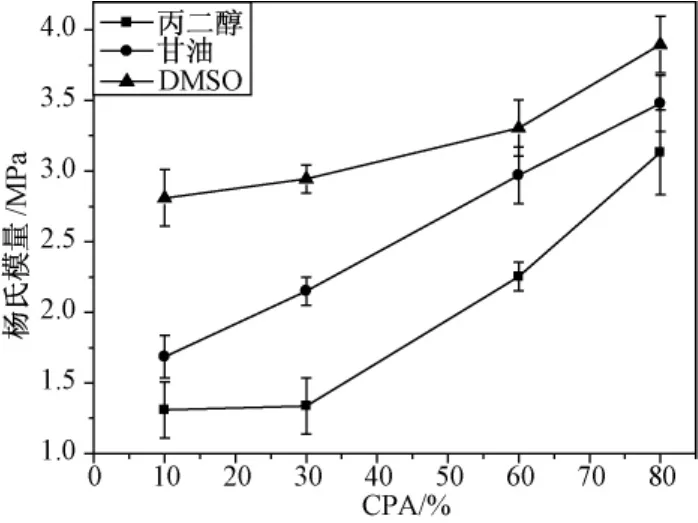
图1 低温保护剂种类及浓度对杨氏模量的影响Fig.1 Effects of CPA on Young's modulus
在3种低温保护剂中,DMSO属于甲基化合物,而甘油和丙二醇属于羟基化合物。不同类型的低温保护剂,其保护机理不同。低温保护剂之所以能够抑制冰晶的形成与生长,有两个原因:一个是溶液中的低温保护剂代替了本该参与相变的水,另一个是由于低温保护剂分子与水分子之间的相互作用,使其中一部分水成为不冻水或称结合水。目前,关于低温保护剂保护机理的探讨性文章很多,如文献[14-17]。在寻求新的低温保护剂时,其结合水的能力是首先要考察的重要参数。甲基化合物,一般认为是官能团甲基(—CH3)改变了水分子之间原有的相互作用关系,形成了结合水,而自身之间是没有相互作用的,故而随浓度的增加,溶液中结合水的含量呈线性上升。而羟基化合物,一般认为是官能团羟基(—OH)的大部分与水键合,形成结合水,但还有一小部分羟基可以自身键合,降低了与水键合的机会。因此,甲基或者羟基的含量直接影响着低温保护剂可以形成的结合水能力[18]。
如图2所示,DMSO有2个甲基,甘油有3个羟基,丙二醇有2个羟基和1个甲基。胥义等研究发现,高浓度DMSO的未冻水份额比低浓度DMSO的未冻水份额高[19-20]。随着低温保护剂浓度的增加,溶液中的甲基或羟基的个数也增加,结合水也越多,加之低温保护剂也代替了降温时可以产生相变的水的份额,所以当关节软骨加载时,只有较少的自由水从组织内部流出,即关节软骨产生较小的变形,导致杨氏模量变大。从图1中可以看到,在3种低温保护剂中,杨氏模量都随低温保护剂浓度的增加而增大。
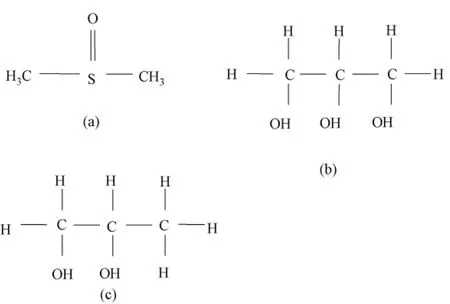
图2 3种低温保护剂的分子式。(a)DMSO;(b)甘油;(c)1-2丙二醇Fig.2 Formula of the three CPA .(a)DMSO;(b)Glycerin;(c)Propylene glycol 1-2
虽然甲基和羟基都可以影响结合水含量,但这两种水溶液中有关结合水含量的数据却比较缺乏。从图1中可以看出,在相同浓度下,DMSO的杨氏模量最高,即DMSO的结合水能力最好,然后依次为甘油、丙二醇。Hey等用DMSO和丙三醇进行了多组对照实验[21],发现45%DMSO和50%甘油在玻璃化转变和反玻璃化趋势方面有很多共性,这说明在相同的浓度下,DMSO的结合水能力可能比甘油的结合水能力要强。文献[16,22]认为,甲基与甲基之间没有相互作用,只与水键合,而羟基除了与水键合外,自身也有键合,从而降低了结合水含量。所以,在相同浓度下,DMSO的杨氏模量会明显大于甘油的杨氏模量,可能是因为DMSO含有2个甲基,而甘油含有3个羟基。这3个羟基除了和水键合之外自身也有键合,降低了结合水含量,导致杨氏模量随之下降。丙二醇与甘油相比,除了有两个羟基之外还有一个甲基,因此不能笼统地以比较羟基的数量来决定两者中哪种低温保护剂的结合水能力更强。有可能是甘油代替的自由水份额比丙二醇代替的自由水份额要高,导致甘油溶液中的自由水低于丙二醇,即在相同浓度下甘油的杨氏模量大于丙二醇的杨氏模量。
以上研究均在未洗脱低温保护剂的条件下进行,而临床应用时,需要将低温保护剂洗脱才符合移植的最基本条件。下面将进一步讨论用PBS洗脱关节软骨中低温保护剂前后的杨氏模量变化。
2.2 洗脱低温保护剂后关节软骨的杨氏模量
在降温速率为20℃/min时,用方法1和方法2处理过的样品杨氏模量进行对比,如图3所示。从图3中可以明显看出,含有低温保护剂和低温保护剂被洗脱后样品的杨氏模量相差非常大。另外,还注意到,添加了80%DMSO样品的杨氏模量高于新鲜关节软骨将近52%。
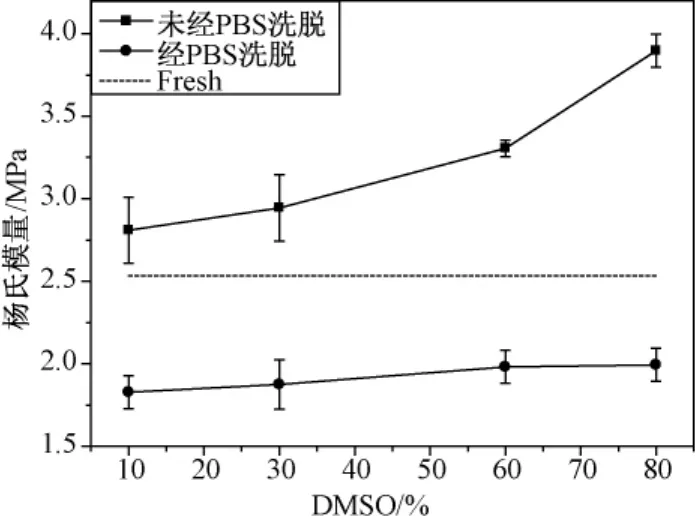
图3 DMSO经PBS洗脱前后关节软骨的杨氏模量Fig.3 Young's modulus of articular cartilage before and after DMSO being eluted by PBS
在经过PBS的冲洗置换出软骨组织内DMSO后,关节软骨的杨氏模量与新鲜关节软骨的杨氏模量相比有不同程度的降低,即降温对力学特性的损伤程度不同。经 PBS洗脱的这些样品中,经30%DMSO处理与经10%DMSO处理的杨氏模量虽然都比新鲜关节软骨的要低,但经30%DMSO处理过的样品杨氏模量要高于经10%DMSO处理的样品的杨氏模量。在10%、30%、60%、80%这4种 DMSO浓度中,以经60%DMSO处理过的样品最接近于新鲜关节软骨的杨氏模量。
经过PBS洗脱后,关节软骨的杨氏模量较新鲜软骨的杨氏模量有所降低,说明即使在有低温保护剂的情况下,仍然会造成关节软骨较大的生物力学性能损伤。因此,要实现完整关节软骨的理想保存,寻找一种合适的低温保护剂及其合适的浓度是非常迫切的。下面讨论降温速率对杨氏模量的影响,均是洗脱低温保护剂后的测试结果。
2.3 降温速率对杨氏模量的影响
图4所示为方法2处理过的样品的杨氏模量,虚线部分为新鲜关节软骨的杨氏模量。可以明显看出,即使添加了各种低温保护剂,经过冻存后关节软骨的杨氏模量与新鲜关节软骨的杨氏模量相比,还是有不程度的降低;在相同的低温保护剂浓度下,降温速率为1℃/min的杨氏模量比较接近新鲜关节软骨。这说明,慢速降温对关节软骨的生物力学特性造成的损伤小。
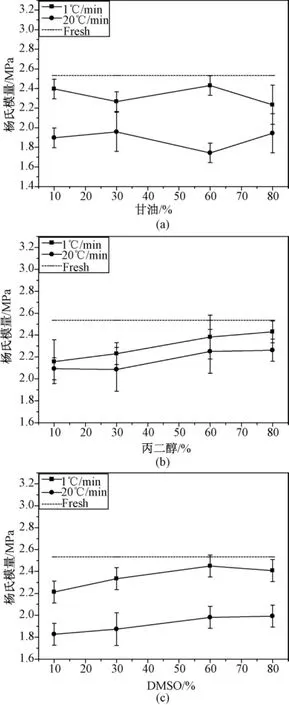
图4 降温速率对关节软骨杨氏模量的影响。(a)甘油;(b)丙二醇;(c)DMSOFig.4 Effects of cooling rates on Young's modulus(a)Glycerin;(b)Propylene glycol;(c)DMSO
机械效应是由细胞内冰晶生长而产生的机械力量引起的,且慢速冷冻产生的冰晶较大、快速冷冻产生的冰晶较小。降温速率越大,成核率也越大,形成数量很多的小冰晶,但冰晶生长率相对较低;而降温速率越小,则相反[23-24]。关节软骨这种特殊的组织是由少量的软骨细胞和大量的细胞外基质组成的,细胞主要作用是合成和分泌基质蛋白,维持软骨基质的新陈代谢,而细胞外基质是软骨的主要力学承载者。当降温速率较小时,细胞外水分首先结晶,造成游离水分子减少,细胞内水分由于渗透压不平衡而外渗,细胞收缩,细胞外形成的冰晶损伤了蛋白多糖或者胶原纤维。当降温速率较大时,软骨细胞内外冰晶体形成的速度较快,细胞内水分尚未转移到细胞外,细胞内外同时结晶。细胞内冰晶对细胞的损伤体现在细胞质和细胞核,影响的是软骨细胞的分裂能力;而细胞外降温时的成核率较低,冰晶生长速度较快,形成的大量冰晶迅速引起宏观体积膨胀,且冰晶之间大量存在的空隙也增加了宏观体积的膨胀,破坏了胶原纤维的合理排列分布,使软骨的支架结构受到破坏,大大降低了软骨的力学承载能力。
从图4中也可以看出,当降温速率太大时,形成的冰晶对软骨细胞外基质(即蛋白多糖或者胶原纤维)的损伤导致了软骨的模量的下降,而软骨的杨氏模量体现了软骨负重能力。另外,形成的冰晶对细胞膜的破坏也是很大的,可以直接造成细胞死亡。所以,找到适合的降温速率对于冻存软骨是非常重要的。
3 结论
本研究对3种低温保护剂、4种低温保护剂浓度以及2种降温速率对关节软骨杨氏模量的影响进行了实验,结果表明:
1)随着3种低温保护剂浓度的增大,杨氏模量也随之升高。这是因为随着低温保护剂浓度的增加,溶液中的甲基或羟基的个数也增加,结合水也增多,相对的自由水减少,所以当关节软骨加载时,只有较少的自由水流出组织产生较小的变形,导致杨氏模量变大。
2)相同的低温保护剂浓度,3种低温保护剂中DMSO的杨氏模量最高,其次是甘油,丙二醇的杨氏模量最低。DMSO有2个甲基,甘油有3个羟基,丙二醇有2个羟基和1个甲基,而甲基与甲基之间没有相互作用,只与水键合,而羟基除了与水键合外,自身也有键合,从而降低了结合水含量。
3)慢速降温的关节软骨的杨氏模量大于快速降温软骨的杨氏模量,这是因为快速冷冻产生的冰晶生长速度较快,形成的大量冰晶迅速引起宏观体积膨胀。这种宏观膨胀破坏了胶原纤维的合理排列分布,使软骨的支架结构受到破坏,大大降低了软骨的力学承载能力。
[1]卫小春.关节软骨[M].北京:科学出版社,2007:120-154.
[2]Seddighi MR,Griffon DJ,Schaeffer DJ,et al.The effect of chondrocyte cryopreservation on cartilage engineering [J].The Veterinary Journal,2008,178(2):244-250.
[3]Pegg DE, Wusteman MC, Wang LH.Cryopreservation of articular cartilage. Part 1:Conventional cryopreservation methods[J]. Cryobiology,2006,52(3):335-346.
[4]Song YC,An YH,Kang QK,et al.Vitreous preservation of articular cartilage grafts[J].J Invest Surg,2004,17(2):65-70.
[5]Leila L,Ken F,McGann LE,et al.Cryopreservation of porcine articular cartilage:MRI and biochemical results after different freezing protocols[J].Cryobiology,2007,54(1):36-43.
[6]陈百成,陈竞清,高石军,等.低温保护冻存的异体骨软骨移植修复关节软骨缺损的研究[J].中国骨肿瘤骨病,2003,2(6):336-339.
[7]李军政,成诗银,崔鹏程,等.深低温冻存软骨细胞构建组织工程化软骨[J].中国误诊学杂志,2004,4(10):1587-1589.
[8]曹谊林.组织工程学[M].北京:科学出版社,2008.
[9]Muldrew K,Novak K,Studholme C,et al.Transplantation of articular cartilage following a step-cooling cryopreservation protocol[J].Cryobiology,2001,43(3):260-267.
[10]Schachar NS,Novak K,Hurtig M,et al.Transplantation of cryopreserved osteochondral dowel allografts for repair of focal articular defects in an ovine model[J].Journal of Orthopaedic Research,1999,17(6):909-920.
[11]Kubo T,Arai Y,Namie K,et al.Time-sequential changes in biomechanical and morphological properties of articular cartilage in cryopreserved [J].Journal of Orthopaedic Science,2001,6(3):276-281.
[12]程杰平,马洪顺,褚怀德,等.骨性关节炎对膝关节软骨力学性质影响的实验研究[J].医用生物力学,2005,3(20):25-27.
[13]Jomha NM,Lavoie G,Muldrew K,et al.Cryopreservation of intact human articular cartilage[J].Journal of Orthopaedic Research,2002,20(6):1253-1255.
[14]Macfarlane DR.Physical aspects of vitrification in aqueous solutions [J].Cryobiology,1987,24(3):181-195.
[15]Fahy GM,Levy DI,Ali SE,et al.Some emerging principles underlying the physical properties,biological actions,and utility of vitrification solutions[J].Cryobiology,1987,24(3):196-213.
[16]Macfarlane DR.Recent insights on the role of cryoprotective agents in vitrification [J].Cryobiology,1990,27(4):345-358.
[17]Vigier G,Vassoille R.Ice nucleation and crystallization in water-glycerol mixtures[J].Cryobiology,1987,24(4):345-354.
[18]高才,周国燕,胥义,等.乙二醇和丙三醇水溶液冻结特性的研究[J].物理化学学报,2004,20(2) :123-128.
[19]胥义,周国燕,高才,等.兔胸主动脉冻结相变膨胀过程的TMA实验研究[J].中国生物医学工程学报,2004,23(5):455.
[20]胥义,华泽钊,周国燕.兔主动脉冻结过程中未冻水份额的研究[J].工程热物理学报,2006,27(3):478-480.
[21]Hey MJ, Macfarlane DR.Crystallization of ice in aqueous solutions of glycerol and dimethyl sulfoxide [J].Cryobiology,1996,33(2):205-216.
[22]Macfarlane DR,Forsyth Maria,et al.Recent insights on the role of cryoprotective agents in vitrification [J],Cryobiology,1990,27(4):345-358.
[23]胥义,周国燕,高才.兔主动脉冻结膨胀行为及其影响因素的研究[J].工程热物理学报,2005,26(6):1013-1015.
[24]Xu Yi,Hua Zechao,Sun Dawen,et al.Effects of freezing rates and dimethyl sulfoxide concentrations on thermal expansion of rabbit aorta during freezing phase change as measured by thermo mechanical analysis[J].Journal of Biomechanics,2007,40(14):3201-3206.
