大黄中4个番泻苷类成分受热条件下转化关系的研究
2012-07-26李瑞明张兰兰闫希军
哈 飞, 李瑞明, 张兰兰*, 闫希军
(1.天津中医药大学,天津300193;2.天津天士力集团研究院现代中药所,天津300410)
大黄为蓼科植物掌叶大黄Rheum palmatum L.、唐古特大黄Rheum tanguticum Maxim.ex Balf或药用大黄Rheum officinale Baill.的干燥根及根茎[1],始载于《神农本草经》,列为中品,因其色黄而得名[2]。大黄是中医中传统的泻剂之一,致泻的主要成分为蒽醌类化合物,其中以番泻苷的作用最强,游离型蒽醌泻下作用较弱。番泻苷A和B是大黄的活性成分,韩国及日本均将番泻苷A作为检测指标[3]。自古研究大黄以来,大黄有在处方中需要后下之说,药典用法有不宜久煎,都是因为加热时间过长泻下成分会分解[4-5],但很少有文献报道其具体成分转化途径,本实验对大黄中主要泻下成分番泻苷类进行了受热条件下转化关系的研究,阐述了其分解途径,对大黄在中药制剂中的应用具有科学性指导。
1 仪器与试药
1.1 仪器 Waters高效液相色谱仪 (Waters e2695 Separations Module,Waters 2998 PDA检测器,Empower数据处理软件),质谱仪 (Agilent G6300 MS TRAP)调温电热套 (98-1-B型),电子分析天平 (梅特勒/XS205DU)。
1.2 试药 大黄购于安国药材市场,为四川大黄统货,经天津中医药大学李天祥教授鉴定为药用大黄 Rheum officinale Baill.。
番泻苷A、B、C、D对照品 (天津马克生物技术有限公司,批号:f-20091215),磷酸 (天津市光复精细化工研究所,色谱纯),食用乙醇,二纯水 (Milli-Q制备),色谱乙腈 (Merck公司)。
2 方法与结果
2.1 色谱条件 Agilent ZORBAX SB-C18色谱柱(4.6 mm×250 mm,5 μm);流动相为乙腈 (A)-0.1%磷酸水溶液 (B)梯度洗脱,0~50 min(10% ~27%A),50~55 min(27% ~27%A),55~78 min(27% ~53%A),78~83 min(53%~80%A),83~93 min(80%A);柱温35℃;检测波长280 nm;体积流量1.0 mL/min。
2.2 供试品溶液制备
2.2.1 大黄原液样品制备 以最优工艺[6]提取大黄生药,称取大黄生药20.0 g,加入10倍生药量的80%乙醇,回流提取3次,每次提取时间为0.5 h,得大黄提取液。取样,为0时刻待测液。分别平行取6份大黄提取液,每份200 mL置于圆底烧瓶中,回流加热,回流时间依次为10、20、30、40、50、60 min。分别取样平行3份,以2.1项色谱条件方法检测,比较大黄中4个番泻苷类成分变化。
2.2.2 番泻苷样品制备 分别精密称取番泻苷A、B、C、D各2.5 mg,用80%乙醇定容于25 mL量瓶中,得0.1 mg/mL供试品溶液。取样,为0时刻待测液。分别将供试品溶液移置50 mL烧瓶中,电热套加热回流,分别在10、20、30、40、50、60 min时刻取样,得待测液,以2.1项色谱条件方法检测。
2.3 方法学考察
2.3.1 线性 分别精密吸取番泻苷A、B、C、D对照品原溶液3、5、7、9、12、15 μL,按2.1项色谱条件,高效液相检测,测得峰面积为纵坐标,进样量为横坐标,回归方程分别为:YA=862384 X+421483,r=0.9995;YB=919823X -28414,r=0.9990;YC=541435X -12076,r=0.9991;YD=929651X -40147,r=0.9998。番泻苷A、B、C、D 在0.3 μg~1.5 μg范围内呈良好线性关系。
2.3.2 精密度实验 分别精密吸取番泻苷A、B、C、D对照品原溶液10 μL,按2.1项色谱条件下重复进样6次,测得各峰面积,得其RSD值分别为0.26%、0.37%、0.45%和0.43%,表明精密度良好。
2.3.3 重复性实验 供试品溶液每时刻分别平行取样3份,进行测定,得番泻苷A、B、C、D峰面积值的RSD均小于3%,表明重复性良好。
2.3.4 稳定性实验 取番泻苷A、B、C、D对照品原溶液,分别于0、2、4、6、8、10、12、24 h在2.1项色谱条件下进行测定,峰面积的RSD值分别为1.06%、1.27%、0.95%和1.31%,表明在常温下24 h内稳定。
2.4 结果
2.4.1 大黄提取液未加热前HPLC色谱图见图1。大黄中番泻苷A、B、C、D成分在受热条件下均存在降解,通过对大黄中番泻苷A、B、C、D在受热条件下各时间点的相对峰面积进行比对,分别得到1 h内的变化趋势,见图2~5。
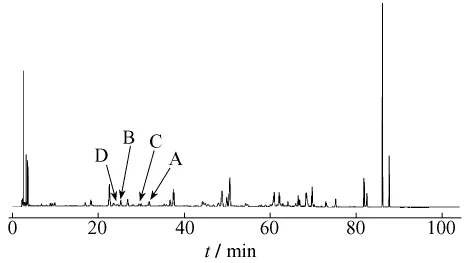
图1 大黄提取液HPLC图谱Fig.1 Chromatogram of rhubarb extract
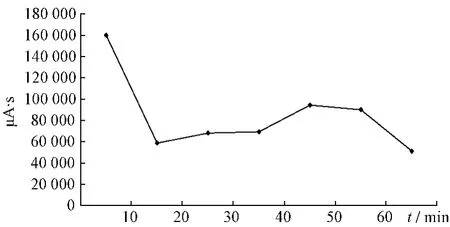
图2 番泻苷A变化趋势图Fig.2 Changed trend chart of sennoside A
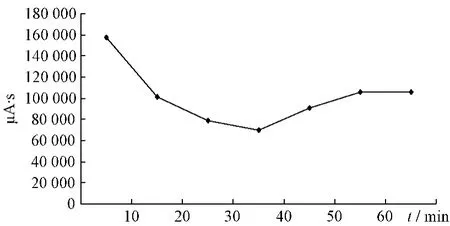
图3 番泻苷B变化趋势图Fig.3 Changed trend chart of sennoside B
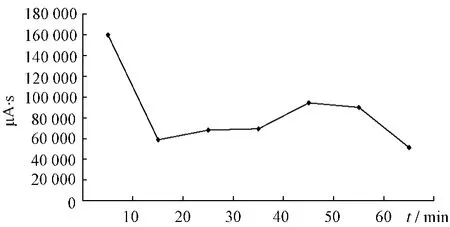
图4 番泻苷C变化趋势图Fig.4 Changed trend chart of sennoside C
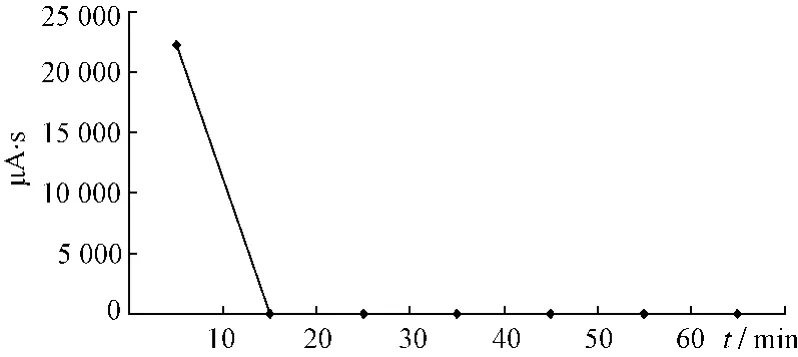
图5 番泻苷D变化趋势图Fig.5 Changed trend chart of sennoside D
2.4.2 番泻苷A、B、C、D在受热条件下存在相互转化关系,在1 h内呈规律性趋势变化,结果见图6~9。
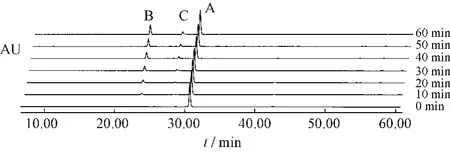
图6 番泻苷A受热条件下1h内变化情况Fig.6 Sennoside A changes under heating condition in 1 h
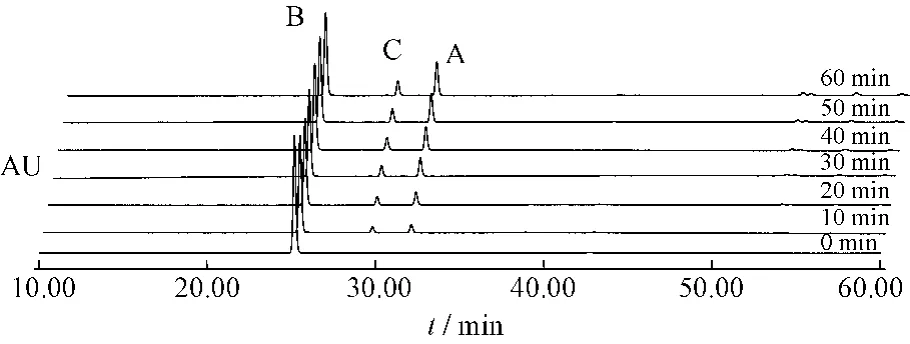
图7 番泻苷B受热条件下1 h内变化情况Fig.7 Sennoside B changes under heating condition in 1 h
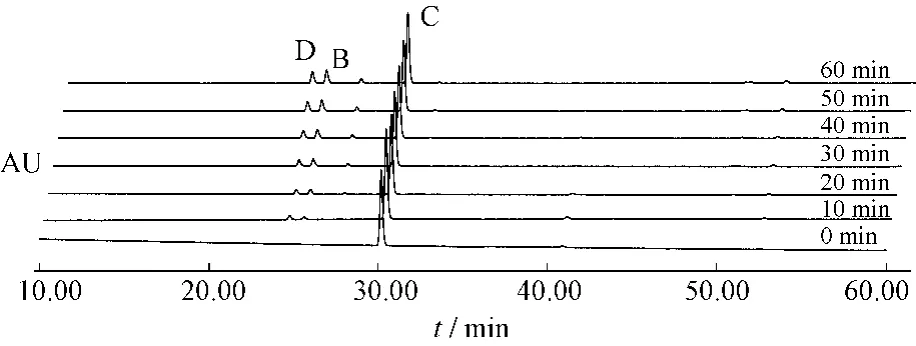
图8 番泻苷C受热条件下1 h内变化情况Fig.8 Sennoside C changes under heating condition in 1 h
番泻苷A在1 h内80%乙醇中加热回流条件下,可以转化为番泻苷B和番泻苷C。番泻苷B在1 h内80%乙醇中加热回流条件下,可以转化为番泻苷A和番泻苷C。番泻苷C在1 h内80%乙醇中加热回流条件下,可以转化为番泻苷B和番泻苷D和新的中间产物。番泻苷D在1 h内80%乙醇中加热回流条件下,可以转化为番泻苷B和番泻苷C和新的中间产物。见表1~4。
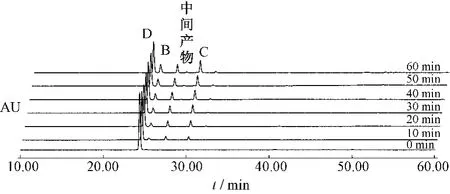
图9 番泻苷D受热条件下1 h内变化情况Fig.9 Sennoside D changes under heating condition in 1 h
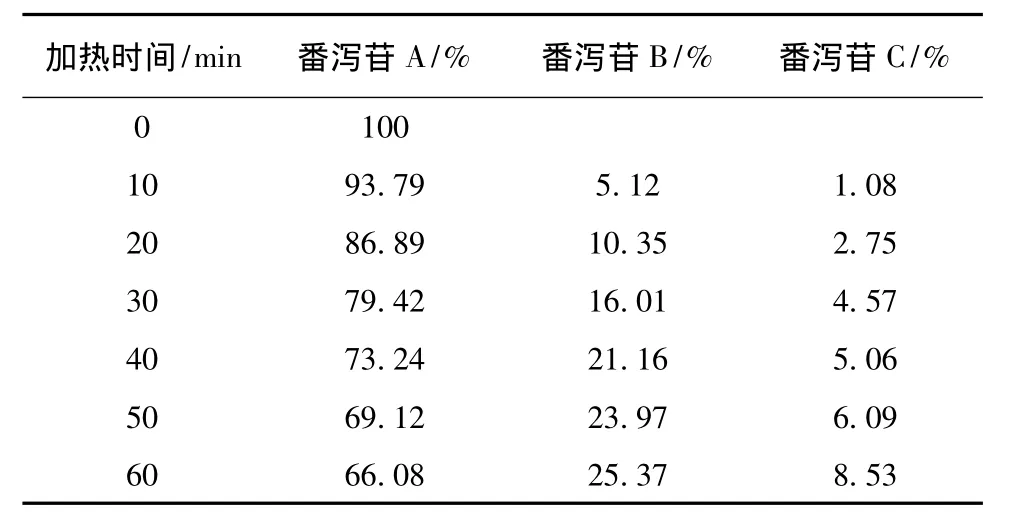
表1 番泻苷A在加热回流各时间点的峰面积百分比Tab.1 Peak area percentage of sennoside A under heating reflux condition each time
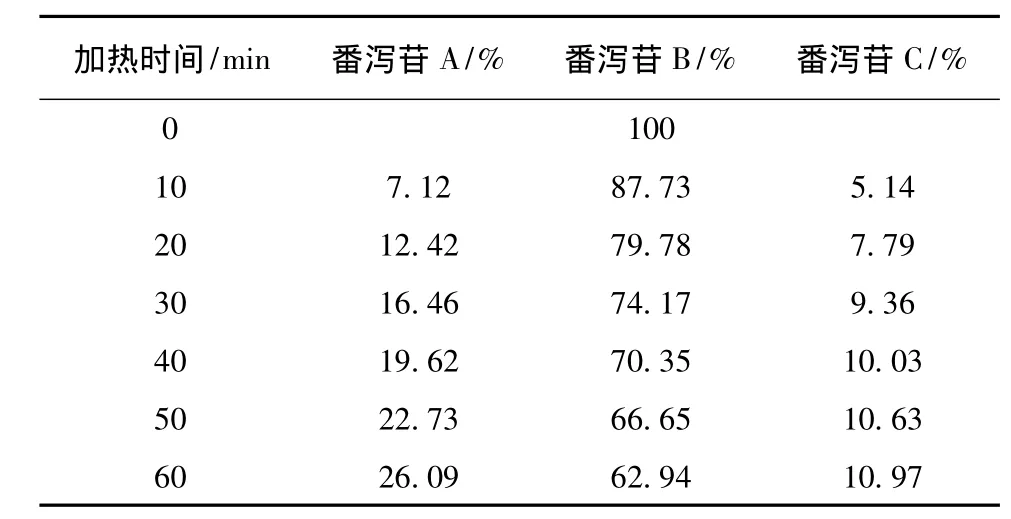
表2 番泻苷B在加热回流各时间点的峰面积百分比Tab.2 Peak area percentage of sennoside A under heating reflux condition each time
番泻苷A、B、C、D化学结构式[7]见图10。
番泻苷A和B互为异构体,相对分子质量为862.74;番泻苷C和D互为异构体,相对分子质量为848.74[8]。取番泻苷D加热60 min时刻的样品,进行质谱检测。番泻苷C和D加热下有新中间产物生成,对其进行质谱分析,对正离子碎片离子峰采集,结果如图11,得知推测生成的中间产物的相对分子质量为834.7。
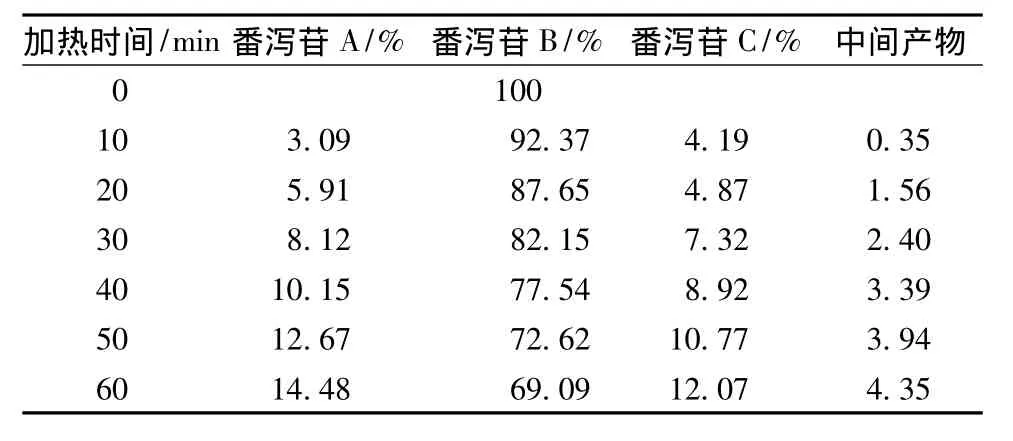
表3 番泻苷C在加热回流各时间点的峰面积百分比Tab.3 Peak area percentage of sennoside A under heating reflux condition each time
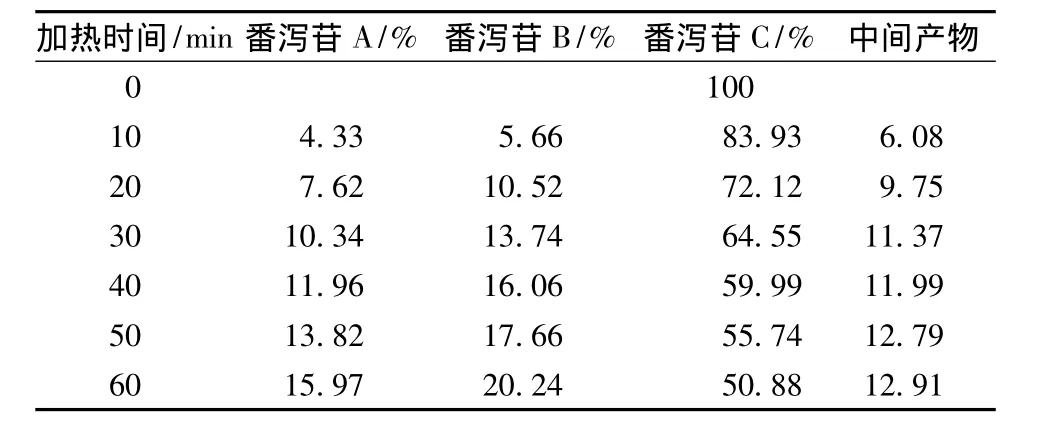
表4 番泻苷D在加热回流各时间点的峰面积百分比Tab.4 Peak area percentage of sennoside A under heating reflux condition each time
3 讨论
大黄泻下的有效成分为蒽醌类衍生物,以蒽酮苷类泻下效力较强,游离蒽酮较弱,游离蒽醌更次。双蒽酮比单蒽酮强,其中番泻苷A(sennoside A)为大黄泻下最强的有效成分[9]。因番泻苷A加热分解,大黄煎煮时间过长,会使泻下作用减弱[10]。大黄中番泻苷类成分为大黄泻下作用的主要成分[11],药效作用大,但含有量较少,因此有必要对番泻苷类单体成分进行研究,使大黄更好的在现代中药中应用。
本实验中,对大黄中番泻苷类成分受热条件下考察,番泻苷A、B、C、D成分均有降解,为明确其降解原因,故首次将番泻苷A、B、C、D对照品作为考察对象,更直观的对大黄中番泻苷类成分稳定性进行研究,揭示了番泻苷类成分之间的转化关系,避免了大黄中其他成分对番泻苷类成分研究时的影响。
大黄药材中番泻苷总量在0.304%~1.450%之间,均值在0.892%[12],其中含番泻苷D较低,同时,从单体番泻苷D受热下转化情况得知其降解率大,且转化中难形成番泻苷D,推测为大黄中番泻苷D受热全部降解的原因,HPLC未能检测出。
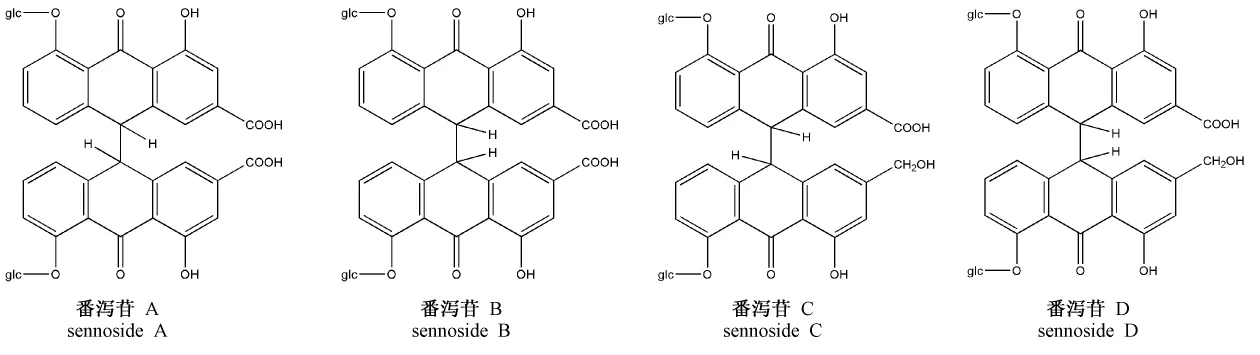
图10 番泻苷A、B、C、D化学结构式Fig.10 Chemical structures of sennoside A,B,C,D

图11 中间产物质谱图谱Fig.11 Mass spectrum of intermediate product
结合型蒽醌以番泻苷为主,是大黄蒽醌类衍生物以及蒽酮与葡萄糖结合形成的苷类。蒽酮糖苷进行治疗时发挥作用的成分为水解后苷元的部分[13]。大黄中番泻苷类成分的致泻作用是因其在肠内变为大黄酸蒽酮所致,并进一步被氧化成番泻苷元[7,14]。结合实验结果推测,二蒽酮番泻苷类成分在受热条件下可断链形成单蒽酮,又可再结合,形成互相转化过程。
本实验考察番泻苷类成分是为大黄更好的应用为前提,大黄提取醇提法也为经典法[15],故只考虑了80%醇中和受热条件下其转化关系。对于番泻苷类成分在不同溶媒及不同pH和不同温度条件下的变化关系,有待进一步研究。
实验中,在质谱分析中,番泻苷D在加热条件下生成的新中间产物量较大,所以选择其加热60 min时刻进行分析。番泻苷A和B的相对分子质量已知为862.74,番泻苷C和D的相对分子质量为848.74,故通过质谱正离子谱图得其中间产物分子量。
该实验对大黄中4个番泻苷类成分的稳定性进行研究,数据真实可靠,为大黄在中药现代化中的应用提供可靠性指导。
[1]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:22.
[2]张向红,程黎晖.大黄的药理作用及临床应用研究进展[J].中国药业,2009,18(21):76-78.
[3]马 蓉,张雪菊.液相色谱法对不同产地大黄中番泻苷A含量比较分析[J].中成药,2008,30(10):1489-1490.
[4]冯 萍,赵 萍.剂量、炮制和煎服方法对大黄药效的影响[J].实用中医内科杂志,2004,18(3):256-258.
[5]朱诗塔,雷 鹏,李新中,等.掌叶大黄不同炮制品泻下、止血作用的比较研究[J].中药材,2008,31(2):199-201.
[6]哈 飞,李瑞明,张兰兰.大黄浓缩干燥过程中各活性成分的稳定性[J]中国实验方剂学杂志,2012,18(3):11-13.
[7]吴立军.天然药物化学[M].5版.北京:人民卫生出版社:148-149.
[8]邱颂平.大黄的药学与临床研究[M].北京:中国中医药出版社,2007.12:143-145.
[9]李 娟,李 坚.大黄药理作用研究及临床应用概况[J].实用医药杂志,2006,23(9):1132-1133.
[10]冈村信幸.制备大黄煎剂时番泻苷A及泻下活性的变化[J].国外医学中医中药分册,2003,25(2):98-99.
[11]郑志华,祝 晨.HPLC测定大黄提取工艺产物番泻苷A的含量[J].中药材,2004,27(12):950-951.
[12]孙 佩,李 敏.HPLC法测定大黄药材和饮片中番泻苷A和番泻苷B的含量[J].成都中医药大学学报,2008,31(3):51-23.
[13]王 磊,高文远.大黄活性成分药代动力学研究进展[J].中成药,2011,33(9):1571-1573.
[14]武玉清,王静霞,周成华,等.番泻苷对小鼠肠道运动功能的影响及相关机制研究[J].中国临床药理学与治疗学,2004,9(2):162-164.
[15]马 静,张 建,刘春华,等.大黄浸膏制备工艺研究[J].中成药,2011,33(3):518-521.
