水杨酸对盐胁迫下花椰菜种子萌发及幼苗生理特性的影响
2012-06-08王玉萍董雯张鑫杨茜张峰
王玉萍,董雯,张鑫,杨茜,张峰,2*
(1.甘肃农业大学农学院 甘肃省干旱生境作物学重点实验室 甘肃省作物遗传改良与种质创新重点实验室,甘肃 兰州730070;2.甘肃农业大学生命科学技术学院,甘肃 兰州730070)
水杨酸(salicylic acid,SA)是植物体内普遍存在的一种酚类化合物,是细胞内信号分子,又是一种内源性激素[1],参与调节植物的许多生理过程。研究发现,SA具有诱导植物系统抗病性[2],提高植物对非生物逆境的抗性,如缓解重金属对植物的毒害作用[1],提高植物抗盐性[3-5]、加快种子萌发速率[4-7]等。但目前关于这方面的研究报道多见于玉米(Zeamays)[1]、小麦(Triticumaestivum)[4]和水稻(Oryzasativa)[7]等大田作物,而涉及蔬菜作物形态建成的较少。
花椰菜(Brassicaoleraceavar.botrytis)又名花菜、菜花、球花甘蓝,为十字花科(Cruciferae)芸薹属(Brassica)植物。其营养丰富,质地细嫩,风味鲜美而广受人们喜爱,已成为我国重要的蔬菜作物,也是兰州市高原夏菜主栽蔬菜之一,近年发展规模越来越大,然而栽培常受到盐渍地威胁,给生产造成不同程度的损失[8]。前人已对花椰菜的营养生理[9]、干旱和高温胁迫[10,11]以及抗病性[12]进行了研究,但对盐胁迫下花椰菜的生理特性研究较少。因此,研究花椰菜耐盐机理,选择和培育花椰菜耐盐品种具有重要的理论和实践意义。
种子萌发和幼苗形态建成是作物生产的关键时期,种子发芽质量好坏直接影响作物生长和经济效益,外源SA对盐胁迫下花椰菜种子萌发及幼苗生长影响的研究鲜见报道。为明确SA对花椰菜耐盐性的生理机制,本研究以花椰菜种子和幼苗为试材,分析不同浓度外源SA处理后,种子萌发、植株生长参数及生理生化指标的变化,研究SA对盐胁迫下花椰菜的作用机理,旨在为缓解花椰菜盐害提供理论和技术依据,同时为解决花椰菜在栽培和育种实践中综合逆境因子的伤害提供新思路。
1 材料与方法
1.1 试验材料
本试验于2010年3-9月在甘肃农业大学农学院进行。供试花椰菜品种为先华70和祁连白雪,购自于甘肃省农业科学院。SA和NaCl购自北京化学试剂公司,含量≥99.5%,分析纯试剂AR级。
1.2 试验方法
1.2.1 SA对NaCl胁迫下花椰菜种子萌发的影响 试验共设6个处理:以蒸馏水作为对照(CK),SA处理浓度分别设置为0.5,1.0,1.5,2.0和2.5mmol/L(T1、T2、T3、T4、T5)。在预备试验的基础上,选取2个不同盐敏感性的花椰菜品种籽粒饱满种子(种子在蒸馏水中的初始发芽率均达100%),用10%(v/v)次氯酸溶液消毒15 min,去离子水洗净凉干。分别用不同处理浓度的SA溶液浸种24h,CK用等量蒸馏水浸种处理,将浸种后的种子分别在125mmol/L NaCl溶液中进行发芽试验。采用纸上发芽床法,在洗净、烘干的培养皿(直径9cm)中铺2层滤纸,将处理溶液分别加入培养皿内,至滤纸饱和,然后整齐排入50粒种子,加盖。在25℃的恒温培养箱内暗萌发。每个处理重复3次。称重法补充蒸发的水分,保持溶液的浓度恒定。每日观察并记录发芽种子数(以胚根伸出种皮作为发芽标准),记录7d,测定并计算种子萌发相关指标。
1.2.2 SA对NaCl胁迫下花椰菜幼苗形态生理指标的影响 花椰菜种子温汤浸种5h,25℃下保湿催芽2~3 d。待种子露白播种于塑料营养钵(9cm×9cm)中,基质为蛭石∶珍珠岩=3∶1(v/v),浇灌1/2Hoagland营养液,置于人工气候室培养,培养环境设为温度26℃/18℃(昼/夜),光周期昼夜各12h/d,白色荧光灯作为光源,光强为(600±15)μmol/(m2·s),相对湿度75%。每处理播种20盆,每盆播2粒种子,幼苗破心时选择长势一致的植株定苗1株。
试验共设6个处理:以蒸馏水作为对照(CK),SA 处理浓度分别设置为0.5,1.0,1.5,2.0和2.5mmol/L(T1、T2、T3、T4、T5)。待两片真叶完全展平后,在距根部约2cm处用注射器进行SA注根初始处理,每株20 mL;2d后叶面喷施SA强化处理,每处理喷施60mL。CK用等量蒸馏水代替。强化处理后3d,进行盐胁迫:用注射器缓慢注入125mmol/L NaCl,每株40mL。每隔3d浇1次营养液,胁迫处理15d后测定相关形态和生理生化指标。
1.3 指标测定
1.3.1 种子萌发指标 种子萌发第4天测定发芽势,第7天测定发芽率和发芽指数。ɑ-淀粉酶活性测定参照李合生[13]的方法。发芽率(GP)=∑(Gt/t)×100%;发芽指数(GI)=∑(Gt/Dt),式中,Gt为在t日的发芽数;Dt为相应的发芽天数。发芽势=(规定天数发芽的种子数/供试种子数)×100%。
1.3.2 形态指标 胁迫处理后第20天测定幼苗株高(子叶节到生长点之间的距离)、茎粗(子叶节下2cm处的粗度)及叶面积 (第3片真叶展开叶面积)。
1.3.3 生理生化指标 胁迫处理后第15天取第2片完全展开的真叶,参照李合生[13]的方法,避开叶脉打孔,测定叶绿素a,叶绿素b含量;丙二醛(malonic dialdehyde,MDA)含量的测定采用硫代巴比妥酸法;超氧化物歧化酶(superoxide dismutase,SOD)活性的测定采用氮蓝四唑(nitrotetrazolium blue chloride,NBT)法;过氧化物酶(peroxidase,POD)活性的测定采用愈创木酚氧化法;游离脯氨酸含量的测定采用磺基水杨酸法,可溶性糖含量的测定采用蒽酮比色法[14]。
1.4 数据处理
所有处理每次测定重复3次,数据为3次测定的平均值。采用Microsoft Excel 2003软件对数据进行处理;用DPS 7.05统计软件进行方差分析,用LSD法进行差异显著性多重比较。
2 结果与分析
2.1 SA浸种对盐胁迫下花椰菜种子萌发的影响
不同浓度SA浸种处理,盐胁迫下2个花椰菜种子萌发相关指标随浸种浓度的增加表现出先升后降的趋势(表1)。与CK相比,T1、T2和T3处理可明显提高种子发芽率、发芽势、发芽指数和ɑ-淀粉酶相对活性。以T2处理效果最佳,先华70的发芽率、发芽势、发芽指数和ɑ-淀粉酶相对活性分别较CK提高18.9%,23.5%,22.7%和25.1%,差异显著(P<0.05);祁连白雪的发芽率、发芽势、发芽指数和ɑ-淀粉酶相对活性分别较CK提高20.5%,21.3%,20.6%和28.5%,差异显著(P<0.05)。T4和 T5处理2个品种的种子发芽各项指标较CK明显降低。

表1 SA浸种对NaCl胁迫下花椰菜种子萌发的影响Table 1 Effects of exogenous salicylic acid on seed germination of cauliflower under salt stress %
结果表明,适宜浓度的SA浸种可以有效缓解盐胁迫对花椰菜种子萌发的抑制作用,其中以1.0mmol/L的SA浸种效果最佳,SA浓度为0.5和1.5mmol/L时,缓解效果明显降低,超过1.5mmol/L不具有缓解效应,高浓度SA对种子发芽有抑制作用,且浓度越高抑制效果越明显。
2.2 SA对盐胁迫下花椰菜幼苗形态特征的影响
与CK相比,不同SA处理对盐胁迫下花椰菜幼苗的生长发育有不同程度的影响(表2)。T1、T2和T3处理,对盐胁迫下2个花椰菜品种幼苗的生长发育均具有较明显的促进作用,其中T2处理的效果最佳。与CK相比,先华70的茎粗、株高、叶面积分别提高了6.1%,11.8%和6.2%,差异均达显著水平(P<0.05);祁连白雪的茎粗、株高、叶面积分别提高了5.1%,12.2%和6.9%,差异也达显著水平(P<0.05)。T4处理与CK差异不显著,T5处理的花椰菜幼苗茎粗、株高和叶面积较CK降低,幼苗的生长发育受到明显抑制,胁迫加剧。
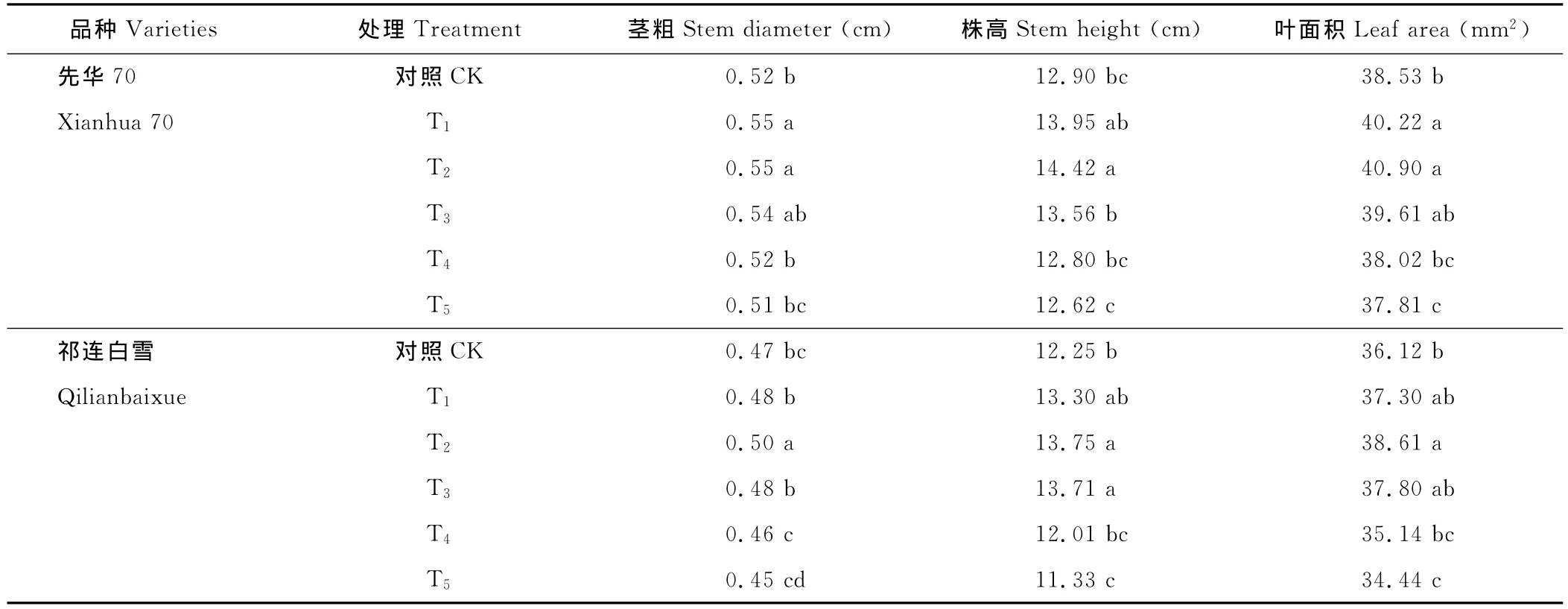
表2 SA对盐胁迫下花椰菜幼苗形态指标的影响Table 2 Effects of exogenous salicylic acid on morphologic characters of cauliflower seedlings under salt stress
一定浓度的外源SA处理能不同程度地提高花椰菜幼苗叶片叶绿素a、叶绿素b和叶绿素(a+b)含量(表3),其中T1~T3处理较CK能明显提高叶绿素a、叶绿素b和叶绿素(a+b)含量,以T2处理最佳,先华70和祁连白雪分别比CK提高23.8%,10.2%,19.9%和26.1%,13.3%,22.4%,差异达显著水平(P<0.05);T4处理中先华70上述指标与CK差异不显著,而祁连白雪上述指标稍高于CK;T5较T4处理的各指标均有所降低。说明0.5~1.5mmol/L的低浓度SA能有效地缓解幼苗的盐胁迫,提高叶绿素含量,促进幼苗的生长发育,当SA浓度超过2.0mmol/L,缓解作用不明显甚至没有缓解作用,因此这种促进作用随SA处理浓度的增加表现出先上升后下降的趋势。

表3 SA对盐胁迫下花椰菜幼苗叶绿素含量的影响Table 3 Effects of exogenous salicylic acid on chlorophyll contents of cauliflower seedlings under salt stress
2.3 SA对盐胁迫下花椰菜幼苗叶片MDA含量的影响
T1、T2和T3处理叶片中 MDA含量较CK明显降低(图1),以T2处理效果最佳,2个品种花椰菜幼苗叶片中MDA的含量降至最低,此时细胞膜稳定性最高,缓解胁迫的作用最为显著。T4处理MDA含量恢复至与CK差异不显著,对盐胁迫的缓解作用不明显,T5处理MDA含量明显高于CK,没有缓解作用,甚至胁迫较CK加剧。说明SA对花椰菜幼苗盐胁迫的缓解作用与浓度有关,0.5~1.5 mmol/L的低浓度缓解作用明显,超过1.5mmol/L的SA对盐胁迫的缓解作用降低,甚至加剧胁迫。
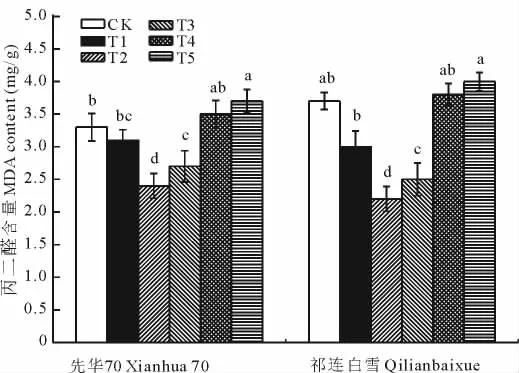
图1 SA对盐胁迫下花椰菜幼苗叶片MDA含量的影响Fig.1 Effects of exogenous salicylic acid on the content of MDA in the seedling leaves of cauliflower under salt stress
2.4 SA对盐胁迫下花椰菜幼苗叶片抗氧化酶活性的影响
SA对盐胁迫下花椰菜幼苗叶片的SOD和POD活性有显著影响(图2)。与CK相比,T1~T3处理能明显促进花椰菜幼苗叶片SOD和POD活性的提高,表明外源SA可以提高盐胁迫下花椰菜幼苗的抗氧化能力,对盐胁迫起缓解作用。其中,T2和T3处理的SOD和POD活性提高最大,与CK相比,差异均达显著水平(P<0.05),但T2和T3两个处理之间差异不显著(P>0.05)。T4处理的2个品种SOD活性降至与CK相同甚至低于CK,而POD活性均较CK高。T5处理的SOD活性较CK降低显著,而POD活性与CK差异不显著。SA对SOD与POD活性的影响总体上呈现“低-高-低”的趋势,但是SOD与POD活性的降低幅度不同,表明不同浓度SA处理对SOD和POD活性的调节作用不同。
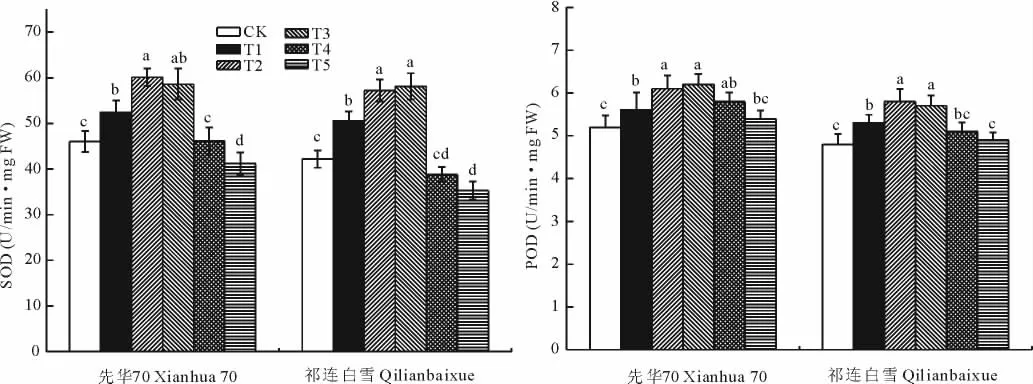
图2 SA对盐胁迫下花椰菜幼苗叶片SOD和POD活性的影响Fig.2 Effects of exogenous salicylic acid on the activities of SOD and POD in the seedling leaves of cauliflower under salt stress
2.5 SA对盐胁迫下花椰菜幼苗叶片脯氨酸和可溶性糖含量的影响
T1~T3处理明显促进先华70脯氨酸含量的提高(图3),而T1~T4处理明显促进祁连白雪脯氨酸含量的提高,且T2处理的2个品种与CK相比,脯氨酸含量增加最高,对盐胁迫缓解作用最佳。T4处理的脯氨酸含量与CK差异不显著,缓解作用不明显,T5处理的脯氨酸含量明显低于CK,没有缓解作用。可溶性糖含量的变化情况与脯氨酸基本相同,表明SA能够一定程度上提高盐胁迫下幼苗体内可溶性糖含量,提高幼苗渗透调节能力,缓解盐胁迫造成的渗透失水及次生伤害,综合2个品种总体上以T3处理效果最佳,但T2和T3处理间差异不显著(图3)。SA处理的脯氨酸和可溶性糖含量的变化总体上呈现“低-高-低”的趋势。T3、T4和T5处理,可溶性糖含量的降低幅度小于脯氨酸的降低幅度。说明0.5~1.5mmol/L SA能够在一定程度上提高花椰菜幼苗的渗透调节能力,对盐胁迫起缓解作用(P<0.05),超过1.5mmol/L时2种渗透调节物质变化幅度的差异表明,高浓度SA作用下脯氨酸和可溶性糖对缓解花椰菜幼苗盐害可能有不同的作用机制。
3 讨论
盐胁迫损害植物细胞的正常代谢过程,造成种子发芽率、发芽势和发芽指数降低。SA可以提高植株的抗病性[2]、耐盐性[3-5],促进种子萌发[4-7]等。本研究通过预备试验,选取介于2个不同盐敏感性的花椰菜品种种子萌发盐胁迫临界浓度之间的NaCl(125mmol/L)进行胁迫处理。通过不同浓度SA浸种处理,结果表明0.5~1.5 mmol/L的较低浓度SA能显著提高胁迫处理下2个花椰菜品种种子的发芽率、发芽指数和ɑ-淀粉酶相对活性,而SA浸种超过1.5mmol/L时对种子萌发起抑制作用(表1)。这同张士功等[4]在盐胁迫下小麦种子上的研究结果基本一致。已有研究表明SA能通过提高种子的含水量[6]、POD活性和可溶性糖含量[7]来促进种子萌发。α-淀粉酶作为种子贮存物质的氧化分解关键酶之一,在种子萌发过程中起了非常重要的作用。本研究结果表明SA在促进盐胁迫下花椰菜种子萌发的同时也促进了α-淀粉酶活性的提高,说明SA是通过提高α-淀粉酶的活性而促进种子萌发的。但是SA浓度超过1.5mmol/L时对种子萌发产生一定程度的抑制现象,可能与SA干扰正常的物质代谢和能量代谢,并消耗一定的生物能有关。

图3 SA对盐胁迫下花椰菜幼苗叶片脯氨酸和可溶性糖含量的影响Fig.3 Effects of salicylic acid on the contents of free proline and water dissolved-carbohydrate in the seedling leaves of cauliflower under salt stress
逆境条件下,植物细胞内自由基产生和清除的平衡遭到破坏,过量产生的自由基会对植物造成伤害,MDA是膜脂过氧化产物之一,其含量的高低表示细胞膜脂过氧化的程度和植物对逆境条件反应的强弱。本研究结果表明,1.0mmol/L的外源SA处理显著抑制花椰菜叶片中MDA的积累,降低膜脂过氧化的程度,维持膜系统的稳定性,提高花椰菜幼苗的耐盐能力;抗氧化酶活性与细胞活性氧水平及氧化伤害与否有直接关联。SOD和POD是活性氧清除酶系统的重要保护酶,在逆境胁迫中清除过量的活性氧,维持活性氧的代谢平衡,使植物在一定程度上抵御逆境伤害[15]。本研究表明,0.5~1.5mmol/L的SA处理显著提高了盐胁迫下花椰菜幼苗叶片SOD和POD活性,两者协同作用,保证了活性氧的清除,MDA含量下降,缓解了盐胁迫对幼苗的氧化损伤,幼苗对盐胁迫的抗性增强;同时促进了盐胁迫下花椰菜幼苗株高、茎粗、叶面积和叶绿素含量的增加,维持幼苗正常生长发育,使植物对逆境的适应能力增强,这与宋士清等[5]和佘小平等[16]对黄瓜(Cucumissativus)的研究结果相似。
在盐胁迫下,由于外界渗透势较低,植物细胞会发生失水现象而造成生理性缺水,植物体内渗透调节成为一个关键环节。游离脯氨酸和可溶性糖作为2种主要的渗透调节物质在渗透调节中起着重要作用[5,17,18]。本研究结果表明,0.5~1.5mmol/L的SA处理显著提高了盐胁迫过程中2个花椰菜品种幼苗的脯氨酸和可溶性糖含量,说明花椰菜可通过渗透调节来适应逆境。脯氨酸作为一种有机渗透调节剂,虽然它积累的原因和生理意义仍然存在分歧[18,19],但是它作为一种有机渗透调节物质在植物遭受盐害时起的作用已经被大多数人所接受[17,19]。李源等[19]认为脯氨酸含量与耐盐性呈负相关,脯氨酸积累可能是植物细胞结构和功能受到盐害的一种适应性反映,可以对植物本身起到一定的防护作用。秦峰梅等[18]和董秋丽等[20]认为脯氨酸的积累与渗透调节和耐盐能力呈正相关,即脯氨酸在逆境下的积累能力越强,渗透调节能力越强,耐盐能力越强。本研究支持后者即脯氨酸含量与耐盐性呈正相关。但SA超过1.5mmol/L时,脯氨酸和可溶性糖含量以及SOD和POD活性的降低幅度都不尽相同,也揭示了外源SA调节花椰菜体内抗氧化酶活性水平和渗透调节物质含量的复杂性。
综上所述,外源SA可有效促进盐胁迫下不同盐敏感性花椰菜品种的种子萌发及幼苗的生长发育,通过提高ɑ-淀粉酶活性,提高花椰菜幼苗渗透调节能力和抗氧化能力,诱导花椰菜耐盐性提高,减轻和缓解盐胁迫。外源SA浸种和处理的最佳作用浓度为1.0mmol/L。
[1]黄丽华,陆凤秀.水杨酸对铜胁迫下玉米幼苗生理特性的影响[J].种子,2009,28(3):90-93.
[2]Malamy J,Catt J P,Klessing D F.Salicylic acid-likely endogenous signal in the resistance response of tobacco to viral infection[J].Science,1990,(250):1001-1006.
[3]Omar B,Victoriano V,Miguel A B.Evidence for a role of salicylic acid in the oxidative damage generated by NaCl and osmotic stress inArabidopsisseedlings[J].Plant Physiology,2001,126:1024-1030.
[4]张士功,高吉寅,宋景芝.水杨酸对小麦种子萌发和幼苗生长过程中盐害的缓解效应[J].中国农业科学,1998,31(4):90-92.
[5]宋士清,郭世荣,尚庆茂,等.外源SA对盐胁迫下黄瓜幼苗的生理效应[J].园艺学报,2006,33(1):68-72.
[6]刘晶,王翠花,王芳,等.水杨酸浸种对蓖麻种子萌发的影响[J].内蒙古民族大学学报(自然科学版),2002,18(1):53-55.
[7]向华,饶力群,肖立锋.水杨酸对水稻种子萌发及其生理生化的影响[J].湖南农业大学学报(自然科学版),2003,29(1):12-14.
[8]李彦,张英鹏,孙明,等.盐分胁迫对植物的影响及植物耐盐机理研究进展[J].中国农学通报,2008,24(1):258-265.
[9]杨暹,关佩聪,陈玉娣.氮钾营养与花椰菜氮素代谢和产量的初步研究[J].华南农业大学学报,1994,15(1):85-90.
[10]陈国菊,杨暹,吴筱颖.干旱胁迫对花椰菜叶片细胞保护酶及超微结构的影响[J].中国蔬菜,2002,(2):8-12.
[11]汪炳良,徐敏,史庆华,等.高温胁迫对早熟花椰菜叶片抗氧化系统和叶绿素及其荧光参数的影响[J].中国农业科学,2004,37(8):1245-1250.
[12]吴晓丽,李建民,段留生,等.花椰菜幼苗叶片抗氧化酶系统与抗黑腐病关系的研究[J].植物病理学报,2005,35(6):509-513.
[13]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[14]张志良,翟伟箐.植物生理学实验指导[M].北京:高等教育出版社,2003.
[15]Liang Y C,Chen Q,Liu Q.Exogenous silicon (Si)increase antioxidant enzyme activity and reduces lipid peroxidation in roots of salt-stressed barley(HordeumvulgareL.)[J].Journal of Plant Physiology,2003,160:1157-1164.
[16]佘小平,贺军民,张键,等.水杨酸对盐胁迫下黄瓜幼苗生长抑制的缓解效应[J].西北植物学报,2002,22(2):401-405.
[17]侯彩霞,汤章城.细胞相容性物质的生理功能及其作用机制[J].植物生理学通讯,1999,35(1):1-7.
[18]秦峰梅,张红香,武祎,等.盐胁迫对黄花苜蓿发芽及幼苗生长的影响[J].草业学报,2010,19(4):71-78.
[19]李源,刘贵波,高洪文,等.紫花苜蓿种质耐盐性综合评价及盐胁迫下的生理反应[J].草业学报,2010,19(4):79-86.
[20]董秋丽,夏方山,董宽虎.NaCl胁迫对芨芨草苗期脯氨酸代谢的影响[J].草业学报,2010,19(5):71-76.
