旋覆花不同部位提取物对辣椒疫霉菌的生物活性研究
2012-05-10万红娟董红平郭朝阳
万红娟,赵 特,董红平,刘 希,郭朝阳,周 琳
(1.河南农业大学植物保护学院,河南郑州450002;2.河南省新型农药创制与应用重点实验室,河南郑州450002)
辣椒疫病是由辣椒疫霉菌(Phytophthora capsici Leonian)引起的一种毁灭性土传卵菌病害,现已在全世界普遍发生[1].近年来,随着辣椒在各主产区的连茬种植,该病害有逐渐加重的趋势,危害较为显著[2].疫病可危害辣椒的根、茎、叶和果实等部位,在气候条件适宜的情况下,短期内就可爆发,蔓延速度极快,给辣椒生产造成严重经济损失[3].化学合成杀菌剂通常被用来控制多种植物病害,但其不合理使用引起了诸多问题,如病原真菌对杀菌剂的抗性及食品、水、空气和土壤中农药残留的检出等[4].因此,从生物体特别是植物体中寻找新的高效、低毒、低残留且与环境相容性好的天然活性物质已成为人们努力的方向[5,6].目前国内外已发现杀菌活性植物1 400余种,其次生代谢产物超过40万种,其中含有许多对病原菌有抑制作用的活性物质[7],且已有多个植物源杀菌剂投放市场[8].欧亚旋覆花(Inula britannica L.)为菊科旋覆花属草本植物,在中国、日本和朝鲜等国分布非常广泛[9],是一种传统的中草药,具有降气、消痰、行水、止咳的功效[10].研究发现旋覆花花序提取物对多种植物病原真菌具有较强的生物活性,特别是对辣椒疫霉菌菌丝生长和孢子萌发抑制作用较强[11,12].为进一步明确旋覆花的抑菌活性部位及其对辣椒疫霉菌的控制效果,本研究系统测试了旋覆花4个部位的不同溶剂提取物的离体抑菌活性,并进行了盆栽药效试验.
1 材料与方法
1.1 供试材料
1.1.1 植物样品 2007-07于河南省郑州市市郊采集旋覆花植株,阴干后粉碎得干粉,过40目筛,备用.
1.1.2 供试菌种 辣椒疫霉菌(P.capsici),由河南农业大学植物保护学院病理学实验室提供.
1.2 旋覆花不同部位不同溶剂提取物的制备方法
采用浸渍超声提取.取旋覆花的根、茎、叶、花粉碎样品各50 g,分别用石油醚、乙酸乙酯、氯仿、正丁醇4种不同极性溶剂浸泡24 h后进行室温超声提取20 min,过滤,得滤液.如此重复3次,合并滤液,减压浓缩各提取液,加10 mL丙酮定容,配成质量浓度为5.0 g·mL-1的供试药液,置冰箱中保存备用.
1.3 旋覆花提取物对辣椒疫霉菌菌丝生长的影响
采用吴文君[13]的抑制菌丝生长速率法.分别取质量浓度为5.0 g·mL-1的供试药液 0.2 mL 加到9.8 mL PDA培养基中,即各提取物的供试终质量浓度为 0.1 g·mL-1,每培养皿放置 1个菌饼(直径为4 mm),重复3次,以相应溶剂为对照.按公式(1)评判生物测定效果.

1.4 旋覆花提取物对辣椒疫霉菌游动孢子释放的影响
参照毕艳红等[14]的方法.将辣椒疫霉菌在PDA培养基上培养4 d后接种到米糠培养基上,在光强3 000 lx、光暗比12 h∶12 h,25℃培养箱中培养8 d,用无菌水配成 4.0 ×106个·L-1的孢子囊悬浮液(在10×10倍显微镜下观察).将供试药液与孢子囊悬浮液等体积混匀,以无菌水与孢子囊悬浮液等体积混合液为对照.将混合液滴满凹玻片凹面,置于培养皿内保湿,在4℃冰箱中处理15 min后,移至25℃恒温箱中培养5 h,取出载玻片在10×10倍显微镜下随机检查3个视野,每视野观察约50个孢子囊,以孢子囊中游动孢子全部游出而成空壳记录为完全释放,每处理3个重复,以平均值作为测定结果.按公式(2)求供试药剂对病原菌孢子囊中游动孢子释放的抑制作用.

1.5 旋覆花的花提取物对辣椒疫病的盆栽防效
保护作用测定:当盆栽辣椒长至5~8片叶时,取供试药液5 mL在距离辣椒植株1 cm处灌根.每种药剂设置6次重复,以自来水和50%福美双可湿性粉剂800倍液为对照.24 h后将配好的孢子囊悬浮液5 mL在距离植株2 cm处灌根,于温度为28℃、相对湿度为50%条件下培养6 d后调查病害级别[15].治疗作用测定方法同保护作用,区别是先接种辣椒疫霉菌孢子囊悬浮液24 h后再用药剂灌根.以自来水和安博可湿性粉剂800倍液作为空白对照和标准药剂对照.分别按公式(3)和公式(4)计算病情指数与防治效果.

1.6 数据处理
利用SPSS 10.0软件中ANOVA方法对试验数据进行方差分析,并用Duncan’s新复极差法比较数据之间的差异显著性.
2 结果与分析
2.1 旋覆花提取物对辣椒疫霉菌菌丝生长的抑制作用
抑制菌丝生长速率法测定结果(表1)表明,在0.1 g·mL-1供试条件下,除旋覆花茎部氯仿提取物外,同一组织的不同溶剂提取物对辣椒疫霉菌菌丝生长均有较强的抑制活性,其中花的抑制活性最强,其石油醚提取物、氯仿提取物、乙酸乙酯提取物和正丁醇提取物对供试菌菌丝生长的抑制率分别为81.19%,93.15%,100%,95.43%;叶的抑制活性次之,抑制率分别为 81.17%,88.29%,95.43%,87.16%;茎的石油醚提取物、乙酸乙酯提取物和正丁醇提取物的抑制率分别为65.66%,74.05%,82.76%,根的4种溶剂提取物的抑制率也均在60%以上,分别为 73.22%,62.79%,64.20%,73.61%.
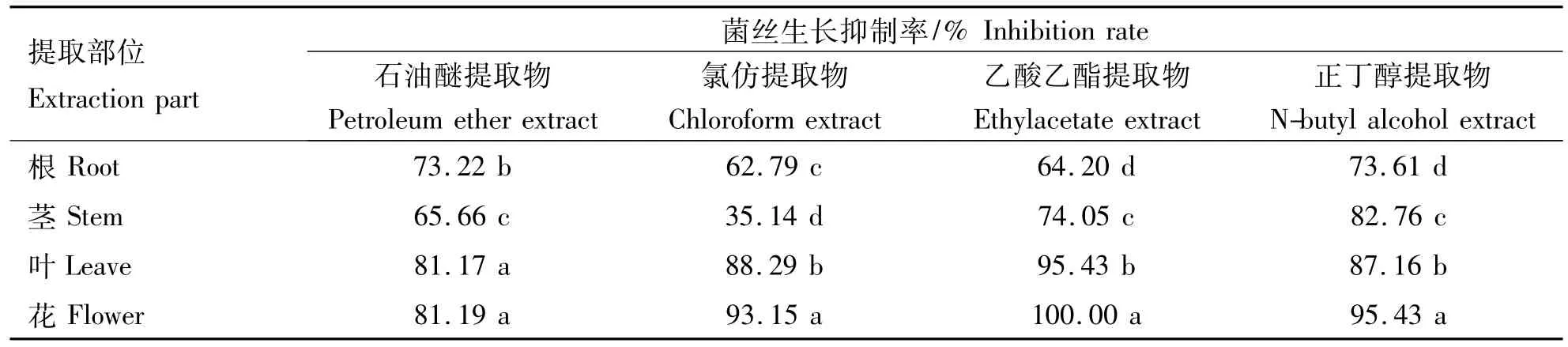
表1 旋覆花不同组织不同溶剂提取物对辣椒疫霉菌菌丝生长抑制作用Table 1 Inhibition of Inula britannica extracts by various solvents on mycelium growth of Phytophthora capsici
2.2 旋覆花提取物对辣椒疫霉菌游动孢子释放的抑制作用
在0.05 g·mL-1供试质量浓度下,旋覆花不同部位4种溶剂提取物对辣椒疫霉病菌孢子囊中游动孢子释放的抑制作用小于对菌丝生长的抑制作用.根、茎、叶、花4个不同组织中,叶的石油醚提取物对辣椒疫霉菌孢子萌发的抑制作用较强,抑制率为 83.33%,茎的石油醚提取物抑制率为66.67%,其它提取物对辣椒疫霉菌游动孢子释放的抑制作用都较弱,均低于45.56%(表2).

表2 旋覆花不同部位不同溶剂提取物对辣椒疫霉菌孢子释放抑制作用Table 1 Inhibition of Inula britannica extracts by various solvents on spores release of Phytophthora capsici
2.3 旋覆花的花提取物对辣椒疫病的盆栽防效
盆栽试验结果(表3)表明,在 1.0 g·mL-1处理剂量下,旋覆花花序氯仿提取物对辣椒疫病的治疗作用最强(52.18%),与对照药剂50%福美双可湿性粉剂800倍液相比无明显差异,其它3种溶剂提取物的治疗作用均显著低于对照药剂.旋覆花花序氯仿提取物对辣椒疫病的保护作用亦为最强,防效达46.35%,与对照药剂的防效相当,其它3种溶剂提取物的保护作用均显著低于对照药剂.
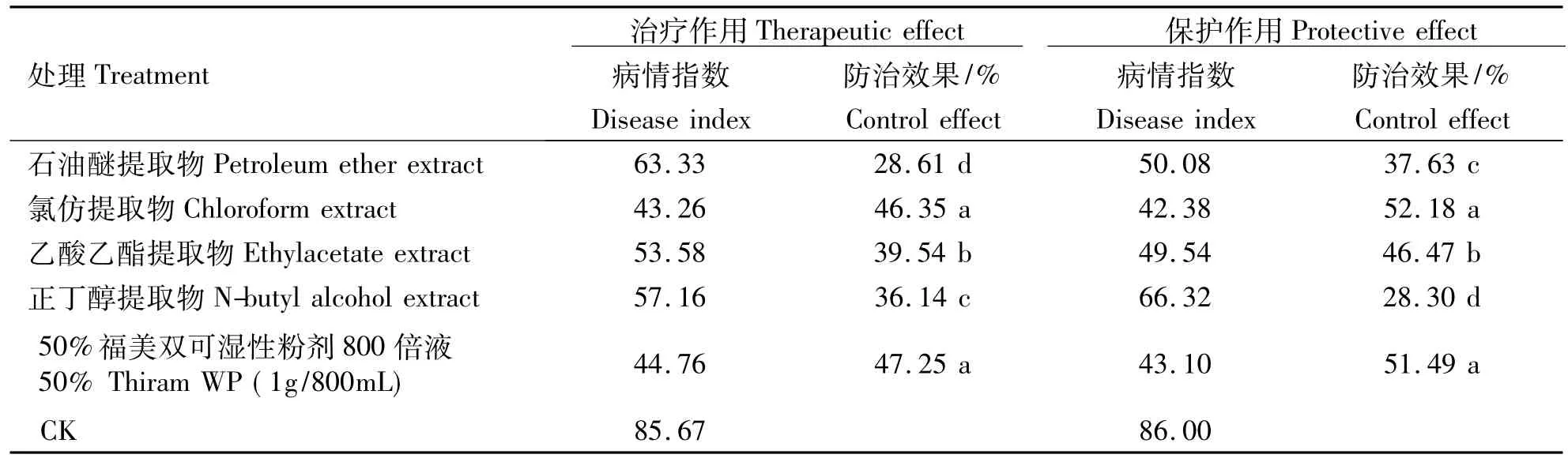
表3 旋覆花的花提取物对辣椒疫霉病的盆栽防效Table 3 The efficacy of the flower extracts of Inula britannica against phytophthora blight in pepper plant
3 结论与讨论
3.1 旋覆花提取物对辣椒疫霉菌具有较强的抑菌活性
本研究结果表明,在 0.1 g·mL-1供试条件下,旋覆花根、茎、叶、花4个部位的4种溶剂提取物能显著抑制辣椒疫霉菌的菌丝生长,其中花和叶的4种溶剂提取物抑制率均在80%以上;除旋覆花茎的氯仿提取物外,其它茎和根的不同溶剂提取物抑制活性均在 62.79%以上.在 0.05 g·mL-1供试条件下,旋覆花茎和叶的石油醚提取物对辣椒疫霉菌游动孢子释放的抑制作用较强,抑制率分别为83.33% 和 66.67%.盆栽试验结果表明,在1.0 g·mL-1处理剂量下,旋覆花花的氯仿提取物对辣椒疫病的治疗作用和保护作用与50%福美双可湿性粉剂800倍液相当.可见,旋覆花不同部位的不同极性溶剂提取物对辣椒疫霉菌具有较强的控制效果,其在辣椒疫病防治上具有较大的开发应用潜力.
3.2 旋覆花中抑菌活性成分值得进一步分离
已有研究表明,旋覆花不同溶剂提取物对多种植物病原真菌具有较强的抑菌活性[11,12,16],本研究结果表明,旋覆花各部位的不同极性溶剂提取物对辣椒疫霉菌具有不同程度的抑制活性,均说明植物体中含有一种或多种具有抑菌活性的化合物.王红刚等[17]从欧亚旋覆花中分离出了1-氧-乙酰大花旋覆花内酯,并发现其对黄瓜白粉菌、黄瓜霜霉菌、番茄早疫菌、黄瓜灰霉菌和致病疫霉均有一定的抑菌活性,其中对致病疫霉休止孢萌发抑制作用最强,在质量浓度为0.1 g·L-1时,抑制率可达100%,与化学药剂百菌清相当.因此,有必要采用不同极性溶剂对旋覆花主要抑菌活性部位——花和叶进行萃取,并对提取物中的抑菌活性成分进行系统的分离和鉴定,为旋覆花的直接开发应用提供科学依据,为寻找新型植物源杀菌剂的先导化合物提供重要线索.
[1] 崔晓岚,孟庆晓,毕 扬,等.辣椒疫霉对烯酰吗啉的敏感性基线及室内抗药突变体研究[J].植物病理学报,2009,39(6):630-637.
[2] 高立强.辣椒疫霉病的发生与防治[J].西北园艺,2002(4):46-47.
[3] 韩文革,李海燕,刘惕若,等.甲霜灵(Metalaxy1)种衣剂防治辣椒苗期疫病效果的初步研究[J].黑龙江农业科学,2004(5):17-l8;36.
[4] DAFERERA D J,ZIOGAS B N,POLISSIOU M G.The effectiveness of plant essential oils on the growth of Botrytis cinerea,Fusarium sp.and Clavibacter michiganensis subsp.Michiganensis[J].Crop Protection,2003,22:39-44.
[5] DUKE S O.Natural pesticides from plants[M]∥Janick,J,Simon J E Advances in New Crops.Portland,OR:Timber Press,1990:511 -517.
[6] GIGANTE B,SILVA A M,MARCELO C,et al.Structural effects on the bioactivity of dehydroabietic acid derivatives[J].Planta Medica,2002,68:680 -684.
[7] 周 丽,高 飞,滕 云,等.17种高原草地有毒植物对植物病原真菌生物活性的初步研究[J].四川大学学报:自然科学版,2008,45(1):214-218.
[8] 吴文君,高希武.生物农药及其应用[M].北京:化学工业出版社,2004.
[9] 吴一兵,张嫡群,王云志.欧亚旋覆花化学成分研究进展[J].天然产物研究与开发,2006(18):503-507.
[10]国家药典编委会.中华人民共和国药典[M].北京:化学工业出版社,2000.
[11]周 琳,焦 斌,高 飞,等.旋覆花花序不同溶剂提取物对植物病原真菌的抑菌活性[J].浙江大学学报:农业与生命科学版,2010,36(3):287-292.
[12]焦 斌,周 琳,宋天有,等.旋覆花花序氯仿提取物对13种植物病原真菌的抑菌活性[J].河南农业科学,2010,38(7):60-62;65.
[13]吴文君.植物化学保护实验技术导论[M].西安:陕西科学技术出版社,1988:141-145.
[14]毕艳红,慕 卫,刘 峰,等.杀菌剂对辣椒疫霉菌的毒力及其所致番茄猝倒病的控制效果研究[J].农药学学报,2004,6(4):43-47.
[15]王进强,许文耀,朱巧玲,等.56%氢氧化铜·烯酰吗啉可湿性粉剂对辣椒疫病的防治效果[J].亚热带农业研究,2006,1(2):37-40.
[16]王红刚,王文桥,韩秀英,等.旋覆花提取物对6种植物病原真菌抑制作用初步研究[J].华北农学报,2007,22(增刊):225-229.
[17]王红刚,王文桥,韩秀英,等.旋覆花中1-氧-乙酰大花旋覆花内酯的分离分析及抑菌活性测定[J].植物保护学报,2008,35(6):551-556.
