印记基因对胎盘发育的影响
2012-04-19尹秋丹张林波田见晖
尹秋丹,张林波,田见晖*
(1.吉林农业大学 生命科学学院生物制药创新实验室,吉林 长春130118;2.中国农业大学 动物科学技术学院/农业部动物遗传育种与繁殖重点实验室,北京100193)
印记基因是一类具有父母双方来源的等位基因,但是只表达其中一方的遗传信息,而另一方处于沉默状态的基因。其中父源表达、母源沉默的基因称为母源印记基因,反之则称为父源印记基因。在哺乳动物基因组中,印记基因成串出现在富含CpG 核苷酸的DNA 序列簇中,这些特殊的区域,称为印记控制区域[1]。目前,哺乳类动物基因组中大约存在100 ~200 个印记基因,在鼠类和人类基因组中已确定的约80 种。印记基因对于胎儿的生长发育与行为,特别是胎盘的发育都极其重要,印记基因的异常表达会导致许多疾病的发生[2]。
胎盘是怀孕期间形成的第一个器官,虽然短暂,却对胎儿发育起着至关重要的作用,例如胎儿的新陈代谢和营养控制、气体和代谢物的交换以及控制内分泌。一个功能正常的胎盘是哺乳动物存活与生长的重要保障之一[3]。胎盘是印记基因活动最重要的器官之一,尽管胎盘的形成显示出不同物种间的差异,但是在真亚纲哺乳动物中,尤其是灵长类、啮齿类和反刍动物中的基因印记活动是保守的。
印记作用被认为是在胚胎发育时期母体营养资源分配过程中,父源基因组和母源基因组冲突假说理论的应答变体。冲突假说,即父源表达基因促进胎盘发育并为胎儿提供更多营养,促进胎儿迅速生长,以期获得强壮个体; 母源表达基因则是为了自己的终身繁殖能力,限制胎儿生长速度和体重,节省和平均各胎次的繁殖资源[4]。胎盘是胎儿生长所需营养的主要资源,印记基因通过调节胎盘发育和营养物的转运,就可以影响母体-胎儿资源分配和胎盘对周围环境改变的应激反应,以及及时变更子宫内养分有效性。同时这些作用影响子宫内组织的发育编程,并与成人以后的一些疾病的发病率息息相关[5]。因此,印记基因通过调节胎盘生长发育,从而影响胎儿发育,具有十分重要的作用。
1 印记基因的表观调控方式
印记基因的“印记”机理是印记一方的基因调控序列DNA(一般认为是启动子) 被甲基化和组蛋白被甲基化,其中DNA 甲基化是关键[6]。DNA 甲基化是已知最早被发现的与基因抑制相关的表观遗传机制。在哺乳动物中,它发生于CpG 二核苷酸。甲基化DNA 在基因组上的分布表明它们集中出现在非编码区和散在的重复元件区域,是在DNA甲基化酶作用下,将S- 腺苷酞甲硫氨酸(SAM) 分子上的甲基转移到DNA 分子中胞嘧啶残基的5 位碳原子上。胞嘧啶被甲基化为5-甲基胞苷。此时该等位基因将被关闭,不再表达。另一方等位基因的调控序列未被甲基化等修饰,在转录复合体作用下可以正常进行mRNA 转录。在哺乳动物生命周期中,性原细胞阶段,DNA 分子甲基化被清除。配子阶段,重新建立DNA 甲基化。对于非印记基因,随后出现去甲基化,在受精后父源基因组DNA 去甲基化过程是主动的,母源基因去甲基化过程是被动的[7]。基因印记区域甲基化DNA 的存在导致胎盘类哺乳动物中母源或父源等位基因的沉默,包括X染色体失活。这表明在进化过程中它们独有的利用这一表观遗传机制来稳定沉默[8]。许多印记基因和印记调控子邻近的序列存在有差异甲基化序列和DNA 甲基化修饰,DNA甲基化在基因组印记的维持中所充当的重要角色在遗传学中得到了证明。
2 印记基因与胎盘发育
印记基因在胎盘中广泛却又短暂的表达,但其作用对于正常胎盘发育是必需的。在啮齿类动物中,当印记基因甲基化的建立受损,这包括与其相关基因的异常表达和甲基化抑制剂的作用,都会使胎盘滋养层细胞的分化及凋亡发生异常,从而导致胎盘的异常发育而使其不能正常发挥功能。在老鼠中,通过选择性基因敲除手段而产生的转基因突变个体中,经常发现有异常的胎盘发育,这包括异常的胎盘重量、迷路滋养层以及成胶质细胞的发育异常(表1)[1]。在正常受孕的人类婴儿中,异常的胎盘重量经常伴随着混乱的印记基因表达出现,而且有报道称,在发育迟缓或早产婴儿中胎盘内常伴有印记基因表达异常。并且各基因在胎盘发育的不同时期有不同表达量,不是所有基因在胎盘形成初始至胎儿出生都有表达[9]。
一般来讲,胎盘的正常发育需要父源印记基因和母源印记基因共同调控,通过父源基因的表达快速发育,通过母源基因的表达受到发育限制,任何一方的基因表达异常都会导致胎盘发育异常。这已通过对敲除基因突变体各项检测得到论证,这也与冲突假说理论表述一致。例如,H19-IGF2基因位点父源表达的IGF2基因编码生长因子IGF2,促进胎盘生长发育; 而母源表达的IGF2r 和H19 基因会直接或间接限制IGF2的表达,从而抑制胎盘发育,减少胎盘重量(表1)[10]。类似的,Phlda2 基因敲除的小鼠胎盘的重量高于平均重量,而敲除RTL1 基因的小鼠则表现为胎盘生长发育迟缓。还有一些基因,例如PEG10 和Mash2,如果敲除这些基因不仅会影响血性绒毛膜胎盘的形成,甚至会导致怀孕中期胚胎致死率的增高[11]。
在很多敲除型突变个体中,胎盘重量上的改变还常伴随着形态学上的变化,从而直接影响胎盘对胎儿营养的供应。例如老鼠胎盘,分为3 个区域: 含有肝糖原细胞的底蜕膜区域,成胶质细胞的分界区域以及包含了3 层滋养层细胞层的迷路区域。其中成胶质细胞具有内分泌作用,而滋养层细胞则是母体-胎儿进行营养物质运输的重要区域。当通过敲除特异印记基因使其表达异常时,这3 个区域的发育则会发生异常。尤其是迷路区域的面积,肝糖原的数目和基因位点以及在厚度和器官膜上的变化,这些都将成为母体和胎儿之间物质循环的障碍[12,13]。这些变化同样会改变一些哺乳动物胎盘的表面积和滋养层中的多血管系统,使成胶质细胞不能正常发育,妨碍胎盘绒毛膜形成[14]。而且交界处总面积的变化和细胞成分上的变化都可以通过母体新陈代谢和对胎儿的营养物质分配直接影响胎儿生长发育,使胎盘的糖原利用和激素生成产生差异,严重影响胎盘正常发育与功能[15,16]。
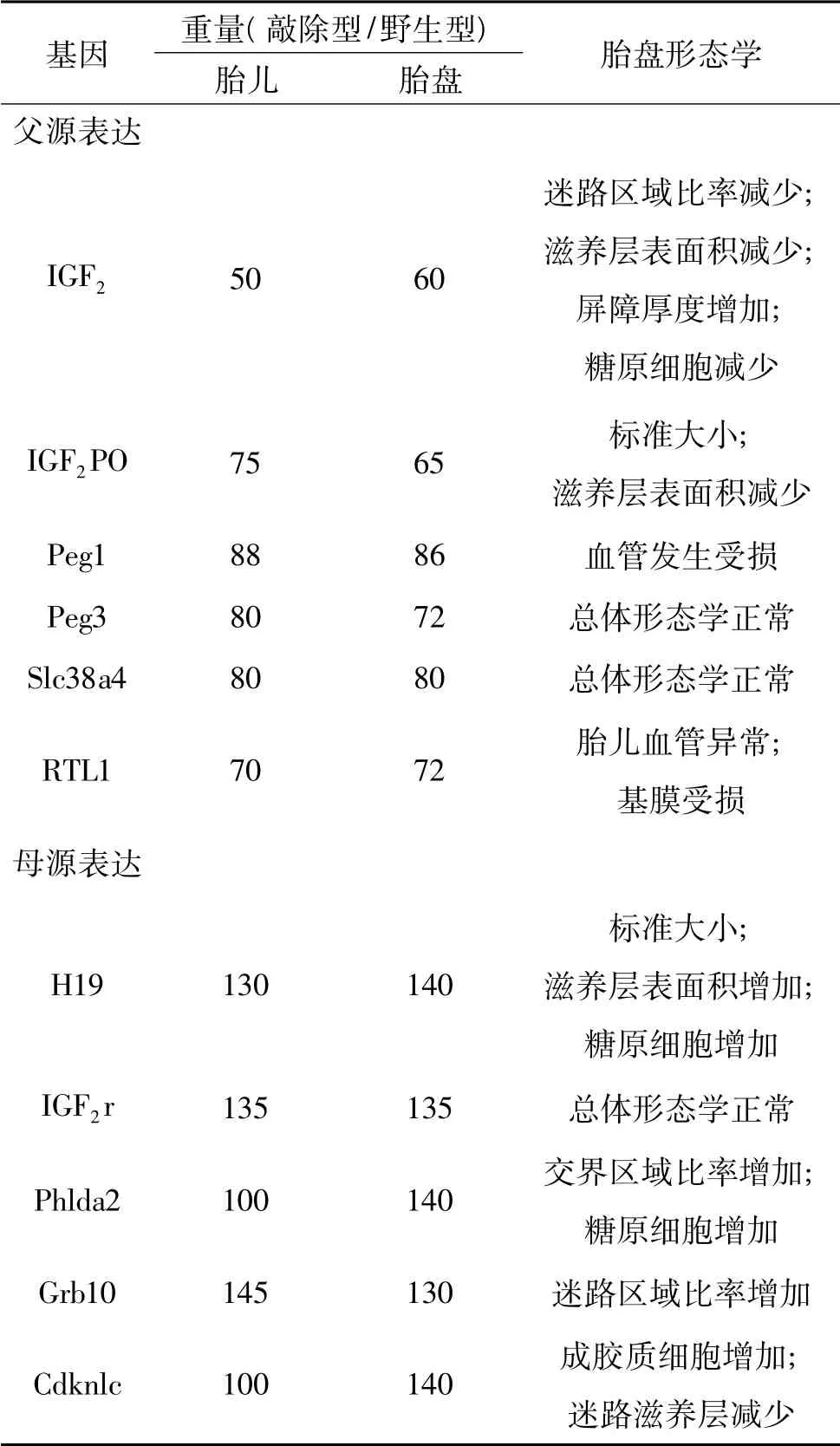
表1 在小鼠怀孕晚期,印记基因对胎儿-胎盘生长及胎盘形态学的作用[1]
3 印记基因与胎盘营养物质的运输
测量营养物质的转运是通过检测在敲除印记基因或印记基因过表达的突变型个体中,胎盘所转运物质的量。与野生型相比,IGF2PO(父源IGF2) 胎盘会转运更多的MeAIB(α-甲氨基异丁酸)[17],它同样转运更多的钙和甲基-D-葡萄糖[18]。在大多数情况下,这些营养物质运输上的改变伴随着胎盘上特异葡萄糖和A 系统氨基酸转运蛋白表达的改变[17]。Sla38a4,父源印记基因,A系统氨基酸转运子亚型,在IGF2完全失效胎盘通过这种基因的减少效应和MeAIB 转运蛋白的正向调节,使X 和Y 氨基酸转运子系统丰裕度减少,这也解释了为何这些突变体宫内发育迟缓[17]。这些发现表明,印记基因在调节胎盘上营养物转运过程中扮演着重要角色。
通常情况下,胎盘厚度上的改变会影响被动扩散性质,而胎盘的通透性则是被动扩散的标记,同时滋养层表面积的变化会影响通过简单扩散和转运蛋白介导转运的营养物的运输过程[19]。例如,在基因表达有缺陷的突变体膜上的甘露糖、EDTA(乙二胺四乙酸) 和菊糖含量减少,导致胎盘或脉管系统的表面积减少,影响物质运输[20,21]。综上,胎盘内印记基因的正常表达以及它们之间的互作对胎盘正常生长发育、生理功能和营养物质运输都是至关重要的。
4 印记基因作为环境诱发表观修饰信号
除了调节胎盘生长发育和营养物质转运之外,胎盘内的印记基因可以迅速感应环境变化进而变更胎盘表型。研究表明,印记基因调控在胎盘环境微干扰中比胚胎或胎儿组织中表现更为敏感,尤其在胚胎植入前改变早期胚胎环境在决定以后胎盘内印记基因表达模式中显得尤为重要[22]。而这些发现与利用体外辅助生殖技术获得人类婴儿的胎盘中印记基因表达混乱的结果一致[23]。
环境诱发改变的印记基因表达与胎盘生长和营养物质运输能力改变有关。对比IGF2PO 和IGF2无效突变体表明,印记基因可以同样对胎儿所需营养做出迅速感应[24,25]。当IGF2只在迷路区域中缺乏时,胎盘变得更加高效,并且可以提高营养物质转运蛋白的丰富性,通过其它表达IGF2的胎儿组织帮助维护其生长[26]。当所有胎儿组织中IGF2的表达均缺乏时,胎盘氨基酸转运蛋白丰富度降低,胎儿相关生长率降低[24]。当胎盘对胎儿正常营养物质的需要和供给不匹配时,IGF2PO 正向表达会增加MeAIB 运输和Slc38a2 氨基酸转运蛋白的表达,这样胎盘会对胎儿生长供给更多,进而可在怀孕后期保证胎儿正常生长率。同样,在Phlda2 过表达的胎盘中,相似的营养供求机制也可以促进正向调节营养物质表达和离子转运蛋白,以保证胎儿生长发育。反过来,在怀孕后期孕体过生长时,胎盘减少的被动通透性和MeAIB 的运输可能反射母源信号,抑制胎盘营养物的支配来调节胎儿生长[20]。由此可见,胎儿和胎盘间印记基因的相互影响不仅与调节营养物分配有关,同样可以应答环境信号。
5 辅助生殖技术(ARTs)和体细胞克隆(NT)引起的胎盘印记异常
ARTs 是近年来迅速发展并已广泛应用于人类和动物,用以尝试校正生育能力损伤的技术,可以提高特殊物种生殖效率,包括体外受精、ICSI 等。虽然它的应用广泛,但是这项技术的使用和体外培养条件会对胚胎造成损伤,因此具有很高的胚胎死亡率。在实验动物中,大多数胚胎由于异常甲基化不能重编程,无法正常发育为胚胎。同时它增加了胎盘异常形态的发病率。这都与印记基因异常表达相关。
动物体细胞克隆是应用显微操作技术将体细胞注入去核的卵母细胞中,再将重构胚移入体内培养,以期成为正常个体。该技术中的去分化和恢复全能性是成功的关键。虽然已经有多种动物通过克隆产生个体,但是克隆动物的存活率低,且存在大量表型异常及不同程度缺陷一直是克隆技术中存在的重要问题[27]。主要表现为克隆动物胚胎和胎盘的过度生长。而这正与许多印记基因表达失调导致的症状相似。体细胞克隆时,供体细胞不适当的表观遗传重编程,如DNA 甲基化,可能是导致体细胞克隆效率低的原因[28]。有证据表明,重编程过程中,一些印记基因会被破坏,导致基因组印记缺陷。而核移植操作和体外培养对卵母细胞和供体细胞造成的损伤及发育异常也会被带到重构胚中,致使印记基因表达异常[29]。例如,在体外培养液中加入血清会干扰DMR 的甲基化和IGF2r 的表达[30]。而基于印记基因对于胎盘正常发育和生理功能的重要作用,在克隆动物中,胎盘及胎儿发育的异常也就不足为怪。因此这也是导致克隆效率低的一个重要因素。
6 结论与展望
不同基因在多样的表观遗传修饰调控下开启或关闭,执行各自的功能。基因组印记就是通过甲基化作用等方式实现对来源于不同亲本的等位基因表达的调控,从而保证各基因的正常表达。胎盘作为对胎儿生长有决定性作用的器官,有许多特异印记基因的表达,这些基因表达调控胎盘的正常发育及结构形成,同时对于胎盘的主动运输能力和转运蛋白的表达有极其重要的作用。这也关系到母体-胎儿之间物质循环,充足的营养转运是保证胎儿发育的首要因素之一。同时,这些基因可以感应周围环境的微小变化并迅速作出反应,平衡母体和胎儿的营养供求。一旦这些基因出现表达上的异常,则会引起胎盘表型上的异常,导致其功能出现异常。因此这些印记基因的正常表达以及协同作用是保证胎盘的生长发育以及行使其生理功能的重要因素。
回顾哺乳动物发育中的几种重要的基因印记作用,确定印记基因在功能健全和胎儿发育中的重要作用。基因印记作用的获得和进化是基础生物学问题之一,不断探索各基因的功能、表达机制以及基因间的互作将成为这一问题研究的必要环节。而且这些印记基因也将成为一些遗传类疾病的治疗靶点,并且可以应用在体外辅助生殖技术中用以改良人类生育及动物繁殖中的一些问题。因此,研究胎盘内印记基因的表达和作用具有重大意义。
[1]A L Fowden,P M Coan,E Angiolini.Imprinted genes and the epigenetic regulation of placental phenotype.Progress in Biophysics and Molecular Biology.2011,281-288.
[2]Katia D,Robert F.Epigenetic regulation of mammalian genomic imprinting.Current Opinion in Genetics & Development,2004,14: 1-8.
[3]Rossant J,Cross JC.Placental development: lessons from mouse mutants.Nat Rev Genet 2001; 2: 538-48.
[4]Partidge L,Hurst L D.Sex and C on flict.Science,1998,281: 2003-2008.
[5]Barker,D.J.P..The malnourished baby and infant.Br.Med.Bull.2001,60,69-88.
[6]张守权.哺乳动物印记基因的研究进展[J].中国生物工程杂志,2003,23: 12.
[7]Dean W,Santos F,Reik W.Epigenetic reprogramming in early mammalian development and following somatic nuclear transfer.Seminars in Cell &Developmental Biology,2003,14: 93-100.
[8]Mayer W,Niveleau A,et al.Demethylation of the zygotic paternal genome.Nature,2000,403: 501-502.
[9]Kagami M,Sekita Y.Deletions and epimutations affecting human 14q32.2 imprinted region in individuals with maternal and paternal upd(14)-like phenotypes.Nat.Genet.2008 40,237-242.
[10]C onstancia M,Hemberger M,et al.Placental-specific IGF-II is a major modulator of placental and fetal growth.Nature,2002,417: 945-948.
[11]F F Bressan,T H C De Bem,F Perecin.Unearthing the Roles of Imprinted Genes in the Placenta.Placenta 30,2009,823-834.
[12]Georgiades P,Ferguson-Smith A C.Comparative developmental anatomy of the murine and human definitive placenta.Placenta,2002,23,3-19.
[13]Watson E D,Cross J C.Development of structures and transport functions in the mouse placenta.Physiology.2005,20,180-193.
[14]Georgiades P,Watkins M,Burton G J.Roles for genomic imprinting and the zyotic genome in placental development.Proc.Natl.Acad.Sci.U.S.A.2001,98,4522-4527.
[15]Lin,Coan P.Differential regulation of imprinting in the murine embryo and placenta by the Dlk1-Dio3 imprinting control region.Development 134,2007,417-426.
[16]Tunster S J,Tycko B.The imprinted Phlda2 gene regulates extraembryonic energy stores.Mol.Cell.Biol.,2010,30,295e306.
[17]Constancia M,Angiolini E.et al.Adaptation of nutrient supply to fetal demand in the mouse involves interaction between the Igf2 gene and placental transporter systems.Proc.Natl.Acad.Sci.U.S.A.2005.102,19219-19224.
[18]Dilworth M R,Kusinski L C,et al.Placental-specific Igf2 knockout mice exhibit hypoclacemia and adaptive changes in placental calcium transport.Proc.Natl.Acad.Sci.U.S.A.2010,107,3894-3899.
[19]Angiolini E,Fowden A L,et al.Regulation of placental efficiency for nutrient transport by imprinted genes.Placenta 27 (Suppl.A) ,Trophoblast Res.2006.S98eS102.,20.
[20]Coan P M,Angiolini E.et al.Adaptations in placental nutrient transfer capacity to meet fetal growth demands depend on placental size in mice.J.Physiol.2008a.586,4567e4576.
[21]Sekita Y,Wagatsuma H,et al.Role of retrotransposon-derived imprinted Rtl1,in thefeto-maternal interface of the mouse placenta.,2008.
[22]Fortier A L,Lopes F L.Superovulationalters the expression of imprinted genes in the mid gestation mouse placenta.Hum.Mol.Genet.,2008,17,1653-1665.
[23]Haycock P C,Ramsay M,Exposure of mouse embryos to ethanol during preimplantation development: effect on DNA methylation in the H19 imprinting control region.Biol.Reprod.2009,81,618e627.
[24]Constancia M,Angiolini E et al.Adaptation of nutrient supply to fetal demand in the mouse involves interaction between the Igf2 gene and placental transporter systems.Proc.Natl.Acad.Sci.U.S.A.,2005,102,19219-19224.
[25]Coan P M,Fowden A L,et al.Disproportionate effects of Igf2 knockout on placental morphology and diffusional exchange characteristics in the mouse.J.Physiol,2008,586,5023-5032.
[26]Constancia M,Hemburger M,et al.Placental-specific IGF2is a major modulator of placental and fetal growth.Nature,2002,417,945-948.
[27]Kubota C,Y amakuchi H,et al.Six cloned calves produced from adult fibroblast cells a fter long 2term culture.Proc Natl Acad Sci(USA) ,2000,97: 990-995.
[28]Dean W,Santos F,Reik W.E pigenetic reprogramming in early mammalian development and following somatic nuclear transfer.Seminars in Cell&Developmental Biology,2003,14: 93-100.
[29]侯晓军,焦丽红.基因组印记对个体发育及动物克隆的影响[J].遗传学报,2005,32(5) : 550-554.
[30]Shi W,Zzkhartchenko V,Wolf E.Epigenetic reprogramming in mammalian nuclear transfer.Differentiation,2003,71(2) : 91-113.
