急性应激大鼠中枢色氨酸羟化酶-2表达变化☆
2012-04-19张盛宇禹顺英汪东祥郑贤杰胡淑楠李霞
张盛宇* 禹顺英* 汪东祥* 郑贤杰胡淑楠李霞
·论 著·
急性应激大鼠中枢色氨酸羟化酶-2表达变化☆
张盛宇* 禹顺英* 汪东祥* 郑贤杰△胡淑楠△李霞
【摘要】目的 探讨急性应激大鼠各脑区五羟色胺合成通路中色氨酸羟化酶-2(Tryptophan hydroxylase-2,TPH2)的作用机制。方法采用电击诱导应激模型,将16只SD大鼠随机分为实验组与对照组,每组8只,实验组每天上午予以40 min的电击诱导1次持续3天,建模后采用旷场试验评价大鼠行为;安乐处死,取血液及脑组织(海马、前额叶、中缝核及纹状体)低温保存后采用采用实时荧光定量PCR(Real-TimePCR)检测外周血及各脑区的TPH2mRNA的表达。结果 经3天电击诱导后,实验组大鼠活动明显减少,与对照组行为学数据有显著性差异(P<0.05)。实验组海马(0.914±0.513 vs 3.640±2.836)、中缝核(0.484±0.374 vs 2.685±2.662)TPH2mRNA表达升高(P均 <0.05);外周血、前额叶、纹状体TPH2mRNA表达两组比较无统计学差异(P>0.05)。结论 急性应激大鼠在中枢海马、中缝核TPH2mRNA的表达显著增加,前额叶、纹状体与外周血无显著变化。
【关键词】大鼠 急性应激模型 抑郁症 色氨酸羟化酶-2
抑郁症是一种常见的精神疾病,据世界卫生组织、世界银行和哈佛大学的一项联合研究表明,到2020年单向抑郁症将达到全球疾病负担的第二位[1]。抑郁症的病因学尚不明确,其中中枢五羟色胺(5-hydroxytryptamine,5-HT)功能低下是抑郁症生化机理中较公认的假说。色氨酸羟化酶(Tryptophan hydroxylase,TPH)作为5-HT合成过程中的限速酶,调节5-HT的生成,是五羟色胺合成通路中非常重要的环节。TPH基因有TPH1和TPH2两种亚型,研究发现TPH2基因仅特异地表达于中枢,脑干的TPH2mRNA水平约为TPH1mRNA的150倍,提示TPH2在中枢神经5-HT的合成中起到重要作用[2]。中枢5-HT水平受很多因素的影响,包括合成、代谢和转运等。抑郁症中枢5-HT水平改变是否在合成环节中受到TPH2调控并没有明确的定论。本研究运用逆转录聚合酶链反应,检测急性应激模型大鼠大脑海马、前额叶、纹状体、中缝核及外周血TPH2的mRNA表达情况,探讨TPH2在抑郁症的病理机制中的作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 成年雄性Sprague-Dawley(SD)大鼠由华东师范大学实验动物科学部提供,封闭群属,清洁级,SCXK(沪)2010-0002,6~8周龄,体重200~250 g/只。
1.1.2 主要试剂 RevertAidTMFirst Strand cDNA Synthesis Kit逆转录试剂盒(美国Fermenias公司),Real-Time PCR探针,Assays ID: Rn00598017_m1(Taqman公司设计的探针)。
1.2 方法
1.2.1 大鼠分组 聚碳酸酯饲养笼饲养,每笼3~4只,自由摄食进水,维持周期12 h的昼夜节律(光照时间7:00~19:00 h),饲养室温度(22±1)℃,相对湿度50%,适应饲养环境1周后开始实验。选择16只大鼠随机分为实验组与对照组,每组8只。
1.2.2 动物模型的建立 建模方法电击诱导抑郁模型[3],实验组大鼠每天按编号顺序依次进行一次足部电击,足部电击电流为0.8 mA,间歇性电击3~6 s电击/2~8 s非电击,电击总时长40 min,持续三天;对照组正常饲养三天。予以旷场试验检测两组大鼠行为学指标。
1.2.3 组织取材与样品制备 行为学测试结束后将所有大鼠后处安乐死,取血样与脑组织,用解剖镜在冰面上分离双侧海马、中缝核、前额叶、纹状体,液氮冻存,以备逆转录聚合酶链反应检测使用。
1.2.4 基因表达的检测 将冻存脑组织匀浆仪匀浆,血液离心后取粒细胞,加入800 μL Trizol保存,并转移至1.5 mL EP管中,充分混匀,室温静置15 min。采用Trizol法提取RNA,然后用逆转录试剂盒进行逆转录反应将mRNA逆转录为cDNA,采用实时荧光定量PCR(Real-TimePCR)检测外周血及各脑区的TPH2mRNA的表达。反应程序为:①预变性:50℃孵化 2 min,95℃预变性 10 min;②PCR反应:95℃变性15 s,58℃退火1 min,40个循环;③溶解曲线生成:95℃预变性1 min,55℃退火1 min,55℃退火10 s并以每循环增加0.5℃的温度进行80个循环。使用Sequence Detector Software(SDS) version 2.1软件 (Applied Biosystems,CA,USA)实时收集荧光信号,然后应用比较Ct值(Comparative Ct Values,△Ct)方法计算TPH2基因的相对表达量。
1.3 统计学处理 采用SPSS 13.0进行统计分析。数据采用均数±标准差(±s)来描述。对所获数据进行正态性检验,正态性数据采用独立样本t检验;非正态分布数据采用独立样本秩和检验。对相关分析,正态分布数据采用Pearson相关分析,偏态数据采用Spearman相关分析,显著性水平P<0.05。
2 结果
2.1 实验组与对照组大鼠行为学比较 大鼠旷场试验各行为学数据呈正态分布(P>0.05);经3 d电击诱导后,实验组大鼠活动明显减少,与对照组比较,经t检验,总移动距离 (t=3.043,P=0.009)、总移动时间(t=3.308,P=0.005)、头动总距离(t=3.930,P=0.002)、总越限次数(t=2.761,P=0.015)与总转身次数(t=2.504,P=0.025)差异均有统计学意义。详见表1。
2.2 实验组与对照组大鼠外周与中枢TPH2mRNA表达比较 TPH2mRNA在外周血、海马、中缝核、前额叶与纹状体中均有表达,且均可被检测,详见图1。TPH2mRNA在外周血、海马、中缝核、前额叶与纹状体中表达检测值均呈非正态分布(P<0.05)。与对照组比较,经Mann-Whilney U检验,实验组海马(Z=-2.100,P=0.036)、中缝核TPH2mRNA表达(Z=-1.995,P=0.046)上升有统计学意义。前额叶(Z=-1.279,P=0.201)、纹状体(Z=-0.525,P=0.600)及外周血(Z=-1.314,P=0.195)与对照驵相比差异无统计学意义。详见表2。
2.3 实验组大鼠行为学指标与中枢TPH2mRNA表达相关性分析 实验组大鼠在移动总时间、移动总里程、总越限次数、头动总距离、总转身次数的行为学数据与外周血及大脑各区TPH2mRNA表达均无相关(相关系数r范围-0.491到0.368,均P>0.05)。
表1 电击诱导后实验组与对照组大鼠行为学比较(±s)
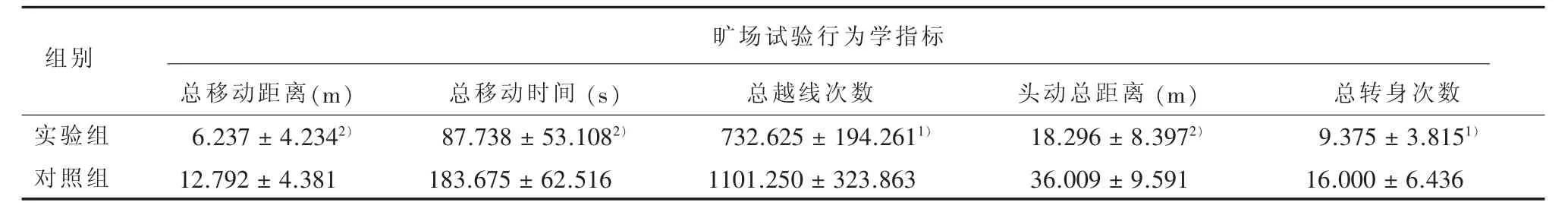
表1 电击诱导后实验组与对照组大鼠行为学比较(±s)
1)与对照组相比,经t检验,P<0.052)与对照组相比,经t检验,P<0.01
旷场试验行为学指标组别实验组对照组总移动距离(m)6.237±4.2342)12.792±4.381总移动时间 (s)87.738±53.1082)183.675±62.516总越线次数732.625±194.2611)1101.250±323.863头动总距离(m)18.296±8.3972)36.009±9.591总转身次数9.375±3.8151)16.000±6.436
表2 电击诱导后对照组与实验组大鼠TPH2 mRNA表达比较(±s)
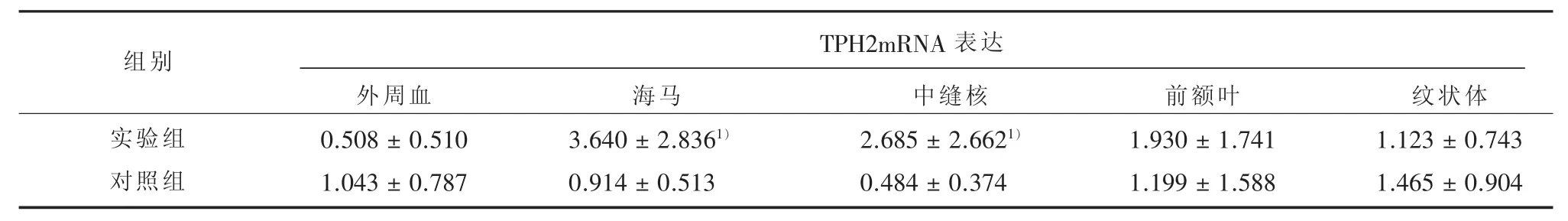
表2 电击诱导后对照组与实验组大鼠TPH2 mRNA表达比较(±s)
1)与对照组相比,经Mann-whilney U检验,P<0.05
TPH2mRNA表达组别实验组对照组外周血0.508±0.510 1.043±0.787海马3.640±2.8361)0.914±0.513中缝核2.685±2.6621)0.484±0.374前额叶1.930±1.741 1.199±1.588纹状体1.123±0.743 1.465±0.904
图1 大鼠TPH2mRNA值在组织中的表达经PCR扩增显示稳定可靠
3 讨论
抑郁症被认为一种应激相关性疾病,研究发现单次和重复应激都能增加海马5-HT的释放和代谢[4]。本研究使用连续3 d天电击作为应激方式,建立急性应激模型。其理论基础为,让动物在短时间内处于不可逃避的应激刺激,并感知到这种刺激的无法控制时,便会出现类似人类的绝望、无力、悲观等行为学特征[5]。在经过3 d电击刺激后,实验组大鼠活动明显减少,与对照组相比各项旷场试验行为学数据都有显著性差异,出现了“类抑郁行为”。
中枢水平5-HT合成基本上依赖TPH2的水平。TPH2的水平取决于其合成过程中基因的转录,蛋白的翻译,以及酶的活性等方面。在对于各个脑区TPH2mRNA表达的检测中发现,实验组TPH2mRNA表达在海马、中缝核较对照组有所增加,反应了在连续3 d的电击诱导后,TPH2基因转录水平增强。国外也有文献报道在行为绝望抑郁模型大鼠(即强迫游泳试验)刺激后24 h大鼠中枢检测中发现,大鼠下丘脑和杏仁核的5-HT和其代谢产物五羟色胺酸浓度显著下降,中缝核TPH2mRNA水平上升[6]。推测TPH2mRNA表达的上升是急性应激状态下中枢五羟色胺下降后的代偿的反应。由此可以进一步推测,急性应激后5-HT水平的下降可能并不是由TPH2调控的合成通路所造成的,相反5-HT水平的下降促使了TPH2mRNA的表达,从而合成5-HT来弥补其水平的不足。另外,国内文献报道,慢性不可预见性应激模型大鼠中枢海马与中缝核5-HT水平及TPH2mRNA表达下降[7]。对于急、慢性抑郁模型中枢TPH2mRNA表达出现截然不同的结果,推测慢性应激模型TPH2mRNA表达下降可能是中枢5-HT下降后失代偿的结果。
TPH2在中缝核5-HT神经元和外周的肠肌间神经元有显著表达[8]。大鼠研究目前证实TPH2在脑中有特异性表达[9]。外周血TPH2与中枢TPH2有无关联目前尚无定论。国外有研究发现TPH2基因敲除大鼠和TPH2/TPH1基因双重敲除的大鼠中枢5-HT水平显著下降;TPH2/TPH1基因双重敲除的大鼠外周5-HT显著下降,但是TPH2基因敲除大鼠外周5-HT水平无差异[10],这提示了中枢 5-HT水平主要由TPH2调控,外周5-HT水平与TPH2无关。本研究实验组与对照组在外周血粒细胞TPH2mRNA表达未显示明显差异,外周血TPH2的mRNA表达与动物的旷场行为间也未显示相关,提示外周血粒细胞TPH2mRNA表达不能作为急性应激所致抑郁的外周生物学标记。
5-HT作为中枢一种抑制性神经递质,参与实现多个系统的生理功能,包括情绪控制、睡眠节律、疼痛感受、食物摄取及性行为等[11]。TPH2作为5-HT合成的限速酶,其水平的变化也会影响动物的认知及行为。国外一项研究发现TPH2基因是风险选择行为测试的一个特质因素[12]。对于小鼠实验研究发现中枢TPH2低活性小鼠攻击性下降,强迫游泳表现差,但在旷场试验中无明显变化[13]。另有研究发现雄性TPH2基因敲除小鼠在旷场试验中移动总里程及中央区时间显著低于对照组[14]。此外,Hiroi等人发现大鼠中锋背核延髓背内侧TPH2mRNA表达与焦虑样行为相关[15]。本研究发现旷场试验行为学数据与中缝核、海马TPH2mRNA表达均无相关(均P>0.05)。其原因可能为旷场试验的行为学太过简单,在今后研究中可以加入其他行为学及认知测试加以完善。
中枢5-HT水平受包括合成、代谢和转运等多方面的影响,本研究只观察了合成环节中TPH mRNA的变化,仅仅反映可急性大鼠中枢TPH2合成中基因转录的情况,但并不没有对TPH2酶的活性进行测定,此外研究未能同步检测中枢的5-HT及其代谢物的水平,将在以后的研究中进一步的完善。
参考文献
[1] 王祖承.精神病学[M].北京人民卫生出版社,2002,2:112-125.
[2]Cote F,Thevenot E,Fligny C,et al.Disruption of the nonneuronal tph1 gene demonstrates the importance of peripheral serotonin in cardiac function[J].Proc Natl Acad Sci USA,2003,100(23):13525-13530.
[3]Dwivedi Y,Mondal AC,Shukla PK,et al.Altered Protein Kinase A in Brain of Learned Helpless Rats: Effects of Acute and Repeated Stress[J].Biol Psychiatry,2004,56(1):30-40.
[4] 周建松,曹霞,李凌江,等.重复应激对5-羟色胺耗竭大鼠海马皮质类固醇受体表达的影响[J].中国神经精神疾病杂志,2010,36(3):173-175.
[5]Porsolt RD,Martin P,Lenegre A,et al.Effects of an extract of Ginkgo Biloba(EGB 761)on"learned helplessness"and other models of stress in rodents[J].Pharmacol Biochem Behav,1990,36(4):963-971.
[6]Shishkina GT, Kalinina TS, Dygalo NN, et al.Serotonergic changes produced by repeated exposure to forced swimming:correlation with behavior[J].Ann N Y Acad Sci,2008,1148:148-153.
[7] 肖爱娇,韩志芬,黄景斌.抑郁大鼠海马5-羟色胺含量及中缝核色氨酸羟化酶-2表达变化研究[J].中华精神科杂志,2008,41(3):180-183.
[8]Walther DJ,Peter JU,Bashammakh S,et al.Synthesis of serotonin by a second tryptophan hydroxylase isoformp[J].Science,2003,299(5603):76.
[9]Patel PD,Pontrello C,Burke S,et al.Robust and tissue-specific expression of TPH2 versus TPH1 in rat raphe and pineal gland[J].Biol Psychiatry,2004,55(4):428-433.
[10]Hiroi R,McDevitt RA,Morcos PA,et al.Overexpression or knockdown of rat tryptophan hyroxylase-2 has opposing effects on anxiety behavior in an estrogen-dependent manner[J].Neuroscience,2011,176:120-131.
[11]Kranz GS,Kasper S,Lanzenberger R.Reward and the serotonergic system[J].Neuroscience,2010,166(4):1023-35.
[12]Juhasz G,Downey D,Hinvest N,et al.Risk-taking behavior in a gambling task associated with variations in the tryptophan hydroxylase 2 gene:relevance to psychiatric disorders[J].Neuropsychopharmacology,2010,35(5):1109-1119.
[13]Osipova DV,Kulikov AV,Popova NK.C1473G polymorphism in mouse tph2 gene is linked to tryptophan hydroxylase-2 activity in the brain,intermale aggression,and depressive-like behavior in the forced swim test[J].J Neurosci Res,2009,87(5):1168-1174.
[14]Savelieva KV,Zhao S,Pogorelov VM,et al.Genetic disruption of both tryptophan hydroxylase genes dramatically reduces serotonin and affects behavior in models sensitive to antidepressants[J].PLoS One,2008,3(10):e3301.
[15]Hiroi R,McDevitt RA,Neumaier JF.Estrogen selectively increases tryptophan hydroxylase-2 mRNA expression in distinct subregions of rat midbrain raphe nucleus: association between gene expression and anxiety behavior in the open field[J].Biol Psychiatry,2006,60(3):288-295.
(责任编辑:文飞)
* 上海交通大学附属精神卫生中心(上海 200030)
△华东师范大学
【中图分类号】R749.4
【文献标识码】A
收稿日期:(2012-01-03)
doi:10.3969/j.issn.1002-0152.2012.08.013
项目基金☆号:国家自然科学青年基金(编号:81101007);上海市科委医学引导类项目 (编号:09411965600)
通讯作者(Email:ja_1023@yahoo.com.cn)
