钙磷对酸铝胁迫后紫花苜蓿-根瘤菌体系结瘤固氮的修复效应
2012-04-12王晓锋罗珍刘晓燕朱丹夏志强周建华张磊
王晓锋,罗珍,刘晓燕,朱丹,夏志强,周建华,张磊
(西南大学资源环境学院,重庆 北碚400715)
*全世界约39.5亿hm2土壤属于酸性土壤,占耕地和潜在可耕地的50%以上[1]。2000年初,我国酸性土壤总面积为2.03×107hm2,占全国土地总面积的21%[2]。由于气候和长期施用化肥等原因,酸性土壤及其酸度存在扩大和恶化的趋势。同时,我国酸雨分布区与酸性土壤分布区重叠,也加剧了我国南方土壤的酸化进度,严重影响南方种植业及其相关产业的发展。在酸性土壤中,铝离子从硅酸盐或氧化物中释放出来,溶解到土壤溶液中而对植物产生的毒害作用[3],已经成为一个世界性的限制酸性土壤上作物产量的主要因子。紫花苜蓿(Medicagosativa,俗称alfalfa)是一种营养丰富的优良牧草,具共生固氮能力,根系非常发达,能有效防止雨水的冲刷,是理想的水土保持植物[4],扩大其种植已被列入国家重大规划项目。但是,紫花苜蓿是对酸性土壤条件最为敏感的植物之一[5],酸性土壤的铝毒胁迫更加限制了苜蓿的北草南引。因此,有必要建立高效耐酸铝的豆科植物-根瘤菌共生体系,并结合物理化学手段,提高苜蓿耐受酸性土壤及其铝毒胁迫的能力。
铝毒(aluminum toxicity)对植物的毒性及其作用机理已有过许多报道[6-9]。对豆科植物而言,酸铝胁迫不仅影响根瘤菌与宿主植物的接触,而且限制根瘤菌结瘤因子(nod factor)的产生、宿主根毛去极化以及结瘤基因的表达[10,11]。进一步地,铝离子交换量占土壤中阳离子交换总量的20%~80%,土壤溶液中过剩的铝离子容易导致土壤阳离子流失,造成磷、钙、钼等营养元素缺乏[12]。研究表明,施钙[13,14]和磷矿粉[15]能够有效地缓解铝毒。目前大部分相关研究都只对单独施用钙或磷以缓解铝毒的效应进行探讨,对同时补充钙和磷的缓解效应鲜有报道。酸铝胁迫主要对幼苗根系作用,而且毒害效应很快,研究钙、磷对酸铝胁迫之后豆科作物及其共生固氮性能的修复效应具有一定实践意义。
许多细菌能够通过小的可扩散的信号分子感知细胞密度和调控其各生理功能,该过程即“群体感应”(quorum sensing,简称QS)[16]。豆科根瘤菌(Rhizobium)的群体感应调控系统被证明会影响其生长和共生固氮[17]。根瘤菌与豆科宿主植物间共生关系的形成是宿主和根瘤菌间复杂的信号释放和识别的结果[18,19],该识别过程首先引起大量根瘤菌在植物根系聚集,而细胞密度的增加受群体感应调控,是一种重要的信号感应过程[20]。据报导,苜蓿根瘤菌(Sinorhizobiummeliloti)的群体感应系统可能会影响结瘤数目和共生过程[21];苜蓿中华根瘤菌的群体感应系统控制胞外多糖EPSⅡ的产生,该多糖与根瘤的形成过程有关[22]。关于酸铝胁迫对紫花苜蓿共生结瘤的影响已有一些研究报道[23,24]。在此基础上,本研究从固氮酶活性、根毛变形、结瘤动力学等角度,探索钙、磷恢复酸铝胁迫后紫花苜蓿-根瘤菌共生固氮能力的效应,并从群体感应这一化学行为入手,初步探讨修复机理。
1 材料与方法
1.1 试验材料
紫花苜蓿为三得利紫花苜蓿(Medicagosativacv.Sanditi),购自江苏省连云港草业中心。苜蓿根瘤菌91522为本研究室分离获得,能在p H 4.8的YMA固体培养基上正常生长并能使紫花苜蓿植株结瘤,是一株耐酸根瘤菌[25-27]。根瘤菌培养基采用改进的 YMA 培养基:甘露醇10 g,酵母浸出粉5 g,NaCl 0.1 g,MgSO4·7H2O 0.2 g,K2HPO40.5 g[28]。供试Ca2+为分析纯CaCl2,P素为 Na H2PO4。
自体诱导物(autoinducers,AI)高效检测菌株KYC55由南京农业大学朱军教授馈赠。检测菌株采用改进的AT培养基:50 m L AT盐,50 m L AT buffer,10 m L 50%葡萄糖,890 m L H2O[AT盐:40 g(NH4)2SO4,1.56 g MgSO4,0.152 g CaCl2,0.1 g FeSO4·7 H2O,0.044 g MnSO4·H2O,1 L H2O;AT buffer:214 g KH2PO4,定容1 L,KOH调节p H=7.3;50%葡萄糖:消毒,常温保存]。
1.2 试验方法
1.2.1 紫花苜蓿无菌幼苗及苜蓿根瘤菌91522的培养 紫花苜蓿种子幼苗准备:先用95%乙醇浸泡5 min,再用0.1%HgCl2溶液灭菌6~10 min,无菌水冲洗5~6次,播种于灭菌的滤纸上[28],于(28±1)℃下暗培养1 d,再于(28±1)℃、16 h的光照下萌发2 d(用于根毛变形率检测)和5 d(用于结瘤检测)。
苜蓿根瘤菌91522的培养:取生长于p H 4.8斜面的供试菌株各1支,用5 m L无菌水洗下菌体,取1 m L接种于100 m L中性YMA培养液中进行快速培养复活,置于28℃恒温震荡器中培养24 h,调节其OD600值约为1.0。
1.2.2 紫花苜蓿结瘤试验 试验于2011年10-12月,在西南大学温室内进行。用2 L不透明塑料桶作培养钵,每盆注入用无菌水配制的Fahraeus无氮营养液1 000 m L[14],营养液含 AlCl3浓度为20μmol/L[24],以HAc-Na Ac缓冲液调节溶液p H为4.8,取正常生长5 d的苜蓿幼苗分散固定在漂浮盘上,培养于各处理营养液中,每盆10株。同时,每盆中接种新培养的苜蓿根瘤菌9 1 5 2 2菌液1 0 m L。处理8 d后进行钙、磷处理。钙、磷水平如表1,每个处理设置3个重复;所有处理均在(28±1)℃、光照/黑暗为16 h/8 h条件下培养,期间每天通气20 min,每周调节p H并补充营养液。从接入苜蓿根瘤菌91522开始起,前20 d每天观察苜蓿根系结瘤情况,之后每2 d观察结瘤,记录现瘤日期和10株苜蓿各阶段结瘤总数,培养60 d后收获,统计最终结瘤率。
培养结束后,取出植株,剪掉地上部分,将结瘤的根系分别剪开。主根上的瘤子可用剥皮法取下,侧根瘤要带少量根剪断,收集到150 m L血清瓶内,盖上反口胶塞,立刻按瓶子体积用注射器注入占体积10%的C2H2,28℃保温1 h。然后用注射器吸出一定体积的混合气体,用气相色谱仪测定C2H4产生量,获得固氮酶活性。
将培养液通过真空泵进行抽滤,除去水体中的杂物或杂质,然后用等量的酸化乙酸乙酯(含0.5%的甲酸)提取,收集的有机相用旋转蒸发仪蒸发至剩余4 m L左右,溶于一定量的甲醇中,-20℃保存作自体诱导物N-乙酰高丝氨酸内酯(AHLs)测定。

表1 水培条件不同钙、磷水平试验设计表Table 1 Design of different Ca2+and P levels
1.2.3 紫花苜蓿根毛变形试验 试验于2011年11月进行。分别设置酸铝胁迫条件为p H=4.8和铝浓度20 μmol/L和含钙、磷水平如表1的Fahraeus营养液,装于不透明塑料杯中,100 m L/杯。将在Fahraeus无氮营养液中培养的苜蓿幼苗(在人工气候箱中培养2 d,根长3 cm左右)15株根浸入酸铝营养液中处理24 h,之后将幼苗移入含钙、磷的营养液中,并接种根瘤菌(菌株91522,OD600=1.0)1 m L,培养24和48 h后用0.5 mmol/L CaCl2洗根,滤纸吸干后用倒置显微镜镜检根毛变形,每个处理设置3个重复。分别统计根毛总数和变形根毛数,计算根毛变形率[24]。

1.2.4 测定方法 群体感应测定:β-半乳糖苷酶活法检测自体诱导物活性,按照Zhu等[29]的方法进行操作,将检测菌株KYC55在不含抗生素的新鲜AT培养基培养至OD600=0.5左右,摇匀,分装到1.5 m L离心管中,加入150μL AHLs粗提液后摇匀,28℃过夜培养,约14 h;吸取200μL上述菌液加入到2 m L无菌离心管,然后依次加入0.8 m L Z-buffer,50μL 0.1%SDS,150μL氯仿,剧烈振荡10 s后,加入100μL 4 mg/m L的邻硝基苯-β-D半乳糖苷(ONPG),摇匀,待变黄后加入600μL Na2CO3(1 mol/L)终止反应,记变色时间;4 000 r/min离心5 min后,以新鲜培养基作阴性对照,分别测定上清液OD420和OD600;根据变色时间,计算β-半乳糖苷酶的活性。计算公式如下:

式中,T0表示起始时间;TS表示变色时间。
固氮酶酶活性测定主要参考张国霞等[30]的方法,采用气相色谱测定根瘤还原乙炔为乙烯的量。
1.3 数据处理
原始数据在Excel中进行标准化处理,应用SPSS 17.0软件对试验数据进行方差分析,5%水平下LSD多重比较各处理平均值之间的差异显著性。
2 结果与分析
2.1 钙磷交互作用对酸铝胁迫后苜蓿结瘤的影响
2.1.1 钙磷交互作用对酸铝胁迫后紫花苜蓿结瘤的恢复效果 酸铝胁迫降低苜蓿结瘤率至36.67%。施加不同浓度P素能够提高结瘤率,但不显著(表2);10 mmol/L Ca2+可以将结瘤率提高到80.00%;在5和10 mmol/L Ca2+下,均表现出4μmol/L P素处理优于30μmol/L处理。

表2 不同钙磷处理对酸铝胁迫下紫花苜蓿结瘤的影响Table 2 Effects of Ca2+and P on nodulation of M.sativa under acid and aluminum stresses
4μmol/L P能够显著提高苜蓿结瘤总数,高浓度P(30μmol/L)则表现出一定的抑制作用;施加Ca2+后结瘤总数显著提高,在处理浓度范围内,Ca2+浓度越高,其影响越显著,10 mmol/L Ca2+的最高,较不施钙条件下结瘤数提高了207.5%;在同一Ca2+水平下,4μmol/L P素处理结瘤总数显著高于0和30μmol/L,Ca2+10 mmol/L和P 4μmol/L处理下结瘤总数比无钙磷处理提高了247.1%。
在酸铝胁迫条件下,紫花苜蓿结瘤鲜重为38.4 mg/株,施加一定量P对瘤鲜重具有一定促进作用,但提高不显著;Ca2+能够显著提高瘤鲜重,而且高浓度Ca2+效果优于低浓度,10 mmol/L Ca2+下瘤鲜重比不施钙磷处理提高了183.1%。钙磷交互作用表现为同一Ca2+水平下,4μmol/L P处理瘤鲜重均高于无P和高P(30 μmol/L)处理,Ca2+10 mmol/L和P 4μmol/L条件下苜蓿瘤鲜重较无钙磷处理提高了254.7%。
在酸铝胁迫处理1周后接种耐酸根瘤菌91522,紫花苜蓿现瘤时间为26 d,胁迫后只加入P,现瘤时间比对照提前了4~5 d;胁迫后施入不同浓度的Ca2+能够使现瘤时间提前9~12 d,表现出良好的恢复效果;Ca2+、P交互作用下,10 mmol/L Ca2+和4μmol/L P处理苜蓿现瘤时间可提前至14 d。
2.1.2 钙磷交互作用对酸铝胁迫后紫花苜蓿根瘤菌结瘤动力学曲线的影响 图1为统计各处理10株苜蓿结瘤总数构建的结瘤动力学曲线,结瘤过程可分为现瘤期(14~26 d)、结瘤中期(26~38 d)和平台期(38~60 d)。酸铝胁迫条件下,紫花苜蓿在接种根瘤菌后26 d出现结瘤,补充适当的P素现瘤时间提前到20~22 d(图1),补充不同浓度Ca2+后现瘤时间提前到14~17 d,比无钙磷处理提前了9~12 d(图1);施加P和Ca2+对同期结瘤数均有促进(图1),其中P素作用不显著,Ca2+作用从现瘤起就表现出显著效果,而且Ca2+10 mmol/L对同期结瘤数增效显著高于Ca2+5 mmol/L处理。Ca2+5 mmol/L 条 件 下,施 加 P 4 μmol/L对同期结瘤数影响显著,P 30μmol/L作用与不施磷相似;Ca2+10 mmol/L条件下,P 4μmol/L处理在结瘤中期对同期结瘤数有显著提高,而P 30 μmol/L并未表现出促进作用。比较同水平P素条件下施加Ca2+后结瘤动力学曲线的变化,随Ca2+浓度的提高,同时期结瘤数相应提高。
单独补充Ca2+条件下,10 mmol/L处理现瘤时间比5 mmol/L处理提前3~5 d,在14~30 d结瘤数提高程度高于30 d之后(图1);在P 4μmol/L条件下补充Ca2+,其促进作用贯穿整个培养过程,且促进程度稳定;P 30μmol/L条件下补充Ca2+5 mmol/L后,结瘤数增加程度有限,且至38 d达到平台期,补充Ca2+10 mmol/L在中期有一段停滞期,总体的增加程度不如P 4μmol/L。
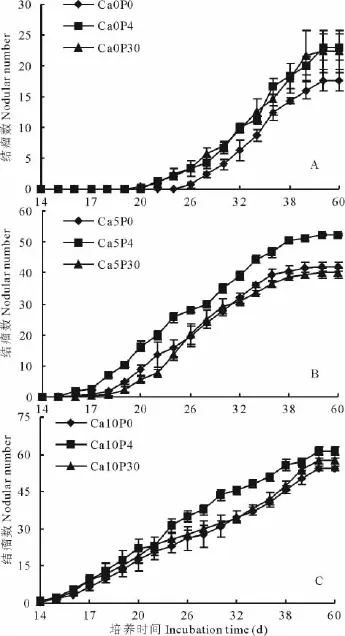
图1 不同Ca2+、P交互对酸铝胁迫条件下紫花苜蓿结瘤(个/10株)动力学曲线的影响Fig.1 Effects of Ca2+ and P on dynamic curves of nodulation(No./10 plant)on M.sativa under acid and aluminum stresses
2.2 根毛变形
酸铝胁迫处理后,仅接种苜蓿根瘤菌91522处理,24 h苜蓿根毛没有发生变形,不同浓度P素处理下少量根毛出现变形;Ca2+处理下根毛变形率显著提高,而且效果随Ca2+浓度增加而显著提高。
接种苜蓿根瘤菌91522 48 h后,3.3%的苜蓿根毛发生变形,而且发生变形的根毛数量表现出随Ca2+、P浓度提高而升高,但与P 0μmol/L处理相比,P素处理没有显著差异。Ca2+显著提高根毛变形率,Ca2+10 mmol/L处理的根毛变形率显著高于5 mmol/L处理。Ca2+、P处理存在交互效应(图2):在Ca2+5 mmol/L条件下,添加P素根毛变形率显著高于无P处理,Ca2+10 mmol/L时,添加P素处理根毛变形较无P处理有所提高,但不显著。可见,P素在低钙(5 mmol/L)条件下对根毛变形的修复效果好于高钙(10 mmol/L)条件。在Ca2+存在时,P素30μmol/L对根毛变形反而有抑制作用,不利于对根毛变形的修复。
2.3 群体感应QS
β-半乳糖苷酶活性代表60 d培养结束后营养液中AHLs活性(图3),即群体感应强度。不同浓度P素处理的群体感应强度没有显著差异,维持在40 Miller Units左右;加Ca2+处理下群体感应强度显著高于零钙处理,Ca2+5和10 mmol/L处理比Ca2+0 mmol/L群体感应强度分别提高了85.04%和75.43%;在同浓度Ca2+处理中,施加P素群体感应强度均表现为P 0μmol/L<P 30μmol/L<P 4μmol/L,但没有显著差异,其中以Ca2+5 mmol/L和P 4μmol/L处理群体感应强度最高,该条件下苜蓿根瘤菌91522自体诱导物的分泌显著恢复和增加,进而促进修复苜蓿、根瘤菌的信息交流。
2.4 固氮酶活性
本试验中对不同处理下根瘤固氮酶活性进行检测。与不加Ca2+、P处理相比,P处理对酸铝毒害下紫花苜蓿根瘤固氮酶活性具有显著的恢复效应,P 30μmol/L处理固氮酶活性高于P 4μmol/L,但是没有显著差异(图4);Ca2+也能够显著恢复固氮酶活性,但10 mmol/L Ca2+显著低于5 mmol/L Ca2+处理,可见,Ca2+对酸铝胁迫之后苜蓿根瘤固氮酶活性的恢复具有显著作用,而高浓度Ca2+并不利于固氮酶活性的提高;在相同Ca2+浓度处理下,补充P素固氮酶活性较无P素处理均有提高,而且低磷(4μmol/L)处理效果显著。

图2 不同Ca2+、P交互对酸铝胁迫条件下紫花苜蓿根毛变形率的影响Fig.2 Effects of Ca2+ and P on hair deformation rate of M.sativa after acid and aluminum stresses
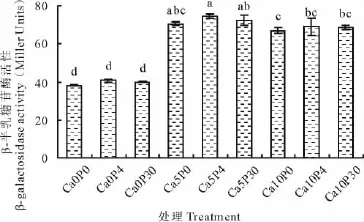
图3 不同钙磷交互处理对酸铝胁迫下苜蓿根瘤菌91522群体感应的影响Fig.3 Effects of Ca2+ and P on QS of S.meliloti under acid and aluminum stresses

图4 不同钙磷交互处理对酸铝胁迫下苜蓿根瘤固氮酶活性的影响Fig.4 Effects of Ca2+ and P on nitrogenase activity of S.meliloti under acid and aluminum stresses
3 讨论
酸铝胁迫条件下,Ca2+、P吸收受阻成为限制豆科植物结瘤固氮的重要原因。本研究对酸铝胁迫7~8 d后的苜蓿根瘤菌91522和紫花苜蓿进行Ca2+、P处理,结果表明Ca2+能够显著促进酸铝胁迫后苜蓿与耐酸根瘤菌的结瘤,缓解胁迫对结瘤过程的限制,提高结瘤率、结瘤总数以及瘤鲜重,而且随Ca2+浓度的提高,对紫花苜蓿结瘤过程的修复效果越显著。Ca2+在缓解酸铝对苜蓿根瘤菌91522结瘤固氮中效果显著;Ca2+、P处理的修复效果有交互作用,适当的P素(4μmol/L)可以在Ca2+基础上进一步提高结瘤效果,对受到酸铝胁迫后紫花苜蓿结瘤能力有良好的修复效果。一般对豆科植物而言,Ca2+被认为是结瘤因子信号转导途中的第二信使[31]。当根毛接触结瘤因子之后,胞内Ca2+通过细胞质膜上的配位体-通道释放出来,耦合IIA型钙离子泵形成Ca2+循环,引起结瘤基因被激活[32]。另外,磷素能够通过影响豆科作物的生长间接影响根瘤的形成和生长[33],或是直接参与根瘤的形成和共生固氮[34-38]。所以 Ca2+、P缓解铝毒害的作用得到共识[13,14,15,25],然而往往忽略了 Ca2+、P素对遭受酸铝毒害后共生体系形成过程的恢复作用。本研究在苜蓿根瘤菌体系遭受短期酸铝毒害之后补充Ca2+、P,得到了良好的修复效果,所以南方酸雨频发地区可通过雨后补充少量Ca2+、P以恢复苜蓿生长,提高抗逆能力。
Soto等[39]研究表明,p H 5.6条件下耐酸苜蓿根瘤菌结瘤动力学曲线不受Ca2+影响。而张琴等[14]研究表明,p H 5.5,5.2,5.0,4.8条件下施加5 mmol/L Ca2+能够促进耐酸苜蓿根瘤菌91522与紫花苜蓿结瘤,而且在整个培养时期效果都非常明显。本试验中,酸铝胁迫处理7~8 d后,单独施加Ca2+、P均能够使酸铝胁迫后苜蓿根瘤菌与紫花苜蓿结瘤时间提前,Ca2+恢复效果好于P素;Ca2+能够显著提高同期结瘤数,补充P素对结瘤数有增加效果。因此,在酸性土壤中种植紫花苜蓿,可以通过合理的补充Ca2+、P修复其与土著耐酸根瘤菌的结瘤固氮,进而可以作为修复酸铝土壤的可行途径。
根瘤菌根毛变形是根毛对根瘤菌入侵和结瘤因子诱导的结瘤反应,是苜蓿结瘤的第一步。根毛变形率提高意味着结瘤数的增加,固氮能力的提高。本研究证实,酸铝胁迫处理24 h,接种根瘤菌后苜蓿根毛变形率仅为3.3%,这与杨敏等[24]结论相似。本研究发现,补充Ca2+和适当的P素使得酸铝胁迫后紫花苜蓿根毛变形显著恢复。一方面,施钙提高根瘤菌在酸性胁迫土壤中的生长存活能力[14],而且本研究也表明Ca2+、P可能通过改善酸铝胁迫后苜蓿根瘤菌的活力(结果未列出),进而影响结瘤因子分泌;另一方面,杨敏等[24]研究认为,酸铝抑制结瘤信号传递导致苜蓿根毛变形受阻,而Ca2+作为结瘤因子信号转导途中的第二信使,提高了经受酸铝胁迫后的根毛感应结瘤因子的能力。Ca2+、P修复酸铝胁迫后紫花苜蓿根毛变形,成为结瘤固氮恢复的重要原因之一。
王树起等[40]研究表明,随着磷浓度的增加,大豆根瘤固氮酶活性呈增加趋势,而且随着反应时间的延长,各磷处理间的差异有增大的趋势,表明施磷对提高豆科根瘤的固氮效率有显著的促进作用。Tang等[41]在苜蓿对磷素的反应试验中表明,磷素能够提高苜蓿根瘤固氮酶还原乙炔生成乙烯的量,即提高固氮酶活性。本试验中酸铝胁迫后,通过补充P素,紫花苜蓿根瘤固氮酶活性显著提高;本试验中Ca2+能够有效地恢复固氮酶活性,但较高浓度Ca2+(10 mmol/L)对固氮酶活性有抑制作用;同水平Ca2+条件下,适当补充P素(4μmol/L)能够显著提高固氮酶活性。所以利用Ca2+对酸铝毒害后苜蓿根瘤固氮酶活性具有良好的恢复能力,而且4μmol/L P浓度在Ca2+作用的基础上也表现出促进作用。
根瘤菌产生AHLs可能参与其和宿主豆科植物形成有固氮活性共生体的过程中的信息交流[42]。祖慧琳等[43]分别采用3.0,6.0,9.0μmol/L AlCl3处理苜蓿根瘤菌1128后,其 AHLs的产生水平及胞外多糖的合成量显著降低,进而抑制苜蓿根瘤菌1128对苜蓿幼根的根毛吸附,降低结瘤信号传递;另有研究表明,天山根瘤菌(Rhizobiumtianshanense)的群体感应突变株完全丧失了固氮结瘤能力[44];Gao等[45]的研究中,经过4 h的根系培养,华癸根瘤菌(Mesorhizobiumhuakuii)群体感应突变株仅有6×102依附在5条根系,同时约有7×105的野生型菌株附着,所以群体感应会影响根瘤菌与宿主植物根毛的识别依附,促进二者信号交流,从而影响根毛变形和共生结瘤。本试验中通过补充Ca2+、P,使得酸铝胁迫下苜蓿根瘤菌91522 AHLs的产生水平显著提高。大量研究认为酰基高丝氨酸内酯(AHL)介导的群体感应(quorum sensing)不仅能调节根瘤菌自身的数目[20],还能影响根瘤菌胞外多糖的产生、根瘤菌与豆科植物的结瘤效率甚至共生体的建成[46]。因此,在酸性土壤中,通过施加Ca2+、P修复土著根瘤菌群体感应系统,能够提高紫花苜蓿与土著根瘤菌的共生固氮能力,为紫花苜蓿在酸性土壤上良好结瘤提供了保障。
在利用植物改良土壤的研究中,苜蓿良好的共生固氮能力能够促进土壤有机质及全氮在耕层的累积[47]。酸性土壤中紫花苜蓿共生结瘤受到抑制,从而限制紫花苜蓿在酸性土壤改良中的应用。通过施加钙磷,根瘤菌自体诱导物的分泌量增加,促进其与宿主植物特异性识别依附过程,改善根瘤菌与宿主植物间的信号交流过程,最终促进结瘤。本研究中5,10 mmol/L Ca2+对苜蓿结瘤修复效果显著,而在此基础上补充4μmol/L P可进一步促进结瘤,而30μmol/L P则有一定抑制作用,可见在实际应用中合理的配施才能发挥良好的作用。影响苜蓿-根瘤菌高效共生的因素非常多,是复杂的综合效应[48],有许多基础性问题,如酸性土壤中耐酸根瘤菌的存活、迁移、对苜蓿根系信号物质的感知以及群体感应物质在酸性土壤中的作用等,均需要更深入的研究。而且,施用钙磷对酸铝胁迫后苜蓿-根瘤菌共生体系形成的恢复效果在实际生产环境如何尚待通过酸性土壤大田试验进一步验证。
4 结论
本研究探讨了酸铝处理苜蓿幼苗及其根瘤菌1周后,施加Ca2+、P对紫花苜蓿-根瘤菌结瘤固氮性能和群体感应的修复/恢复作用。结果表明,在受酸铝毒害后,Ca2+对紫花苜蓿-根瘤菌结瘤过程有显著的修复效应,补充5,10 mmol/L Ca2+条件下,根瘤菌群体感应、根瘤固氮酶活性有显著的提高;4μmol/L P素营养与Ca2+的上述促进作用有交互效应,而且该交互效应导致苜蓿现瘤时间较未经修复处理的提前14 d,结瘤总数提高了247.09%,结瘤率可达到90%,使根毛变形率由无钙磷处理的3.33%提高到28.89%。Ca2+、P对结瘤动力学曲线影响主要体现在Ca2+对同期结瘤数有显著修复效果,并且这种修复从开始结瘤起就非常明显,P素对结瘤数影响在Ca2+5 mmol/L条件下较显著;Ca2+对固氮酶活性有显著提高作用,但高浓度Ca2+(10 mmol/L)效果不如低浓度(5 mmol/L),同时4μmol/L P浓度可以进一步提高固氮酶活性。补充Ca2+、P能够显著提高酸铝胁迫下根瘤菌AHLs分泌量,即提高了根瘤菌的群体感应水平,可能是Ca2+、P对紫花苜蓿-根瘤菌结瘤过程有显著的修复效应的内在机理之一。
因此,在酸性铝毒环境下,施入适当钙、磷营养,能够修复胁迫对苜蓿植物及其根瘤菌体系的负面影响,极大地恢复紫花苜蓿-根瘤菌结瘤固氮性能,提高紫花苜蓿在酸铝胁迫条件下生长能力。
[1] Edwards D G,Sharifuddin H A H,Yusoff M N M,etal.The Management of Soil acidity for Sustainable Crop Production[M].Dordrecht:Kluwer Academic Publishers,1991:383-396.
[2] 杨昂,孙波,赵其国.中国酸雨的分布、成因及其对土壤环境的影响[J].土壤,1999,1:13-18.
[3] Ma J F,Furukawa J.Recent progress in the research of external Al detoxification in higher plants:a mini review[J].Journal of Inorganic Biochemistry,2003,97:46-51.
[4] 黄玺,李春杰,南志标.紫花苜蓿与醉马草的竞争效应[J].草业学报,2012,21(1):59-65.
[5] 李剑峰,师尚礼,张淑卿.环境酸度对紫花苜蓿早期生长和生理的影响[J].草业学报,2010,19(2):47-54.
[6] 杨野,王伟,刘辉,等.铝胁迫对不同耐铝小麦品种根伸长生长影响的研究[J].植物营养与肥料学报,2010,16(3):584-590.
[7] 周楠,刘鹏,徐根娣,等.四种常见杂草根系及根边缘细胞对铝胁迫的响应[J].生态学报,2009,29(12):6512-6518.
[8] Tam’s L,Huttov J,Mistrik I.Inhibition of Al-induced root elongation and enhancement of Al-induced peroxidase activity in Al-sensitive and Al-resistance barley cultivars are positively correlated[J].Plant &Soil,2003,250:193-200.
[9] 阎君,于力,陈静波,等.假俭草铝耐性和敏感种源在酸铝土上的生长差异及生理响应[J].草业学报,2010,19(2):39-46.
[10] Se F,Glenn A R,Dilworth M J.The interaction between aluminum and rood nodule bacteria[J].Soil Biology &Biochemistry,1993,25:403-417.
[11] Graham P H,Vance C P.Nitrogen fixation in perspective:an overview of research and extension needs[J].Field Crops Research,2000,65:93-106.
[12] 应小芳,刘鹏,徐根娣.土壤中的铝及其植物效应的研究进展[J].生态环境,2003,12(2):237-239.
[13] 罗虹,刘鹏,李淑.硅、钙对水土保持植物荞麦铝毒的缓解效应[J].水土保持学报,2005,19(3):101-104.
[14] 张琴,张磊,魏世清,等.钙离子对紫花苜蓿及苜蓿根瘤菌耐酸能力的影响[J].应用生态学报,2007,18(6):1231-1236.
[15] 胡红青,黄巧云,李学垣,等.磷矿粉缓解酸性土壤铝毒的研究[J].中国农业科学,1995,28(2):51-57.
[16] Bassler B L.Small talk:Cell-to-cell communication in bacteria[J].Cell,2002,109:421-424.
[17] Daniels R,De Vos D E,Desair J,etal.The cin quorum sensing locus ofRhizobiumetliCNPAF512 affects growth and symbiotic nitrogen fixation[J].Biologicalogy Chemistry,2002,277:462-468.
[18] Broughton W J,Jabbouri S,Perret X.Keys to symbiotic harmony[J].Bacteriology,2000,182:5641-5652.
[19] Perret X,Staehelin C,Broughton W J.Molecular basis of symbiotic promiscuity[J].Microbiology and Molecular Biology Reviews,2000,64:180-201.
[20] Gonzalez J E,Marketon M M.Quorum sensing in nitrogen-fixing rhizobia[J].Microbiology and Molecular Biology Reviews,2003,67:574-592.
[21] Rodelas B,Lithgow J K,Wisniewski-Dye F,etal.Analysis of quorum-sensing-dependent control of rhizosphere-expressed(rhi)genes inRhizobiumleguminosarumbiovar viciae[J].Journal of Bacteriology,1999,181:3816-3823.
[22] Marketon M M,Glenn S A,Eberhard A,etal.Quorum sensing controls exopolysaccharide production inSinorhizobiummeliloti[J].Journal of Bacteriology,1995,185:325-331.
[23] 罗献宝,黎晓峰,沈方科,等.苜蓿初生根的铝胁迫与钙对铝胁迫的缓解作用[J].广西农业生物科学,2006,25(3):243-247.
[24] 杨敏,黎晓峰,玉永雄,等.铝对苜蓿生长、结瘤及根毛变形的影响[J].农业环境科学学报,2007,26(1):202-206.
[25] 张琴,龙娟,张磊,等.不同p H值下接种根瘤菌对紫花苜蓿产量和品质的影响[J].草业学报,2006,15(5):59-62.
[26] 韩华君,张磊,谢德体,等.耐酸苜蓿根瘤菌在酸性土壤中的定殖研究[J].西南农业大学学报(自然科学版),2006,28(5):722-726.
[27] 张学军,张磊,张琴,等.苜蓿中华根瘤菌(Sinorhizobiummeliloti)的耐酸性研究[J].西南大学学报(自然科学版),2008,30(1):91-97.
[28] 李阜棣,喻子牛,何绍江.农业微生物学实验技术[M].北京:中国农业出版社,1996:96.
[29] Zhu J,Chai Y R,Zhong Z T,etal.Agrobacteriumbioassay strain for ultrasensitive detection of N-acylhomoserine lactonetype quorum-sensing molecules:detection of autoinducers inMesorhizobiumhuakuii[J].Applied and Environmental Microbiology,2003,69:6949-6953.
[30] 张国霞,茅庆,何忠义,等.陵水普通野生稻(Oryzarufipogon)内生菌的固氮及溶磷特性[J].应用与环境生物学报,2006,12(4):457-460.
[31] Felle H H,Kondorosi E,Kondorosi A,etal.The role of ion fluxes in nod factor signalling inMedicagosativa[J].Plant,1998,13:455-463.
[32] Dorothe′e C,Jean L P,Mireille C,etal.Pharmacological evidence that multiple phospholipid signaling pathways link rhizobium nodulation factor perception inMedicagotruncatularoot hairs to intracellular responses,including Ca2+spiking and specificENODgene expression[J].Plant Physiology,2004,126:3582-3593.
[33] 任立飞,张文浩,李衍素.低磷胁迫对黄花苜蓿生理特性的影响[J].草业学报,2012,21(3):242-249.
[34] Israel D W.Sym biotic dinitrogen fixation and host-plant growth during development of and recovery from phosphorus deficiency[J].Physiologia Plantarum,1993,88:294-300.
[35] Drevon J J,Hartwig U A.Phosphorus deficiency increased the argon-induced decline of nodule nitrogen a se activity in soybean and alfalfa[J].Planta,1997,201:463-469.
[36] Almeida J P F,Hartwig U A,Frehner M,etal.Evidence that P deficiency induces feedback regulation of symbiotic N2fixation in white cloverTrifoliumrepensL.[J].Journal of Experimental Botany,2000,51:1289-1297.
[37] Hellsten A,Huss Danell K.Interaction effects of nitrogen and phosphorus on nodulation in red clover(TrifoliumpratenseL.)[J].Acta Agriculture Scandinavica,Section B,Soil and Plant Science,2001,50:135-142.
[38] 苗淑杰,乔云发,韩晓增.磷和根瘤菌交互作用对大豆结瘤和生长的影响[J].大豆科学,2009,28(2):271-274.
[39] Soto M J,Van D P,Martfnez A F,etal.Attachment to plant roots and nod gene expression are not affected by p H or calci-um in the acid-tolerant a1falfa-nodulating bacteriaRhizobiumsp.LPU83[J].FEMS Microbiology Ecology,2004,48:71-77.
[40] 王树起,韩晓增,乔云发,等.缺磷胁迫对大豆根瘤生长和结瘤固氮的影响[J].大豆科学,2009,28(6):1000-1003.
[41] Tang C,Hinsinger P,Drevon J J,etal.Phosphorus deficiency impairs early nodule functioning and enhances proton release in roots ofMedicagotruncatulaL[J].Annals of Botany,2001,88:131-138.
[42] Li J Y,Wang R C,Xia S Q.Quorum sensing system and its application in water treatment with biofilm[J].Chinese Journal of Applied &Environmental Biology,2008,14(1):138-142.
[43] 祖慧琳,朱敏敏,李永春,等.酸性土壤中豆科植物根际微生物群体感应的初步研究[A].江苏省遗传学会第八届会员代表大会暨学术研讨会论文集[C].南京:《中国学术期刊(光盘版)》电子杂志社,2010.
[44] Zheng H M,Zhong Z T,Lai X,etal.A Lux R/LuxI-type quorum-sensing system in a plant bacterium,Mesorhizobiumtianshanense,controls symbiotic nodulation[J].Bacteriology,2006,188:1943-1949.
[45] Gao Y J,Zhong Z T,Sun K J,etal.The quorum-sensing system in a plant bacteriumMesorhizobiumhuakuiiaffects growth rate and symbiotic nodulation[J].Plant and Soil,2006,286:53-60.
[46] Redfield R J.Is quorum sensing a side effect of diffusion sensing[J].Trends Microbiology,2002,10:365-370.
[47] 马其东,高振生,洪绂曾,等.黄河三角洲地区苜蓿生态适应性研究[J].草地学报,1999,7(1):28-38.
[48] Sultan A K,Gintzburger A G,Obaton B M.Growth and nitrogen fixation of annual medicago-rhizobium associations during winter inMediterraneanregion[J].European Journal of Agronomy,2001,15:221-229.
