外植体及氮源对甘草愈伤组织诱导的影响
2012-03-12枊福智蔺海明李占强张汉平
枊福智,蔺海明,李占强,张汉平
(1.甘肃农业大学农学院,甘肃 兰州 730070; 2.酒泉甘草生物育种研究所,甘肃 酒泉 735000)
甘草(Glycurrihizauralensis)是豆科甘草属多年生草本植物,以根和根茎入药[1],具补脾益气、清热解毒、祛痰止咳和调和诸药等功效,是我国2 000多种草药中用量最大的传统中药材之一。甘草不仅用于医药方面,而且在食品、日用化学品、烟草等行业也被广泛应用[2]。甘草根系发达,生命力强,是半干旱荒漠地区优良的药用和防风固沙植物[3];具有抗寒、耐旱、抗盐碱、固沙和改良土壤等作用,对防止水土流失和改善生态环境具有重要意义。甘草广泛分布于我国西北干旱的温带荒漠和温带草原区域[4]。近年来,随着国内和国际市场需求的不断增加,野生资源被过度采挖,致使甘草质量和产量下降,种质资源遭到严重破坏[5]。甘草从播种到成功结实周期较长,至少需要4~5年,种子繁育缓慢已成为制约甘草产业发展的瓶颈[6]。为解决这一矛盾,很多研究者采用基因工程和组织培养技术开展工作,为野生甘草资源的保护和新品种选育提供了新途径。对于甘草种苗和组培技术研究,Zheng等[7]研究了镉对甘草种苗生长和抗氧化剂的影响;刘昕等[8]对胀果甘草(G.inflata)愈伤组织诱导率和褐化率进行了研究;陈巍等[9]对下胚轴、根尖和根中部进行了愈伤组织诱导的研究。营养元素在愈伤组织的生长过程中起着很重要的作用,但有关不同外植体和不同浓度的氮源对甘草愈伤组织生长的影响研究相对较少。本研究以甘草无菌苗的不同外植体为材料,研究不同外植体及氮源对甘草愈伤组织诱导率及生长状况的影响,旨在选择诱导甘草愈伤组织的最佳外植体和氮源浓度,为甘草优质苗的工厂化快速繁殖提供理论及技术支撑。
1 材料与方法
1.1试验材料 以乌拉尔甘草无菌苗的下胚轴、茎、子叶、胚根为试验材料。
1.2方法
1.2.1无菌苗的获得 选取优质的乌拉尔甘草种子,用自来水充分清洗,然后用75%乙醇灭菌30 s,无菌水冲洗3次,0.1%氯化汞常规灭菌10~15 min,无菌水冲洗3次,然后用灭菌滤纸吸干种子表面的水分,将种子接到MS培养基上,pH值5.8,培养室温度28 ℃,光照强度为1 500~2 000 lx,每天光照时间为12~14 h,培养室湿度为70%左右,培养25 d左右可得甘草无菌苗。
1.2.2愈伤组织的诱导 采用培养出的乌拉尔甘草无菌苗的胚根、茎、子叶、下胚轴为外植体材料,接种于前期优选的最佳激素组合MS+6-BA 0.6 mg·L-1+2,4-D 0.5 mg·L-1+NAA 0.6 mg·L-1+KT 0.4 mg·L-1上[6],琼脂5 g·L-1,蔗糖30 g·L-1,培养基的pH值5.8。每个处理20瓶,于高温、高压下灭菌30 min,恒温放置12 h后接种。等愈伤组织诱导出后,每隔5 d测定一次愈伤组织的鲜质量,观察和记录外植体形成不同颜色的愈伤组织数目,并计算每种颜色愈伤组织所占的比例。
1.2.3氮源浓度对甘草愈伤组织诱导影响的测定 以甘草无菌苗下胚轴为外植体,接种于含不同氮源浓度的MS+6-BA 0.6 mg·L-1+2,4-D 0.5 mg·L-1+NAA 0.6 mg·L-1+KT 0.4 mg·L-1培养基上,氮源为KNO3和NH4NO3的总浓度(KNO3∶NH4NO3=1∶1),设6个处理,浓度分别为0、60、120、180、240、300 mmol·L-1。每个处理做20瓶,重复3次。每2 d观察一次,记录下胚轴出愈个数,计算诱导率。
1.2.4愈伤组织诱导率的计算方法

1.3统计分析 试验数据采用SPSS 11.5软件进行统计分析,采用LSD法进行显著性分析。
2 结果与分析
2.1不同外植体对出愈率的影响 在相同的培养条件下,外植体不同,诱导率也不同,且差别较大(图1)。在接种数相同的情况下,愈伤组织诱导率的差异较为明显,其中下胚轴的愈伤组织诱导率最高,茎的愈伤组织率最低。经方差分析,不同外植体诱导率均差异显著(P<0.05),由试验结果可知,4种外植体愈伤组织诱导率以下胚轴最高(93.9%),之后依次是子叶(79.5%)、胚根(73.9%)、茎(65.5%)。
2.2不同外植体对愈伤组织颜色的影响 4种不同外植体诱导的愈伤组织中淡黄色占的比例较高(表1),其中胚根为44.4%,茎为33.5%,子叶为56.2%,下胚轴为68.4%。4种不同外植体中,茎诱导出的愈伤组织的褐化率最高,为20.0%,下胚轴诱导出的愈伤组织的褐化率最低,为5.6%。
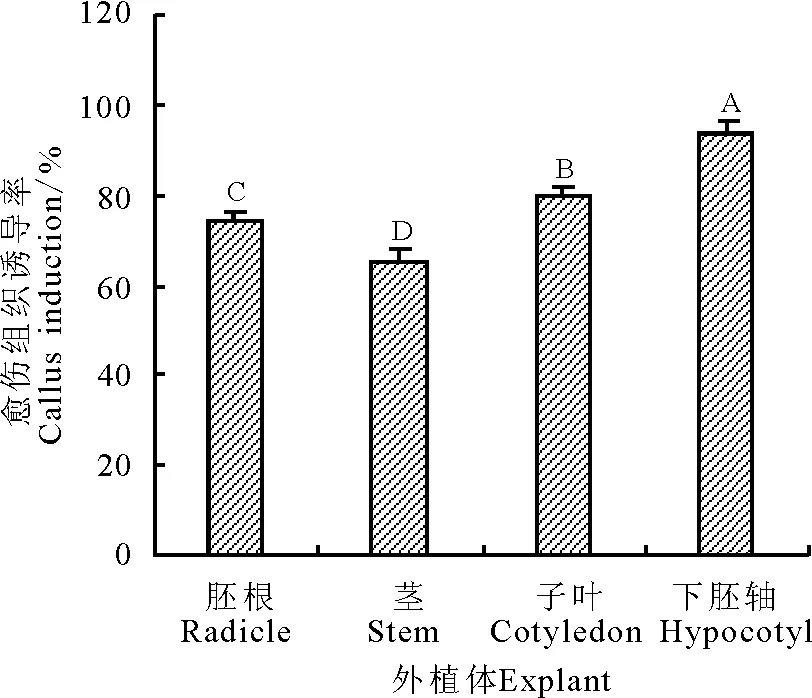
图1 不同外植体对愈伤组织诱导率的影响
4种不同外植体诱导出的愈伤组织中,呈现黄绿色和乳白色最多的分别为茎和胚根,分别为33.4%和27.8%。经方差分析,胚根和下胚轴各颜色愈伤组织占愈伤组织总数的比例差异显著(P<0.05)。从愈伤组织生长状况来看,茎和胚根诱导出的愈伤组织松散,而且生长缓慢,较易褐化;子叶不易诱导愈伤组织,而且生长缓慢,质地较差;下胚轴诱导出的愈伤组织生长快,愈伤组织呈现颗粒状,质地软硬适宜,诱导率高,生长好。因此,下胚轴是诱导愈伤组织的最佳外植体。
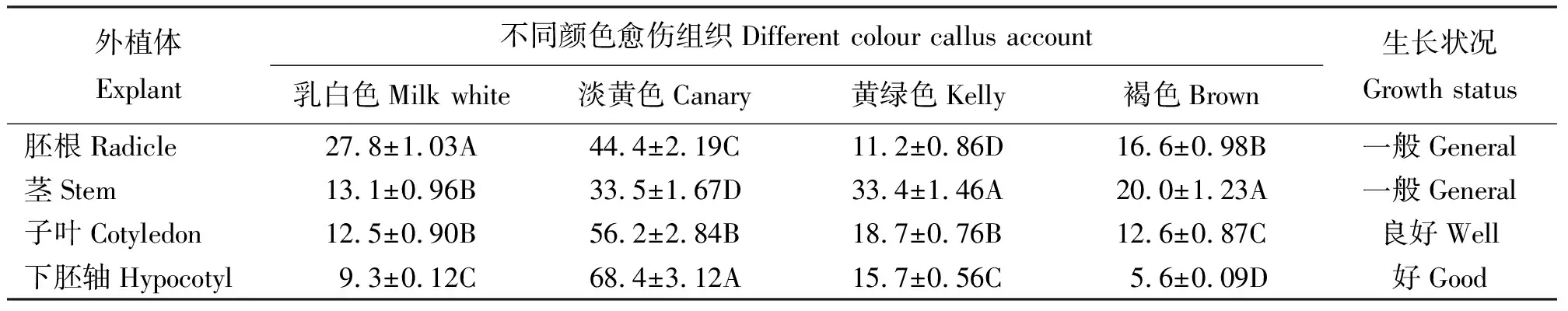
表1 不同颜色愈伤组织占愈伤组织总数的比例
2.3不同外植体对愈伤组织生长状况的影响 甘草愈伤组织生长呈“S”形变化,愈伤组织生长的前10 d,其生长比较缓慢;10~25 d,愈伤组织生长迅速,其鲜质量增加较快;25 d以后愈伤组织生长趋于缓和(图2)。下胚轴的愈伤组织生长较快,其鲜质量的生长量均大于茎、子叶和胚根的愈伤组织生长量。子叶形成的愈伤组织生长比较缓慢,25 d以后愈伤组织生长迅速,比茎和胚根形成的愈伤组织生长快;愈伤组织鲜质量明显高于茎和胚根的愈伤组织生长量。茎的愈伤组织从诱导形成到生长至25 d,其生长速度仅次于下胚轴,愈伤组织鲜质量生长量比子叶和胚根的要快,25 d以后愈伤组织生长趋于缓慢。从愈伤组织生长积累的变化可以看出,外植体对愈伤组织的诱导和生长状况有重要的影响,外植体不同,愈伤组织诱导的难易和生长快慢各不相同。综合愈伤组织的生长状况,下胚轴是诱导愈伤组织的最佳外植体。
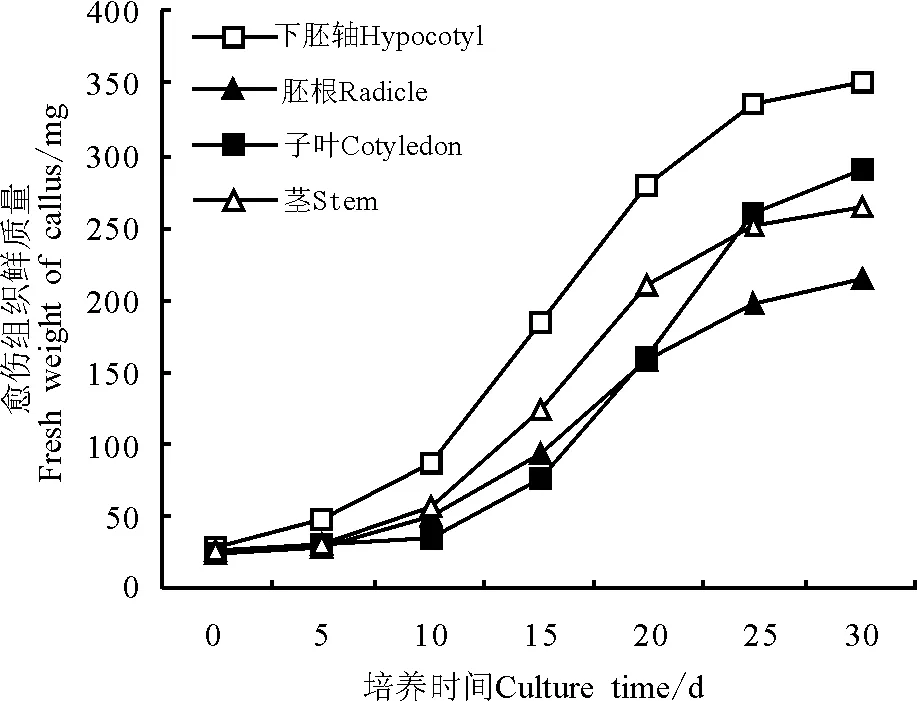
图2 甘草愈伤组织鲜质量变化曲线
在愈伤组织诱导的前10 d,不同外植体愈伤组织的平均日生长速率比较缓慢(表2),其中下胚轴诱导出的愈伤组织平均日生长速率最高,为7.66 mg·d-1;随着诱导时间的延长,愈伤组织的平均生长速率逐渐增加,生长至15~20 d时,除子叶外,不同外植体的平均日生长速率达到最大,其中下胚轴诱导出的愈伤组织平均日生长速率最高,为19.06 mg·d-1;子叶诱导出的愈伤组织平均日生长速率在20~25 d时最高,为19.46 mg·d-1;子叶形成愈伤组织平均日生长速率比较缓慢。经方差分析,不同外植体之间愈伤组织的平均日生长率差异显著 (P<0.05)。20 d以后除子叶外,其他外植体的愈伤组织平均生长速率明显下降。分析表明,下胚轴从诱导愈伤组织开始到20 d时平均日生长率明显高于其他外植体诱导出的愈伤组织,所以下胚轴具有较高的生长速率,是最佳的外植体。
2.4不同浓度的氮源对愈伤组织诱导率的影响 不同浓度的氮源对甘草下胚轴愈伤组织诱导的影响结果显示(图3),氮源浓度对甘草下胚轴愈伤组织诱导有明显的影响。低浓度和高浓度的氮源均不利于愈伤组织的诱导,在氮源浓度为60 mmol·L-1时,从试验得知,培养9 d后,下胚轴周围形成了大量的黄绿色的愈伤组织,诱导率达到了92.5%,随着氮源浓度的升高愈伤组织的诱导率逐渐下降,且生长速度减慢。在氮源浓度为300 mmol·L-1时,几乎没有愈伤组织产生,诱导率最低,为10.2%。这表明,最佳的氮源浓度是愈伤组织诱导成功与否的关键因素,经方差分析,不同氮源浓度对下胚轴愈伤组织诱导率的影响均达到显著差异(P<0.05)。
2.5不同浓度的氮源对愈伤组织生长量积累的影响 愈伤组织鲜质量呈“S”型变化(图4)。甘草下胚轴在接种5 d时鲜质量有所增加,是由于其接种到新鲜培养基上吸水膨胀的结果,接种10~20 d甘草愈伤组织鲜质量增加最快,25 d以后愈伤组织鲜质量的增加都趋于缓慢。氮源浓度为60mmol·L-1时,愈伤组织鲜质量积累最快,达到9.15 mg·d-1;氮源浓度为300 mmol·L-1时,愈伤组织鲜质量最小,为6.25 mg·d-1。由此可见,氮源浓度对愈伤组织的生长量有明显的影响,因此,适宜于甘草下胚轴愈伤组织生长的最佳氮源浓度为60 mmol·L-1。

表2 不同外植体愈伤组织的阶段生长速率
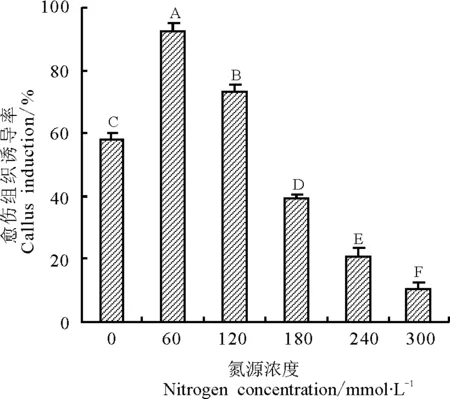
图3 氮源浓度对对下胚轴愈伤组织诱导率的影响
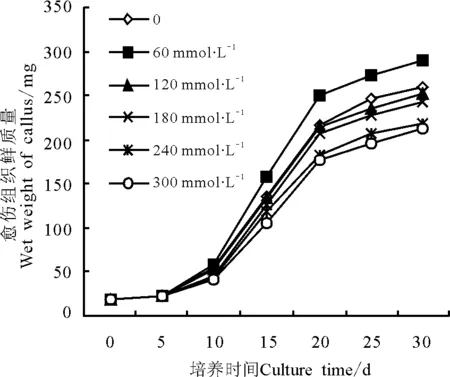
图4 氮源浓度对愈伤组织生长量的影响
3 讨论与结论
外植体是影响愈伤组织诱导的因素之一。各种外植体诱导形成愈伤组织的难易及其所需求的条件有很大的不同,这与外植体供体的遗传因素、基因型和外植体本身的生理生化状态密切相关。同一种植物不同的组织和器官再生能力也有很大差异,本试验中,甘草的外植体不同,对愈伤组织的诱导和生长的影响不同,下胚轴是诱导愈伤组织的最佳外植体,愈伤组织生长好且诱导率最高,子叶较不容易诱导愈伤组织,而且生长比较缓慢且质地较差;茎和胚根诱导出的愈伤组织质地松散,生长较慢且易褐化;甘草不同外植体愈伤组织的生长呈“S”型变化,愈伤组织在不同的生长阶段快慢程度不一。
本试验以甘草下胚轴为外植体诱导愈伤组织具有较高的诱导率和较好的生长状况,是诱导愈伤组织的最佳外植体。该结论与范小峰等[10]以甘草的子叶、下胚轴及胚根为外植体进行愈伤组织诱导所得结论基本一致。根据细胞全能性理论,植物任何器官都可以用作外植体,但不同组织器官培养成功的难易程度是不同的[11]。在甘草不同外植体诱导愈伤组织的过程中可以得出,外植体不同,对愈伤组织诱导的影响效应不同。因此,如何选择最佳外植体是愈伤组织能否高效诱导的关键因素之一。
营养元素在细胞培养中具有非常重要的作用。在离体条件下,植物细胞需要从培养基中摄取必需的营养元素才能维持细胞正常的生理生化等一系列代谢过程,当这些营养元素以适当的浓度存在时才有利于细胞的生长和次生代谢物的积累。氮是细胞中核酸的组成成分,也是生物体许多酶的成分。氮被植物吸收利用后转化为氨基酸,再转化成蛋白质,然后被植物利用。氮源的种类和浓度对细胞生长和次生产物合成的影响非常显著[12]。本试验中,研究了不同浓度的氮源对甘草无菌苗的下胚轴愈伤组织诱导的影响,由结果可以看出,较低和较高浓度的氮源都不利于愈伤组织的生长,适宜甘草下胚轴愈伤组织诱导和生长的最佳氮源浓度为60 mmol·L-1。愈伤组织诱导和生长过程中受多种综合因素的影响,因此,各种复杂因素对愈伤组织生长和干物质积累有待于更加深入的研究。
[1] 肖培根.新编中药志(第一卷)[M].北京:化学工业出版社,2002:259-277.
[2] 王巧饿,任红,曹雪丽.甘草研究开发与利用现状[J].中国农学通报,2011,27(4):290-295.
[3] 蔺海明,纪英,邱黛玉.灌水对沙漠绿洲区甘草生长动态和产量的影响[J].草业科学,2011,28(11):1992-1997.
[4] 周应群,陈士林,赵润怀.药用甘草植物资源生态学研究[J].中草药,2009,40(10):1668.
[5] 魏胜利,王全文,王海.我国中西部地区甘草资源及其可持续利用的研究[J].中国中药杂志,2003,28(3):202.
[6] 赵晶,柳福智,蔺海明.不同外植体对甘草愈伤组织诱导的影响[J].广东农业科学,2011,38(19):36-38.
[7] Zheng G,Lv H P,Gao S,etal.Effects of cadmium on growth and antioxidant responsesinGlycyrrhizauralensisseedlings[J].Plant Soil Environment,2010,56(11):508-515.
[8] 刘昕,王清,于斌.不同外源激素对胀果甘草愈伤组织诱导及褐化的影响[J].甘肃农业大学学报,2010,45(6):88-93.
[9] 陈巍,于泉林,高文远,等.甘草愈伤组织培养的研究[J].中国中药杂志,2005,30(9):713-715.
[10] 范小峰,杨颖丽,郭小强,等.乌拉尔甘草不同外植体愈伤组织的诱导及影响因子研究[J].中药材,2009,32(2):173-176.
[11] 曹君迈,李强,王崇.乌拉尔甘草胚状体的诱导及再生体系的建立[J].核农学报,2010,24(3):522-526.
[12] Kim S H,Kim S K.Effect of nitrogen source on cell growth and anthocyanin production in callus and cell suspension culture of ‘Sheridan’ grapes[J].Journal of Plant Biotechnology,2002,4(2):83.
