TGFβ1及其受体在大鼠整胚及软骨雏形发育过程中的表达
2012-02-08姜孝芳
郭 琼 姜孝芳 陈 艳 王 磊
(新疆医科大学基础医学院:1组织学与胚胎学教研室,2科研中心,3生化教研室,乌鲁木齐830001;4新疆乌鲁木齐兵团医院创伤科 乌鲁木齐830002)
转化生长因子β1(transforming growth factorbeta,TGFβ1)是目前已经发现的 TGFβs家族中最具代表性的一个,它广泛存在于从线虫到哺乳动物的组织细胞内,参与了诸多不同类型细胞的生命活动,同时在妊娠中也具有调节功能,因而在胚胎生长、器官发育,尤其在以软骨及骨组织的发育中表现出了更为突出的作用[1,2]。TGFβs家族成员均为分泌型的多肽信号分子,TGFβ1必须与其特异性I、II型受体(transforming growth factorβtype I、II receptor,TβRI、TβRII)形成四聚体复合物,经受体将信号转入细胞内而产生生物学效应。以往对TGFβ1及TβRI、TβRII在胚胎发育正常过程中所起的作用研究较少。本实验运用半定量RT-PCR和免疫组织化学染色方法观察TGFβ1及TβRⅠ、TβRⅡ在大鼠整胚不同时段及软骨雏形发育过程中的时空表达特点,以期更进一步了解上述因子与组织器官发生发展的关系,为胚胎及胚胎时期软骨雏形的发育规律提供一些参考。
材料和方法
1.材 料
健康雌、雄性SD大鼠各50只(雌性240-260g,雄性260-280g,均为8-10月龄,由华西动物饲养中心提供)。动情期,雌雄于晚1:1合笼,次晨检查阴栓,有阴栓者记为第0d胚胎。孕鼠断颈处死,迅速打开腹腔取出子宫,置于冰冷的9g/L生理盐水内解剖出胚胎,剥离羊膜和胚外膜。共收集13~17d胎龄胚胎40只(大鼠孕19-21d生产,13-17d是胚胎迅速生长发育阶段),每日8只。
2.方 法
2.1 半定量RT-PCR①引物设计合成 根据NCBI GeneBank中大鼠目的基因序列行引物设计βactin上游引物:5′-ccgtaaagacctctgccaac-3′,下游引物:5′-actcatcgtactcctgcttgct-3′,扩增产物 227bp;TGFβ1上游引物:5′-accgacccttcctgctcctcat-3′,下游引物:5′-ggagcgcacgatcatgttgga-3′,扩 增 产 物 398 bp;TβRⅠ上游引物:5′-ccgagaggcagagatatcag-3′,下游引物:5′-ggggccatataccttttagtgc-3′,扩增产物414 bp;TβRⅡ 上游引物:5′-cccaggggccggtctatga-3′,下游引 物:5′-cggtggacacgaacagtagaaga-3′,扩 增 产 物615bp。引物交由大连宝生物公司合成。②总RNA的提取及cDNA的合成 快速取出整胚,用液氮研磨至粉末状,立即放入Trizol(Invitrogen公司)中进行抽提。用Eppendorf核酸蛋白定量分析仪测定RNA浓度和A260/280值,判断其质量,分装于液氮中保存。cDNA的合成按照试剂盒说明书操作(MBI公司Fermentas试剂盒)。③PCR过程 样本cDNA 2μL,β-actin上下游引物各1μL(106mol/L),待扩增目的片段的引物上下游各1μL(106mol/L),2×Taq PCR MasterMix 25μL(天为时代)用ddH2O将体积补至50μL。预变性94℃4min,变性94℃40s,退火48℃45s,延伸72℃40s,共28个循环,再延伸72℃10min。
2.2 免疫组化SABC染色 抗体及SABC染色相关试剂购自武汉博士德公司。
40g/L多聚甲醛固定胚胎,制作3-5μm厚连续石蜡切片,常规脱蜡,水化。30mL/L H2O2处理10min,PBS洗涤;92-98℃,EDTA液行微波抗原修复10min;室温下50g/L BSA封闭40min,直接滴加稀释的一抗(兔多抗TGFβ1、TβRⅠ、TβRⅡ,稀释浓度均为1:100),4℃湿盒过夜后PBS洗涤;滴加生物素化山羊抗兔IgG,室温下孵育40min,PBS洗涤;滴加SABC,室温下孵育40min,PBS洗涤;DAB显色,镜下控制显色强度,苏木素轻度复染,脱水、透明,中性树胶封片。阴性对照用PBS代替一抗。
2.3 统计学分析 用BIO-RAD凝胶成像系统及其半定量分析软Quantity-One,分析各泳道中不同天数目的条带与相对应β-actin条带的密度比值(表示该因子mRNA的相对表达量),将数据输入SPSS13.0统计软件。采用单因素方差法分析TGFβ1,TβRⅠ,TβR II在不同时间点表达量的差异。均数的两两比较用q检验(SNK法)。
结 果
1.半 定量RT-PCR
1.1 琼脂糖凝胶电泳 以DNA Marker DL 2000(TaKaRa)为标准,扩增产物及内参大小正确(图1)。

图1 大鼠13-17d全胚中TGFβ1 及TβRⅠ、TβRⅡ的半定量RT-PCR电泳图。A:扩增TGFβ1,长度398bp;B:扩增TβRⅠ,长度414bp;C:扩增TβRⅡ,长度615bp。扩增内参β-actin,长度227bp。1泳道:13d胚胎;2泳道:14d胚胎;3泳道:15d胚胎;4泳道:16d胚胎;5泳道:17d胚胎。Fig1Agarose gel electrophoresis of half-quantity RT-PCR figures of TGFβ1and TβRⅠ,TβRⅡin the 13th-17th days of rat entire embryo A:TGFβ1398bp;B:TβRⅠ 414bp;C:TβRⅡ 615bp.β-actin 227bp.1:13d;2:14d;3:15d;4:16d;5:17d.
1.2 半定量RT-PCR实验 根据所得灰度值,采用Excel统计软件制图(图2),结合方差分析可以看出,TGFβ1在13-16d中表达是逐渐增加的,其中15、16d是高峰,17d明显下降;TGFβRⅠ在14、15 d之间的表达无差异(P>0.05)但在该发育阶段表达总趋势为递增,其中17d是高峰;TGFβⅡ在13、14d之间,14、15、16d之间的表达无差异(P>0.05)但在该阶段总体趋势仍为递增,其中17d为高峰。
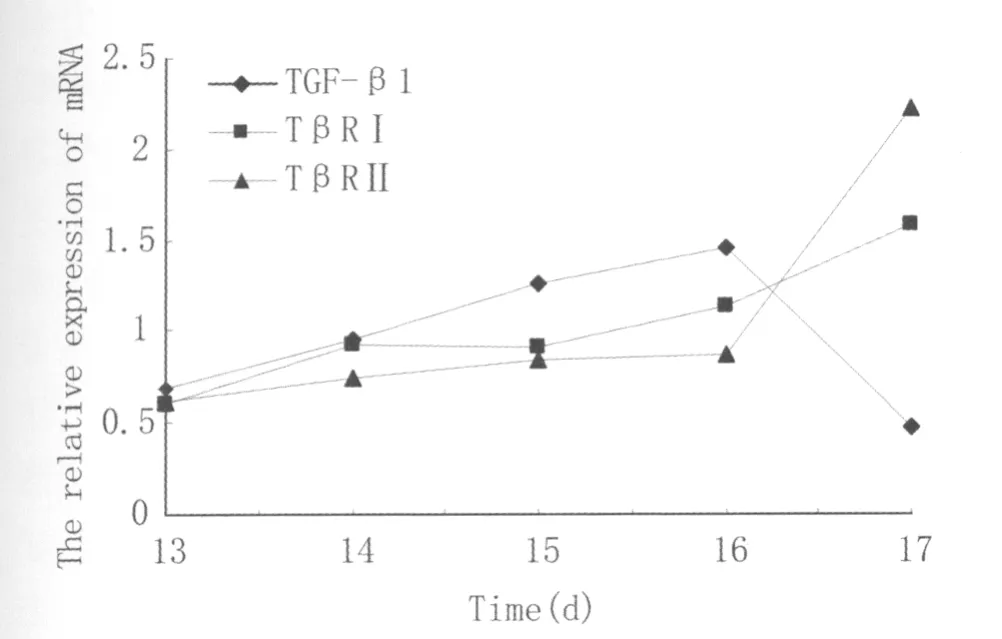
图2 大鼠13-17d全胚中 TGFβ1 及 TβRⅠ、TβRⅡmRNA相对表达量变化趋势图Fig.2The tendency of relative mRNA expressions of TGFβ1,TβRⅠand TβRⅡin the 13th-17th days of rat entire embryo
2.组 织学及免疫组织化学结果观察
2.1 组织学观察 软骨雏形是形成骨和软骨的前体结构,本次观察选择椎骨和肋骨发育初始阶段的软骨雏形进行观察。从13d开始至17d,可见在要形成软骨雏形的部位间充质细胞密度增加,使得细胞密集成团,团块内细胞较为幼稚,核染色较深,即为软骨骨祖细胞。随时间推移,该细胞不断分裂增殖,细胞体积变大为球形或不规则形、细胞继续聚集,形成软骨雏形中心。该区域内,靠外周的细胞较为幼稚,中心区域细胞较为成熟。随着中心内幼稚软骨细胞不断成熟,其产生基质的能力也不断增强,故软骨雏形内细胞相对会变得稀疏,而软骨雏形体积会增大。17d时明显可见团块中心相对成熟的软骨细胞位于各自的陷窝内,而胞质内出现类似空泡状脂滴,有时可见2-3个细胞聚集形成群。在发育过程中始终可见在软骨雏形形成中心周围有由间充质形成的数层扁平或梭形细胞,此即为以后形成的外膜(图3-5)。
2.2 免疫组织化学结果 阳性反应物为棕色或黄色颗粒,分布在胞质和胞膜,对照组全部阴性。
①TGFβ1表达结果 13d时,在软骨雏形形成区域内的细胞中未见阳性表达颗粒,软骨雏形之间的细胞数量稀疏,也无阳性表达颗粒。14d细胞成团的趋势明显,团块内与13d的表达情况类似,但在团块外周边缘处的细胞间质内出现散在阳性表达颗粒(图A)。15d时,在形成软骨雏形的部位有明显的细胞团,其内细胞排列疏散;越靠近中心,细胞阳性表达颗粒越明显,同时可见胞内空泡状的脂滴。而外周膜中的细胞有微弱阳性表达颗粒。软骨雏形之间细胞密集,无阳性表达颗粒(图B)。17d时,可见界限清晰的雏形横切面,外周细胞相对增多,形成明显膜,其阳性表达不明显;中心内肥大的软骨骨祖细胞进一步成熟,阳性表达明显增强,数个细胞有聚集倾向。雏形之间的结缔组织,细胞数量有所减少,其内的丝状纤维中出现微弱阳性表达颗粒(图C)。
②TβRⅠ表达结果 13d时,在软骨雏形形成区域的细胞内可见散在深棕黄色颗粒。14d,软骨雏形内细胞的阳性表达较13d增多,在外周膜中细胞内出现散在的棕黄色颗粒,软骨雏形之间的结缔组织内也出现阳性表达颗粒(图D)。15d时,可见处于不同发育阶段的软骨雏形。在发育相对成熟的软骨雏形内,阳性表达强度较幼稚软骨雏形高,但细胞密度较低(图E)。16d-17d,随着软骨雏形的进一步发育,其内部细胞和外周膜中的阳性表达趋势也随之增加;而软骨雏形之间结缔组织内的阳性表达增加不如软骨雏形内细胞明显(图F)。
③TβRⅡ表达结果 13d时,整个软骨雏形中心及周围均无阳性表达。到14d,在软骨雏形中心的一些细胞内出现弱阳性表达颗粒,但表达数量不多;软骨雏形之间的间充质组织内则出现广泛的弱阳性表达颗粒(图G)。从15d开始到16d,可见软骨雏形内的软骨骨祖细胞中,阳性表达强度迅速增高,外周膜中细胞内出现弱阳性表达颗粒,而周围间充质形成的结缔组织中阳性表达增强趋势不明显(图H)。17d在软骨雏形区域内形成软骨,明显见到幼稚软骨细胞过渡为成熟软骨细胞,阳性表达程度无明显变化,但细胞形态则由小的扁梭形变为大的圆形或椭圆形,软骨陷窝明显,有时可见脂滴(图I)。

图3 大鼠胚胎软骨雏形中TGFβ1阳性表达(标尺=220μm)A图:14d胚胎;B图:15d胚胎;C图:17d胚胎。sc:脊髓;bv:血管;efc:软骨雏形;pc:软骨膜;cc:肋软骨;mt:间充质组织图4大鼠胚胎软骨雏形中TβRⅠ阳性表达(标尺A、B=220μm;C=100μm)A图:14d胚胎;B图:15d胚胎;C图:16d胚胎。bv:血管;e:表皮;mt:间充质组织;sc:脊髓efc:软骨雏形图5大鼠胚胎软骨雏形中TβRⅡ阳性表达(标尺A、B=220μm;C=439μm)A图:14d胚胎;B图:16d胚胎;B图:17d胚胎。bv:血管;mt:间充质组织;efc:软骨雏形;sc:脊髓;pc:软骨膜;cc:肋软骨Fig 3TGFβ1positive expressions in embryonicform of cartilage(bar=220μm)A:14d;B:15d;C:17d.sc:spinal cord;bv:blood vessel;efc:embryonic form of cartilage;pc:perichondrium;cc:costal cartilage;mt:mesenchymal tissueFig 4TβRⅠ positive expressions in embryonicform of cartilage(barA、B=220μm;C=100μm)A:14d;B:15d;C:16d.bv:blood vessel;e:epidermis;mt:mesenchymal tissue;sc:spinal cord;efc:embryonic form of cartilageFig 5TβRⅡ positive expressions in embryonic form of cartilage(barA、B=220μm;C=439μm)A:14d;B:16d;B:17d.bv:blood vessel;mt:mesenchymal tissue;efc:embryonic form of cartilage;sc:spinal cord;pc:perichondrium;cc:costal cartilage
讨 论
TGFβ1及其TβRⅠ、TβRⅡ在哺乳动物胚胎及器官形成中起着重要作用,但在某一阶段连续观察上述3个因子的报道甚少。本研究中我们用半定量RT-PCR方法检测13-17dSD胎鼠TGFβ1及其TβRⅠ、TβRⅡ基因表达变化情况发现,它们在13-17d中均有表达。13-16d3个因子表现出不同程度的递增趋势,TGFβ1递增幅度最大,TβRⅠ次之,TβRⅡ较低。17d开始TβRⅠ与TβRⅡ依然递增,只是TβRⅡ幅度较之TβRⅠ更大,而TGFβ1则转为下降趋势。该现象出现的可能原因是:①TGFβ1多表达在胚胎早期、损伤或疾病的组织器官内;②胚胎通过自分泌或旁分泌的机制,使TGFβ1在胚胎发育早中期自我表达的同时,上调TβRⅠ和TβRⅡ表达;③发育晚期,细胞的TβRⅠ和TβRⅡ有可能随特定组织器官细胞数目的增多而增加[3]。本实验中我们用半定量RT-PCR观察SD大鼠胚胎中TGFβ1及TβRⅠ、TβRⅡ的整体水平变化特点时发现与以往的报道有所不同,即TβRⅡ与TGFβ1的表达量不成正比关系。可能因为以往研究多建立于肿瘤、炎症、外伤等疾病模型之上进行,而此次实验完全是在一个正常的生理前提下实施。Forbes K等[4]用免疫组织化学检测人胚胎中上述三个因子的表达情况,结果出现与本次实验相类似的趋势,只是在表达时间上比本次实验的时间有所提前,其原因可能是物种不同所致。
软骨是机体胚胎时期的主要支架,随着胚胎发育,成体后除了残留的部分软骨外,绝大多数都被骨取代。哺乳动物胚胎时期的软骨来源于软骨雏形,雏形则来源于间充质,在软骨雏形的基础上,软骨以软骨内生长(间质性生长)或软骨膜下生长(附加性生长)进行扩展,最终形成与机体需要所一致的结构:骨或者软骨。本次实验中观察到,在以后形成椎骨或者肋软骨的部位,软骨雏形是以软骨内生长为主。同时免疫组织化学染色显示:14-17d中,软骨雏形内细胞中的TGFβ1表达是随胎龄的增加而增加,但雏形中心外膜上表达一直为阴性;TβRⅠ在表达上与TGFβ1趋近一致,但外膜上的阳性表达较早,且随胎龄增加而增强;TβRⅡ的表达与TβRⅠ则趋近一致。3个因子在软骨雏形之间的间充质内表达均随时间增强,其中TGFβ1的表达及增强强度最弱,TβRⅡ次之,TβRⅠ最强。总之TGFβ1及其Ⅰ、Ⅱ受体介导的信号对胚胎和软骨雏形细胞的分化、增殖和成熟以及周围基质的合成可能具有重要的调控作用。该信号抑制雏形中细胞的肥大性分化及增殖,同时又可刺激诸多受体后分子磷酸化,并调控核内各种靶基因的表达[5,6]。本次实验观察 TGFβ1及其受体在信号传导初始阶段表达变化情况,试图为将来的基因治疗和组织工程技术提供一些基础性的研究依据。综上,TGFβ1与TβRⅠ、TβRⅡ随着大鼠胚胎时期软骨雏形的发育,不同部位阶段有着不同时相性的表达规律。如何解释这一现象?是否可以推测它们在软骨雏形发育特殊时期普遍存在某些分泌模式,还是用发现存在于不同种属内的TGFβ1与TβRⅠ、TβRⅡ具有相互独立的信号传导途径来解释?
TGFβ1作为调节细胞增殖和分化的多功能细胞因子,在受体数量增多或减少的同时都可引发后续不同信号传导通路的激活或抑制[7]。结合半定量RT-PCR与免疫组化结果发现三个因子在全胚中的变化与在软骨雏形中的变化不一致,因为TGFβ1主要分布于中胚层来源的组织细胞,具有促进和抑制生长的双重作用,何种作用占优势取决于细胞类型、TGFβs信号通路部件浓度以及与TGFβs信号途径相互作用的其它信号途径[8,9]。在起源不同的组织结构中,TGFβ1和它的受体执行着不同的生物学功能。当然TGFβ1作用的发挥一方面依赖于分泌水平的高低,另一方面受体的表达及分布对其功能的发挥也起着重要的调节作用。
[1]Remy I,Montmarquette A,Michnick SW.PKB/Akt modulates TGF-betasignaling through a direct interaction with Smad3.Nat Cell Biol,2004,6(4):358-365
[2]Bettina K,Tao Y,Elda M,et al.Interraction of TGFβ and BMPsignaling pathways during chondrogenesis.Plos One,2011,6(1):1-9
[3]Liu HC,He ZY,Mele CA,et al.Human endometrial stromal cells improve embryo quality by enhancing the expression of insulin like growthfactors and their receptors in cocultured human preimplantation embryos.Fertility Sterility,1999,71(2):361-367
[4]Forbes K,Souquet B,Garside R,et al.Transforming growth factor-beta(TGF{beta})receptorsⅠ/Ⅱ differentially regulate TGF{beta}1and IGF-binding protein-3 mitogenic effects in the human embryo.Endocrinology,2010,51(4):1723-1731
[5]Gordon KJ,Blobe GC.Role of transforming growth factor-beta superfamily signaling pathways in human disease.Biochem Biophys Acta,2008,1782(4):197-228
[6]Lorda D CL,Montero JA,Hurle JM,et al.Tgf beta2and 3 are coexpressed with their extracellular regulator Ltbp1in the early limb bud and modulate mesodermal outgrowth and BMP signaling in chicken embryos.BMC Dev Biol,2010,21(10):69-75
[7]Pannu J,Rojanowska M,Recent advances in fibroblast signaling and biology in scleroderma.Curr Opin Rheumatol,2004,16(6):739-745
[8]Karamboulas K,Dranse HJ,Underhill TM.Regulation of BMP dependent chondrogenesis in early limb mesenchyme by TGF beta signals.Cell Sci,2010,123(12):2068-2076
[9]Baldridqe D,Shchelochkov O,Kelley B,et al.Signaling pathways in human skeletal dysplasias.Annu Rev Genomics Hum Genet,2010,229110:189-217
