白细胞介素-1β对人牙周膜成纤维细胞中MCP-1表达影响的研究
2012-02-05谭国琴侯夏沛刘育鑫
靳 晶,谭国琴,侯夏沛,刘育鑫,曹 军
(第四军医大学口腔医学院,陕西西安710032)
牙根吸收(root resorption)是正畸牙齿移动中常见并发症之一,但其发病机制仍不清楚[1-2]。有研究显示:发生牙根吸收的区域局部牙周组织中白细胞介素-1β(interleukin-1β,IL-1β)的表达增强[3],且局部牙周组织中细胞增多[4]。那么,这种局部牙周组织中增多的细胞是否受到局部炎症牙周组织中某种趋化信号的作用呢?本研究针对这个问题进行了初步研究。
单核细胞趋化蛋白-1(Monocyte chemoattractant protein-1,MCP-1)是一种特异性趋化因子,对单核-巨噬细胞有很强的趋化激活作用,在趋化激活单核-巨噬细胞向炎症部位募集过程中发挥重要作用[5]。Asano等[6]在大鼠牙根吸收组织切片中发现:牙周膜成纤维细胞中MCP-1表达阳性,同时还观察到,MCP-1能刺激大鼠破骨前体细胞向破骨细胞的转化,但其具体的分子生物学机制仍不清楚。本研究分别采用半定量逆转录聚合酶链反应(RT-PCR)、免疫荧光技术以及Western blot方法检测不同浓度IL-1β对hPDLFs中MCP-1表达的影响,初步探讨在牙根吸收过程中,人牙周膜成纤维细胞在IL-1β介导环境下,是否存在MCP-1的过表达、引起外周血单核细胞向发生牙根吸收的牙周组织中募集的机制。
1 材料和方法
1.1 主要试剂和仪器
重组人IL-1β(Peprotech公司,美国);DMEM培养基、胰蛋白酶(Gibco公司,美国);胎牛血清(Hyclone Lab,Inc);RT-PCR试剂盒、Taq DNA聚合酶、DL2 000 marker(Takala公司,日本);兔抗人MCP-1多克隆抗体(Abcom公司,美国);山羊抗兔荧光素FITC标记抗体(北京中衫金桥生物技术有限公司);EPS 500/400电泳仪(PerkinElmer公司,美国);垂直电泳槽和电泳仪、Mini Trans-Blot转移电泳槽、Biorad PCR热循环仪(Bio-Rad公司,美国)。Olympus-BH-2型光学显微镜(Olympus公司,日本);Zeiss Axioimager M1型显微镜(ZEISS公司,德国)
1.2 方法
1.2.1 人牙周膜成纤维细胞(hPDLFs)的体外培养
选取12~18岁志愿者因正畸需要拔除的健康前磨牙,立即放入取材液中,超净工作台内用含双抗(青霉素100 U/mL,链霉素100 U/mL)的无菌生理盐水反复冲洗后,刮取根中1/3牙周膜组织,参照文献[7-8]采用组织块法进行原代培养,常规传代并经免疫组化方法鉴定其来源后用于以下实验。
1.2.2 实验分组和细胞处理
取生长良好的4~6代hPDLFs细胞,胰蛋白酶消化后以1×105/mL的细胞密度分别接种于6孔培养板、预先置有玻片的24孔培养板及25 mL的培养瓶中,用含100 mL/L FBS的DMEM-F12的培养液进行培养。待细胞充分贴壁并达80%汇合时换用无血清DMEM-F12继续培养24 h,使细胞相对同步化。然后分别取出6孔、24孔板以及培养瓶,弃培养液,无血清DMEM-F12洗2遍后,各随机分为5组(1个对照组和4个实验组),对照组(N组)加入不含IL-1β的DMEM-F12;4个实验组分别加入含IL-1β终末浓度为1 ng/mL(1组)、5 ng/mL(2组)、10 ng/mL(3组)、25 ng/mL(4组)的DMEM-F12,继续培养24 h。6孔板细胞用于RT-PCR;24孔板每孔中细胞爬片用于免疫荧光染色;25 mL培养瓶细胞用于western blot检测,实验共重复3次。
1.2.3 RT-PCR检测MCP-1基因的表达
取上述培养的6孔板,提取各孔hPDLFs的总RNA进行反转录反应合成cDNA,PCR扩增,产物用18 g/L琼脂糖凝胶电泳分析。PCR反应所用引物设计如下。MCP-1上游引物:5’-CTTCTGTGCCTGCTGCTCATA-3’,下游引物5’-CTTTGGGACACTTGCTGCTG-3’,产物大小166 bp;以磷酸甘油醛脱氢酶(glyceradehyde-3-phosphate dehydrogenase,GAPDH)基因作为内参照,GAPDH上游引物:5’-CGGAGTCAACGGATTTGGTCGTAT-3’,下游引物:5’-AGCCTTCTCCATGGTGGTGAAGAC-3’,产物大小306 bp。反应体系共25 μL。反应条件: MCP-1,94℃预变性5 min,1个循环;94℃变性30 s,57℃退火45 s,72℃延伸30 s,共30个循环。GAPDH,94℃预变性5 min,1个循环;94℃变性35 s,58℃退火60 s,72℃延伸30 s,共30个循环。所有循环最后均72℃延伸10 min。取 PCR各产物经18 g/L琼脂糖凝胶电泳30 min后,于紫外线箱中观察并照相记录。产物鉴定以DL2 000 marker为标准。利用Image-Pro Plus图像分析软件,对目的基因和参照基因电泳条带进行灰度扫描,分别计算出不同处理组中MCP-1与GAPDH的灰度比值,将该比值作为反映不同处理组中MCP-1的基因表达水平指标。
1.2.4 免疫荧光染色检测MCP-1的蛋白表达
取上述培养的24孔板细胞爬片经40 g/L多聚甲醛室温固定后,用PBS振洗3次,每次5 min,吹干,滴加兔抗人MCP-1多克隆抗体(1∶50稀释),置于湿盒4℃冰箱过夜,PBS振洗3次,每次5 min,吹干,滴加山羊抗兔荧光素FITC标记抗体(1∶250稀释),置湿盒室温下2 h,PBS振洗3次,每次5 min,吹干,滴加DAPI染色液,PBS振洗后,抗荧光淬灭封片液封片,PBS代替一抗作阴性对照,荧光显微镜下观察,拍照。
1.2.5 Western blot检测MCP-1蛋白的表达
取上述培养的25 mL培养瓶,提取每瓶hPDLFs中总蛋白,采用BCA蛋白定量试剂盒进行蛋白定量,经150 g/L SDS-PAGE电泳分离后,电转至聚偏氟乙烯(polyvinglidence fluoride,PVDF)膜上,用含50 g/L脱脂牛奶的TBST溶液室温封闭2 h。将封闭好的PVDF膜封入加有一抗(兔抗人MCP-1多克隆抗体按1∶500稀释;抗β-actin单克隆抗体1∶1 000稀释)的塑料袋中,室温孵育1 h之后4℃冰箱过夜。PVDF膜经TBST漂洗3次(每次10 min)后,分别与辣根过氧化物酶标记的山羊抗兔IgG室温孵育1 h,电化学发光,拍照,以β-肌动蛋白(β-actin)作为内参照,扫描后图片利用Image-Pro Plus图像分析软件进行灰度扫描,分别计算出不同处理组中MCP-1与β-actin的灰度比值,将该比值作为反映不同处理组中MCP-1蛋白的相对表达水平指标。
1.3 统计学分析
使用SPSS 13.0统计软件进行统计分析。各组数据采用单因素方差分析及SNK-q检验,以P<0.05为差异有统计学意义。
2 结果
2.1 RT-PCR结果
MCP-1 PCR产物电泳结果显示,对照组hPDLFs中,MCP-1mRNA有弱表达;实验组hPDLFs随着IL-1β作用浓度的升高,MCP-1mRNA表达明显增高(图1)。当IL-1β达10 ng/mL和25 ng/mL时,其表达与正常对照组相比有显著差异(P<0.05),但两者之间无明显的统计学差异(P>0.05);而低浓度IL-1β(1 ng/ml和5 ng/mL)作用下,hPDLFs中MCP-1mRNA表达与对照组相比无显著差异性(P>0.05)(表1)。

图1 MCP-1 PCR产物琼脂糖凝胶电泳图
表1 不同处理组中MCP-1/GAPDH的灰度比值的比较 (n=8,±s)
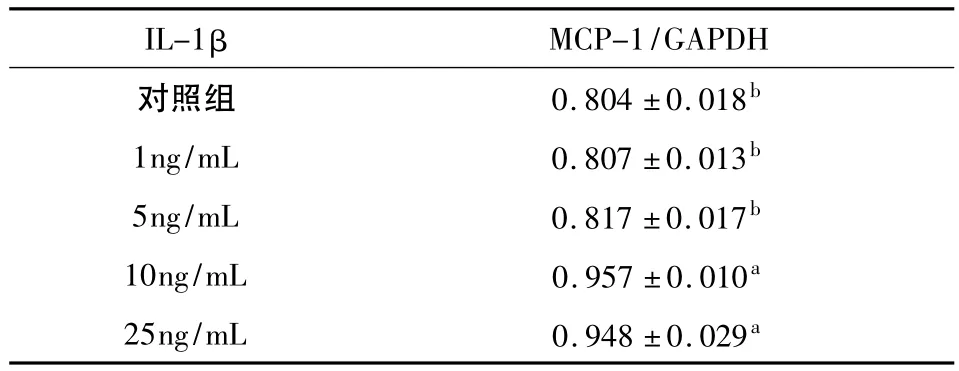
表1 不同处理组中MCP-1/GAPDH的灰度比值的比较 (n=8,±s)
a.与对照组比较P<0.05;b.与10 ng/mL组比较P<0.05
IL-1βMCP-1/GAPDH对照组 0.804±0.018b 1ng/mL 0.807±0.013b 5ng/mL 0.817±0.017b 10ng/mL 0.957±0.010a 25ng/mL 0.948±0.029a
2.2 免疫荧光染色结果
对照组hPDLFs中,MCP-1呈阴性或弱阳性表达;5 ng/mL IL-1β作用下,hPDLFs中MCP-1呈阳性表达;在10 ng/mL IL-1β作用下,MCP-1呈强阳性表达,主要在细胞浆中表达,阳性细胞数显著增加(图2)。

图2 MCP-1免疫荧光染色图(×200)
2.3 Western blot结果
对照组hPDLFs中MCP-1蛋白有弱表达,随着IL-1β浓度的升高,其表达明显增高,与免疫荧光染色结果一致(图3)。当IL-1β达10 ng/mL和25 ng/mL时,其表达与正常对照组相比有显著差异(P<0.05),但两者之间无明显的统计学差异(P>0.05);而低浓度IL-1β(1 ng/mL和5 ng/mL)作用下,hPDLFs中MCP-1蛋白表达与对照组相比无显著差异(P>0.05)(表2)。

图3 MCP-1蛋白表达Western blot检测图
表2 不同处理组中MCP-1/β-actin的灰度比值的比较 (n=8,±s)

表2 不同处理组中MCP-1/β-actin的灰度比值的比较 (n=8,±s)
a.与对照组比较P<0.05;b.与10 ng/mL组比较P<0.05
IL-1β MCP-1/β-actin对照组 0.408±0.029b 1 ng/mL 0.409±0.021b 5 ng/mL 0.424±0.046b 10 ng/mL 0.929±0.033a 25 ng/mL 0.920±0.037a
以上结果表明:对照组hPDLFs中可见微弱的MCP-1表达,且主要在细胞浆表达;低浓度IL-1β作用下,对hPDLFs中MCP-1表达的调节作用较对照组不明显(P>0.05);随着IL-1β作用浓度的增加,hPDLFs中MCP-1表达出现明显的上调表现,这种上调表现在10 ng/mL IL-1β的作用浓度时最明显(P<0.05)。
3 讨论
趋化因子(Chemokines)是一组可由多种细胞产生的小分子蛋白,能特异性地趋化白细胞,从而参与多种口腔、全身免疫炎症性疾病的发生和发展[5,9]。单核细胞趋化蛋白-1(MCP-1)是趋化因子家族中的重要成员之一,是被证实的趋化单核细胞向炎症部位募集的主要因子[10]。牙根吸收作为正畸牙齿移动过程中常见的并发症,其后果较为严重,已经引起广泛的关注。普遍观点认为正畸过程中引起的牙根吸收是一种多细胞多因子共同参与的免疫炎症反应[1-2],在此过程中单核-巨噬细胞系细胞对局部坏死组织的清除发挥着重要的作用[11-13]。Brudvik P等[11-12]在大鼠牙根吸收模型石蜡切片中发现:牙根吸收侧有大量单核-巨噬细胞样细胞存在,同时提出这些细胞的聚集与活化可能受到炎症牙周组织中某种趋化信号的作用;张斯等[3]发现:发生牙根吸收区域局部的牙周组织中IL-1β表达增强;李楠等[4]发现:牙根吸收侧局部牙周组织中细胞增多。那么,参与牙根吸收过程中的大量单核细胞-巨噬细胞样细胞是如何聚集到牙根吸收局部组织中的呢?是否存在hPDLFs在IL-1β作用下,通过上调MCP-1表达引起外周血中单核细胞向局部炎症组织募集的机制呢?针对这个问题,本研究通过免疫荧光染色方法对hPDLFs中MCP-1的蛋白表达进行了定性研究,明确MCP-1在正常hPDLFs可微弱表达,且主要表达于细胞的胞浆中,这与Nebel D等[14]研究结果一致,同时观察到 IL-1β可以明显上调 hPDLFs中MCP-1的表达。进一步通过定量分析发现:低浓度(1 ng/mL和5 ng/mL)的 IL-1β对 hPDLFs中MCP-1表达的调节作用不明显(P>0.05),随着IL-1β作用浓度的增高,可以明显上调hPDLFs中MCP-1表达,这与Oqura N等[15]在颞下颌关节滑膜细胞中的研究结果一致。
本结果提示,存在于牙根吸收发生过程中的IL-1β介导环境,可使hPDLFs中MCP-1表达增高,而MCP-1表达增高可能是引起外周血单核细胞向局部募集的机制之一。Asano M等[6]研究发现:MCP-1在鼠牙根吸收侧表达阳性,阳性细胞主要为成纤维样细胞,同时还观察到MCP-1能刺激大鼠破骨前体细胞向破骨细胞转化,这与本结果显示的hPDLFs在炎症环境下,通过调节MCP-1的表达,参与趋化单核细胞的募集机制一致。而IL-1β对hPDLFs中MCP-1调节作用的信号通路,以及IL-1β刺激下hPDLFs分泌的MCP-1对单核细胞的趋化作用有何影响?具体是否通过激活单核细胞中其受体CCR2的表达来发挥作用等具体的机制还有待进一步的研究。
[1] Brezniak N,Wasserstein A.Root resorption after orthodontic treatment:part 1[J].Am J Orthod Dentofacial Orthop,1993,103(1):62-66.
[2] Brezniak N,Wasserstein A.Orthodontically induced inflammatory root resorption.Part II:The Clinical Aspects[J].Angle Orthod,2002,72(2):180-184.
[3] 张斯,曹军,李臻,等.IL-1β在犬牙根吸收组织的表达及其对人牙周膜细胞MMP-1、TIMP-1表达的影响[J].实用口腔医学杂志,2012,28(2):156-160.
[4] 李楠,谭国琴,王艳青.牙根吸收发生早期指征的动物实验研究[J].牙体牙髓牙周病学杂志,2012,22(3):146-149.
[5] Deshmane SL,Kremlev S,Amini S,et al.Monocyte chemoattractant protein-1(MCP-1):an Overview[J].J Interferon Cytokine Res,2009,29(6):313-326.
[6] Asano M,Yamaquchi M,Nakajima R,et al.IL-8 and MCP-1 induced by excessive orthodontic force mediates odontoclastogenesis in periodontal tissues[J].Oral Dis,2011,17(5):489-498.
[7] 吴军正,司徒镇强,陈建元,等.体外培养的人牙龈牙周牙髓成纤维细胞生长及形态特点[J].实用口腔医学杂志,1993,9(4):227-230.
[8] Ragnarsson B,Carr G,Daniel JC.Isolation and growth of human periodontal ligament fibroblast cells in vitro[J].J Dent Res,1985,64(8):1026-1030.
[9] Sliva TA,Garlet GP,Fukada SY,et al.Chemokines in oral inflammatory diseases:apical periodontitis and periodontal disease[J].J Dent Res,2007,86(4):306-319.
[10] Gunn MD,Nelken NA,Liao X,et al.Monocyte chemoattractant protein-1 is sufficient for the chemotaxis of monocytes and lymphocytes in transgenic mice but requires an additional stimulus for inflammatory activation[J].J Immunol,1997,158(1): 376-383.
[11] Brudvik P,Rygh P.The initial phase of orthodontic root resorption incident to local compression of the periodontal ligament[J].Eur J Orthod,1993,15(4):249-263.
[12] Brudvik P,Rygh P.Non-clast cells start orthodontic root resorption in the periphery of hyalinized zones[J].Eur J Orthod,1993,15(6):467-480.
[13] 卢嘉静,葛振林.正畸致牙根吸收的分子生物学研究进展[J].国际口腔医学杂志,2008,35(5):599-602.
[14] Nebel D,Jonsson D,Norderyd O,et al.Differential regulation of chemokine expression by extrogen in human periodontal ligament cells[J].J Periodont Res,2010,45(6):796-802.
[15] Oqura N,Satoh K,Akutsu M,et al.MCP-1 production in temporomandibular joint inflammation[J].J Dent Res,2010,89 (10):1117-1122.
