脂氧素A4、保护素D1、ResolvinD1抑制多种激动剂引起的NFκB的活化
2012-01-30鲍华燕中国医学科学院北京协和医学院药物研究所北京100050
鲍华燕,严 君,李 珂,刘 鹏(中国医学科学院北京协和医学院药物研究所,北京100050)
炎症是多种疾病发生发展的基本病理过程,过度的炎症反应会造成机体自身组织的损伤。核因子κB(nuclear factor-kappa B,NFκB)是一类重要的核转录因子,启动和调节多种免疫和炎症相关的基因转录[1],受 NFκB调控的炎症蛋白包括 MCP-1、ICAM-1、TNFα等[2]。
热休克蛋白(heat-shock protein,HSPs)、高迁移率族蛋白(high-mobility group protein B,HMGB)1、S100蛋白均可以刺激胞内炎症反应,促进炎性因子释放[3~5]。脂氧素、保护素、Resolvin是近几年发现的一类对于炎症的转归具有重要调节作用的内源性脂质介质[6,7]。本实验旨在研究 LXA4、ProD1和RvD1对NFκB活性的影响,为其在制备抗炎药物中的应用提供依据。
1 材料和方法
1.1 材料 DMEM培养液、新生牛血清均购自美国Gibco公司,胰酶和LPS均购自美国Sigma公司,Glo-Max 96微孔板发光检测仪和荧光素酶检测试剂盒均购自美国Promega公司,NFκB p65抗体购自美国Cell Signal Technology公司,TNFα ELISA试剂盒购自美国eBioscience公司,HSP70购自加拿大StressMarq公司,HMGB1购自美国R&D公司,S100A4购于北京义翘神州生物技术有限公司,LXA4、ProD1和RvD1均购自美国Cayman公司,细胞核蛋白抽提试剂盒购自碧云天生物技术有限公司,BCA蛋白定量试剂盒由武汉博士德生物工程有限公司生产。
1.2 细胞培养 稳定表达NFκB荧光素酶报告基因的中国仓鼠卵巢细胞(CHO,由本实验室构建)培养于DMEM培养液,培养液中加入10%新生牛血清,37℃、5%CO2。
1.3 细胞分组及处理 将生长良好的细胞用胰酶消化处理后,显微镜下对细胞进行计数并计算细胞密度,用细胞培养液稀释细胞悬液置于96孔板内,控制细胞数量约为1×104个/孔,置于细胞培养箱中约24 h待细胞贴壁后备用。
将细胞分为3大组:空白对照组,细胞培养板内单纯加入 DMEM培养液;LXA4/ProD1/RvD1+ LPS/HSP70/HMGB1/S100A4组,细胞培养板内首先分别加入终浓度为100 nmol/L的LXA4/ProD1/ RvD1预处理CHO细胞30 min,然后分别加入终浓度为1 μg/ml的LPS/HSP70/HMGB1/S100A4对细胞进行刺激;单纯LPS/HSP70/HMGB1/S100A4组,细胞培养板内与上组细胞同一时间分别加入终浓度为1 μg/ml的LPS/HSP70/HMGB1/S100A4刺激细胞。各组细胞经过相应处理24 h后,测定细胞内NFκB活性以及上清中TNFα的含量。
1.4 测定细胞内NFκB活性 弃去细胞培养液,用生理盐水将贴壁的CHO细胞清洗2次,加入裂解缓冲液反应约15 min,向裂解产物中加入荧光素酶检测试剂,严格按照荧光素酶检测试剂盒说明书操作,使用Glo-Max 96微孔板发光检测仪评价细胞内NFκB活性。
1.5 ELISA检测细胞培养上清中TNFα的含量移液枪移取细胞培养上清液,严格按照ELISA试剂盒说明书操作测定上清液中TNFα的含量。
1.6 Western blot分析胞核中NFκB的含量 用细胞刮子将各组细胞刮下,严格按照细胞核蛋白与细胞浆蛋白抽提试剂盒说明书操作,提取胞核、胞浆蛋白。按照BCA蛋白定量试剂盒说明书对蛋白进行定量;蛋白变性后,经SDS-PAGE电泳,用湿转法印记于PVDF膜;用5%脱脂奶粉室温封闭1 h,加入抗NFκB p65抗体4℃孵育过夜;次日用TBST洗涤后加入相应的辣根酶标记的二抗,室温孵育1 h;洗涤后显色。用Western blot印迹分析软件(Gelpro3.2)计算各条带光密度值,分析蛋白表达情况。
1.7 统计分析 实验结果用均值±标准误(Mean ±SE)表示。使用SPSS 13.0专业统计软件,经参数或者非参数方差检验,经比较P<0.05认为有统计学差异,P<0.01认为有明显统计学差异。
2 结果
2.1 LPS/HSP70/HMGB1/S100A4显著上调细胞NFκB活性 各组细胞分别经相应的处理后,测定其NFκB的活性,对照组细胞内NFκB的活性维持在较低的水平,经LPS/HSP70/HMGB1/S100A4刺激后,细胞内NFκB活性显著升高(P<0.05,图1)。但四种物质激活NFκB活性的强度不尽相同,其中 LPS的激活作用最强,HSP70作用次之,HMGB1和S100A4对NFκB活性的刺激作用相当。
2.2 LPS/HSP70/HMGB1/S100A4显著增加胞外TNFα的含量 与对照组相比,细胞经LPS/HSP70/ HMGB1/S100A4处理后,分泌到胞外的TNFα的量显著增加(P<0.05,图2)。四种物质中LPS刺激细胞分泌TNFα的作用最强,HMGB1作用最弱,HSP70和S100A4作用相当。
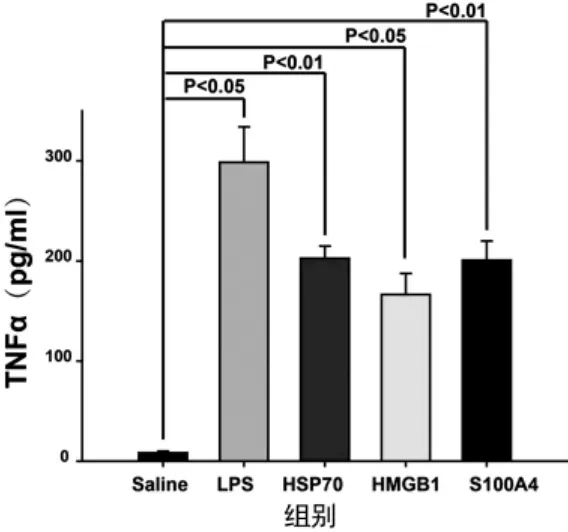
图2 LPS、HSP70、HMGB1、S100A4对细胞分泌TNFα的影响LPS/HSP70/HMGB1/S100A4显著增加胞外TNFα的含量,独立实验重复4次。
2.3 LXA4/ProD1/RvD1下调细胞NFκB活性 与单纯LPS/HSP70/HMGB1/S100A4刺激的细胞相比,加入LXA4/ProD1/RvD1预处理的细胞,其NFκB的活性显著被抑制(P<0.05,图3),不同的物质对NFκB活性的抑制程度存在差异,与对照组相比,LXA4抑制NFκB活化的作用最为显著(P<0.01)。
2.4 LXA4/ProD1/RvD1显著减少胞外TNFα的含量 与单纯LPS/HSP70/HMGB1/S100A4刺激的细胞相比,加入LXA4/ProD1/RvD1预处理的细胞,分泌到胞外的TNFα的量显著减少(P<0.05,图4),但LXA4、ProD1或RvD1对TNFα分泌的抑制程度存在一定的差异。
2.5 LXA4/ProD1/RvD1减少NFκB的入核 与单纯LPS/HSP70/HMGB1/S100A4刺激的细胞相比,加入LXA4/ProD1/RvD1预处理的大部分组别细胞,其胞核内NFκB p65的含量明显降低(图5)。但其中,ProD1、RvD1并不能抑制由HMGB1和S100引起的NFκB的入核。
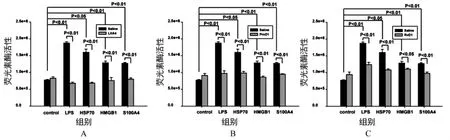
图3 LXA4、ProD1、RvD1显著抑制NFκB活性A-LXA4处理组;B-ProD1处理组;C-RvD1处理组,独立实验重复4次。

图4 LXA4、ProD1、RvD1显著减少上清中TNFα含量A-LXA4处理组;B-ProD1处理组;C-RvD1处理组,独立实验重复4次。

图5 LXA4/ProD1/RvD1对NFκB入核的影响A-LXA4处理组;B-ProD1处理组;C-RvD1处理组,独立实验重复4次。HT〛
3 讨论
炎症是机体抵抗病原入侵、修复组织细胞损伤的重要防御机制之一,若炎症反应持续维持在较高的水平会对机体造成损伤,甚至导致组织的纤维化。炎症的转归是指浸润在组织局部的白细胞及细胞碎片等被从炎症部位清除,使组织重新恢复稳态[8]。炎症的转归并不是炎症反应的被动终止,而是一个主动的代谢过程[9,10]。一些脂质小分子在炎症的转归过程中具有重要的作用,脂氧素、保护素、Resolvin即是其中重要的一族,在机体内,它们主要由ω-3不饱和脂肪酸在5-脂氧合酶、15-脂氧合酶等酶类的催化下经过跨细胞途径生成[11~13]。
NFκB是一种与炎症反应密切相关的核转录因子,被NFκB激活的细胞因子,如IL-1β、TNFα可以直接进一步引起NFκB的活化,从而形成一个正调控增加炎症应答和延长慢性炎症的持续时间[14]。本实验结果表明,用LXA4、ProD1、RvD1对细胞进行预处理,能够不同程度抑制胞内NFκB的活性,减少分泌到胞外的TNFα的量,其对NFκB活性的抑制作用与其抑制胞浆NFκB的入核有关,这可能是这几个脂质介质具有促进炎症转归作用的重要原因之一。Wang等人在2011年的研究发现[15],脂氧素同系物ATL能够抑制胞浆IκB的降解,阻断NFκB的入核,抑制NFκB、AP-1与DNA的结合,从而显著抑制TNFα mRNA的表达,其抑制作用接近100%。本实验中,LXA4抑制由LPS、HSP70引起的NFκB活化的作用最为显著,LXA4使细胞在LPS、HSP70刺激下的NFκB活性降低到接近正常细胞水平,因此推测LXA4对NFκB的激活具有强抑制作用的机制可能也与上述报道一致,这进一步说明LXA4等脂质小分子具有被进一步研究和开发的潜力。另外,本研究发现LXA4、ProD1、RvD1各自对细胞活化NFκB和产生TNFα的抑制作用强度存在较大差异,造成这种差异的内在机制还有待更加深入的研究。
NFκB作为炎症反应中的一个重要的转录因子,从理论上说,如果能特异性地拮抗其活性,就可以起到高效的抗炎免疫效果。目前多种传统抗炎药,如糖皮质激素、阿司匹林、水杨酸钠等,就是通过多种途径抑制NFκB等转录因子的活性,有效降低相关炎症介质的表达和释放。目前已有研究证明,LXA4、ProD1、RvD1具有抗炎和促炎症转归的双重作用[16],虽然这3种脂质介质发挥作用的具体分子机制和信号途径还需要进一步的深入研究,但是本实验为治疗一些炎性疾病提供了新的思路,对于研究开发新型的小分子抗炎药具有重要的参考价值。
[1] Shames BD,Selzman CH,Meng XZ,et al.Genes don't count[J].Arch Sung,1998,133(6):667.
[2] Nemeth ZH,Hasko G,Vizi ES.Phrrolidine dithiocarbamate augments IL-10,inhibits TNF-alpha,MIP-1alpha,IL-12,and nitric oxide production and protects from the lethal effect of endotoxin[J].Shock,1998,10(1):49.
[3] Hamada N,Maeyama T,Kawaguchi T,et al.The role of high mobility group box l in pulmonary fibrosis[J].Am J Respir Cell Mol Biol,2008,39:440.
[4] Vabulas RM,Ahmad NP,Ghose S,et al.HSP70 as endogenous stimulus of the Toll/interleukin-1 receptor signal pathway[J].J Biol Chem,2002,277:15107.
[5] Foell D,Frosch M,Sorg C,et al.Phagocyte-specific calcinm-binding S100 proteins as clinical laboratory markers of inflammation[J].Clin Chim Acta,2004,34:37.
[6] Canny G,Levy O,Furuta GT,et al.Lipid mediator-induced expression of bactericidal/permeability-increasing protein(BPI)in human mucosal epithelia[C].Proc Natl Acad Sci USA,2002,99:3902.
[7] Campbell EL,Louis NA,Tomassetti SE.et al.Resolvin E1 promotes mucosal surface clearance of neutrophils:a new paradigm for inflammatory resolution[J].FASEB J,2007,21:3162.
[8] Serhan,CN.A search for endogenous mechanisms of anti-inflammation uncovers novel chemical mediators:missing links to resolution[J].Histochem Cell Biol,2004,122:305.
[9] Bannenberg GL,Chiang N,Ariel A,et al.Molecular circuits of resolution:formation and actions of resolvins and protectins[J].J Immunol,2005,174:4345.
[10] Serhan CN,Brain SD,Buckley CD,et al.Resolution of inflammation:state of the art,definitions and terms[J].FASEB J,2007,21:325.
[11] Levy BD,Kohli P,Gotlinger K,et al.Protectin D1 is generated in asthma and dampens airway inflammation and hyperresponsiveness[J].J Immunol,2007,178:496.
[12] Duffield JS,Hong S,Vaidya VS,et al.Resolvin,series and protectin D1 mitigate acute kidney injury[J].J Immunol,2006,177:5902.
[13] Mitchell,S,Thomas G,Harvey K,et al.Lipoxins,aspirin-triggered epi-lipoxins,lipoxin stable analogues,and the resolution of inflammation:stimulation of macrophage phagocytosis of apoptotic neutrophils in vivo[J].J Am Soc Nephrol,2002,13:2497.
[14] Oeckinghaus A,Ghosh S.The NF-kappaB family of transcription factors and its regulation[J].Cold Spring Harb Perspect Biol,2009,1(4):1.
[15] Wang YP,Wu Y,Li LY,et al.Aspirin-triggered lipoxin A4 attenuates LPS induced pro-inflammatory responses by inhibiting activation of NFκB and MAPKs in BV-2 microglial cells[J].J Neuroinflammation.2011,8:95.
[16] Serhan CN,Chiang N,Thomas E,et al.Resolving inflammation:dual anti-inflammatory and pro-resolution lipid mediators[J]〛.Nat Rev Immunol,2008,8(5):349.
