自生固氮菌的筛选及其在灭菌土壤中的生长特性
2012-01-29黄慧岳谢达平
黄慧岳,谢达平
(湖南农业大学生物科学与技术学院,湖南 长沙 410128)
氮是农作物生长所必须的营养元素[1]。在农业生产中,氮被视为衡量土壤养分状况乃至土壤肥力的一个重要指标[2]。作物每年都要从土壤中带走大量的氮素,为补充土壤氮素的损失,工业化学氮肥至今仍然是人类向土壤补给氮素的重要来源。而工业氮肥的使用造成了土壤酸化和环境污染等一系列问题,阻碍了农业的可持续发展[3-5]。利用固氮微生物和联合固氮微生物等生物固氮来提高土壤无机氮含量是土壤氮肥补充的有效途径[6]。利用固氮微生物提高农作物产量的研究国内报道较多,其中有选用内生固氮菌的,也有选用自生固氮或联合固氮微生物的。笔者拟从土壤分离出的自生固氮菌为试验材料,测定其固氮能力和对水稻苗生长的影响,并选择固氮力较强的菌株,施用于土壤,检测其在土壤中的变化趋势和对土壤氮含量的影响,以期寻找到有应用价值的固氮微生物。
1 材料与方法
1.1 材料
1.1.1 供试菌株 试验菌株为自生固氮菌,分离出该菌株的4份土壤来自湖南农业大学,采集地点分别为艺苑、实验基地、二食碗池周边、八教垃圾收集处周边。
1.1.2 培养基 Ashby无氮培养基:甘露醇1%,KH2PO40.02%,MgSO4·7H2O 0.02%,NaCl 0.02%,CaSO4·2H2O 0.01%,CaCO30.5%。固体培养基另加琼脂8%。
1.1.3 仪 器 恒温摇床、超净工作台、试管、培养皿、移液管、烧杯、恒温培养箱、三角瓶、量筒、蒸汽电热灭菌锅、吸管、电子天平、pH计、紫外分光光度计、涂布棒、酒精灯、移液枪、凯氏定氮仪等。
1.2 方法
1.2.1 自生固氮菌的初筛及形态观察 从湖南农业大学4个不同区域采取土壤样品,制备土壤菌悬液并取上清液在试管中作梯度稀释。选取菌悬液0.1 mL涂布于Ashby无氮培养基上,28℃恒温培养4 d,统计固氮菌的菌落数量。选取长势良好的菌株,用接种环挑取不同种类的单菌落,接种到新鲜的无氮培养基上,连续划线纯化3次,筛选的优势菌株用30%甘油-70℃保存备用。
用接种环挑取菌落,制备镜检标本,革兰氏染色,观察其菌体形态特征[7-9]。
1.2.2 高效固氮菌株的筛选及对水稻苗生长的影响 (1)菌株固氮能力测定:菌株在无氮培养基中连续3次分离纯化后,选取长势良好的优势菌,进行摇瓶培养,菌液含菌量为2×106cfu/mL,每个菌株重复培养3瓶。以10%接种量于250 mL摇瓶中培养,培养液总体积50 mL,30℃培养7 d后,用比浊法(OD600值法)评估细菌数量,用微量凯氏定氮法测定最终菌液的含氮量,筛选固氮能力较强的菌株[10]。(2)菌株对水稻苗生长的影响。将筛选得到的4株固氮菌株(A1、A2、A3、A4),分别接种到 100 mL 无氮液体培养基中,28℃摇瓶培养5 d后血球计数板计数,用去离子水稀释,获得106cfu/mL的菌悬液。将洗净灭菌的石英砂(粒径为2.0 mm)等量分装到直径12 cm的培养皿中,分别加入以上4种稀释到同浓度的固氮菌液20 mL,设置1个无菌对照,每个培养皿移种催芽露白的水稻种子20粒。处理和对照均重复3次。培养10 d后测量水稻苗的高度,用spss 16.0软件进行统计分析。
1.2.3 自生固氮菌对土壤的影响 用固氮能力较强、对水稻生长起促进作用的菌株接种于土壤,对土壤中氮细菌数量及土壤含氮量进行测定。取筛选的自生固氮菌接种于100 mL无氮液体培养基,摇床培养4 d,对细菌计数并稀释菌液使其活细菌浓度为2×106cfu/mL。取稀释后的菌液100 mL均匀加入到已灭菌的1 kg土壤样品中,另外取1 kg已灭菌土壤样品作为对照样品。将样品置于实验室内自然环境下40 d,每隔5 d补充喷洒适量蒸馏水,保持土壤湿度恒定。
(1)土壤中氮细菌数量的变化:在施用菌液后0、5、10、20、30、40 d,利用最大或然计数法(MPN)[11]对土壤中的细菌含量进行跟踪测定。称取1 g土壤样品,用无菌水稀释,于脱色摇床震荡30 min,摇匀,取稀释度10-1~10-7,分别进行平板活菌计数。取灭菌氮细菌固体培养基,并用不同稀释度稀释菌液各0.1 mL进行Ashby无氮培养基平板涂布,30℃培养5 d后进行平板菌落计数。从最大或然数表中查出最大或然数近似值,按下列公式计算样品中的微生物数量:
土壤固氮菌数量(cfu/g)=MD/W
式中M为最大或然数近似值;D为全部出现菌落的最高稀释倍数;W为土壤质量(g)。
(2)土壤中总氮含量的测定:凯氏定氮仪检测法[12]测定土壤中总氮含量,分析施用固氮菌后对土壤中氮含量的影响。
2 结果与分析
2.1 自生固氮菌的初筛及形态观察
利用无氮培养基平板,从供试的4种土壤中分离出了具潜在固氮能力、菌落形态不同的菌株23个。通过纯化培养、革兰氏染色观察后,从4个土壤样品分离的菌株各挑取1个典型菌株进行研究,分别命名为 A1、A2、A3、A4。如表 1 所示,A1、A2 和A4菌株为革兰氏阳性菌,有芽孢产生,其菌落呈圆形,表面较干燥。A3为革兰氏阴性菌,无芽孢产生,菌落形态不规则。
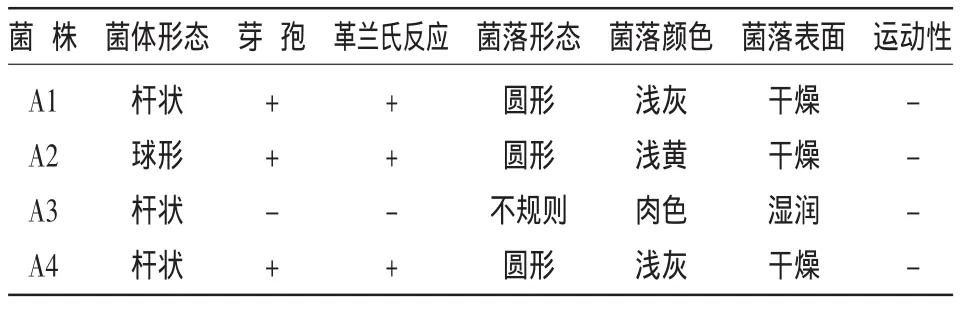
表1 固氮细菌的菌体形态和菌落特征
2.2 高效固氮菌株的筛选及对水稻苗的影响
2.2.1 固氮能力检测 4株固氮菌摇瓶培养后,其生长数量、菌体和介质的总氮含量见表2。由于 试验采用的是无氮培养基,因此氮含量可用于评估菌株的自生固氮能力。如表2所示,菌株A1、A2、A3、A4都有一定的固氮能力。总体来看,A1、A2的数量较大,其固氮能力也较强;而A3的数量一般,固氮能力最弱;A4生长最缓慢,其固氮能力一般。
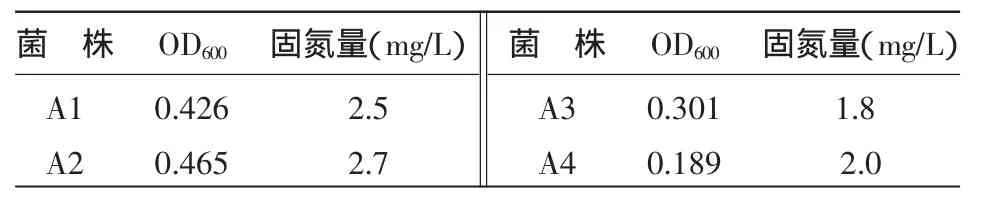
表2 菌株固氮能力检测
2.2.2 对水稻苗生长的影响 固氮菌接种发芽水稻10 d后检测生长相关的指标,结果如表3所示,A1对水稻的促进作用一般;A2和A3对水稻苗生长促进作用较为明显,与对照有显著性差异;A4与水稻苗共培养后,水稻长势不好,甚至对水稻产生致病症状。研究结果表明,菌株A2的固氮作用较强、增殖能力较好,对水稻有明显的促进生长作用。因此,选用菌株A2进行土壤中的生长特性研究。

表3 4株不同固氮菌对水稻生长的影响
2.3 固氮菌在灭菌土壤中的生长特性
2.3.1 灭菌土壤中氮细菌数量的变化 对接种A2固氮菌的土壤用MPN法测定菌数,通过查询最大或然数表计算得出土壤总固氮菌数。接种培养0、5、10、20、30、40 d 后,土壤中固氮菌含量分别为1.9×105、4.0×105、5.0×106、2.2×107、9×106、5×106cfu/g。土壤固氮菌数量变化趋势如图1所示,固氮菌含量在第20天达到峰值,为2.2×107cfu/g,曲线呈现指数型增长,直至第30天细菌开始衰亡。
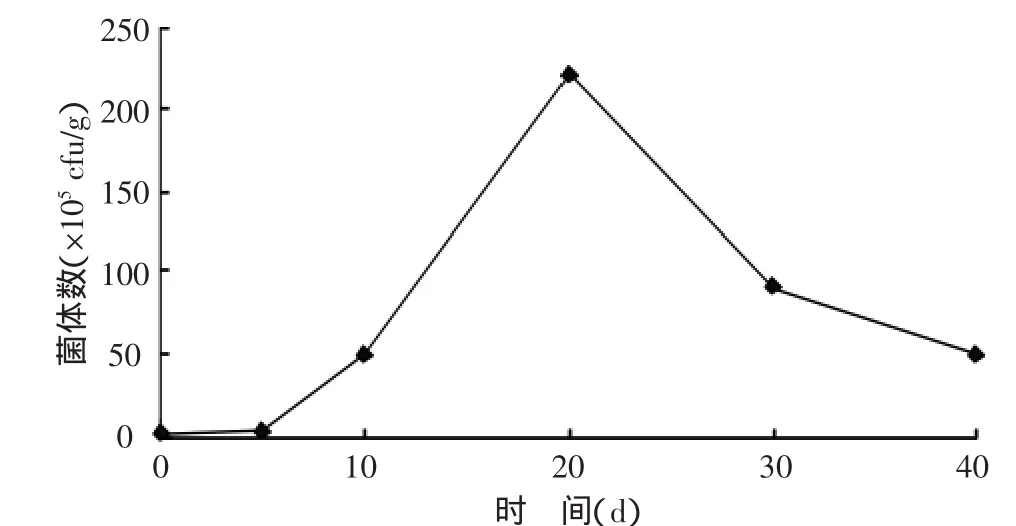
图1 灭菌土壤固氮菌数量变化趋势
2.3.2 灭菌土壤中总氮含量的变化 接种菌株A2培养 0、5、10、20、30、40 d 后,土壤氮含量分别为0.007%、0.014%、0.063%、0.280%、0.245%、0.252%。如图2所示,从施用固氮菌开始,前20 d土壤中氮含量随着固氮菌数量的增加而持续增加,与菌体数量基本呈现正相关关系,且于培育的第20天土壤中总氮含量达到峰值0.280%。根据全国第二次土壤普查土壤养分分级表,该值已达到一级土壤全氮含量标准指标(数据)以上。30 d后土壤全氮含量并不与微生物数量呈对应相关关系,随着固氮菌开始出现衰亡,前阶段所固定氮素并没有随着细菌的死亡而消失,而是持续保留于土壤中。
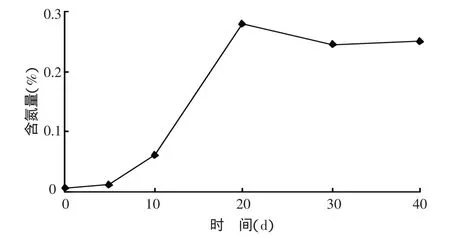
图2 灭菌土壤氮含量变化趋势
3 小结
灭菌土壤中施用自生固氮菌后,培养约20 d固氮菌数量达到最大,为2.2×107cfu/g,固氮菌数量增加约100倍。土壤中全氮含量高于国家土壤养分分级表全氮含量的一级标准。自生固氮菌作为活性微生物,在不同环境下其生物学特征、固氮能力、增殖能力等都有可能发生变化[13],这将有待于进一步的研究。
[1]张世清,李庆洋,高建明,等.24株剑麻根际联合固氮菌的16S rDNA 序列分析[J].江西农业学报,2011,23(11):132-134.
[2]Ye J Q,Yuan R X,Yu H Y,et al.Dynamic changes of nitrogen in salinealkaline paddy field and its potential environmental impacts[J].Agricultural Science&Technology,2011,12(3):443-450,460.
[3]IFA.Sustainable Management of the Nitrogen Cyclein Agriculture and Mitigation of Reaetive Nitrogen Side Effects.Firsted[M].Paris:International Fertilizer Industry Assoeiation,2007.
[4]席寅峰,张孟婧,黄小帅,等.1株光合细菌的分离鉴定及其脱氮能力研究 [J]. 安徽农业科学,2010,38 (27):14847-14849,14875.
[5]Xu F X,Xiong H,Zhang L,et al.Variation of nitrogen uptake and utilization efficiency of mid-season hybrid rice at different ecological sites under different nitrogen application levels[J].Agricultural Science&Technology,2011,12(7):1001-1009,1012.
[6]Jaeoud C,Job D,Wadoux P ,et al.Initiation of root growth stimulation by Azospzillum lipoferum CRTI during maize seed germination[J].Mierobiology,1999,45:339-342.
[7]沈 萍,范秀容,李广武.微生物学实验[M].北京:高等教育出版社,2000.
[8]郭立忠,毕建水,祝王业,等.微生物菌肥中三类菌株的分离、纯化与部分性质鉴定[J].莱阳农学院学报,2002,(4):248-250.
[9]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[10]鲍士旦.土壤农化分析[M].北京:中国农业出版社,2000.
[11]杨从发,王淑军,陈 静,等.自生固氮菌的分离鉴定[J].淮海工学院学报,1998,8(3):56-58.
[12]胡江春,薛德林,马成新,等.植物根际促生菌(PGPR)的研究与应用全景[J].应用生态学报,2004,15(10):1963-1966.
[13]张崇邦,金则心,施时迪.浙江天台山几种林型下土壤细菌生理群生态分布的特性[J].植物生态学报,2002,26(3):269-274.
