短期高浓度氟对小鼠磨牙成釉细胞内BMP-2表达的影响
2012-01-29冀章章梅陵宣
冀章章 夏 荣 梅陵宣
1.安徽医科大学第二附属医院口腔科,安徽合肥230601;2.安徽医科大学附属口腔医院口腔内科,安徽合肥230032
牙齿发育是由牙源性上皮与颅神经嵴来源的间充质相互作用的结果,研究表明一些生物信号分子在牙胚发育过程中呈时空特异性表达,并相互作用,调控细胞的生长和分化,决定牙胚发育的进程。在此阶段机体摄入过量的氟会损伤成釉细胞,引起牙釉质结构发生改变,致使氟牙症的形成[1],骨形成蛋白-2(bone morphogenetic protein-2,BMP-2)作为牙齿发育阶段的重要信号分子,其特异性发生机制目前尚无定论。本实验通过研究小鼠下颌第一磨牙牙胚内分泌期和成熟期成釉细胞形态改变及BMP-2的表达,探讨氟引起牙釉质发育障碍的可能原因。
1 材料与方法
1.1 一般材料
32只4日龄的ICR小鼠(安徽省实验动物中心提供,SPF级),BMP-2单克隆抗体(Abcam公司,美国),SP法免疫组化试剂盒和DAB显色剂(北京中杉公司),微量移液加样器(50μL,中国),Nikon eclipase 80i显微镜及数码成像系统(Nikon公司,日本),RM2245切片机(Leica公司,德国)。
1.2 方法
1.2.1 分组 按照随机抽取及分配的原则,分别从8只母鼠窝内抽取32只4日龄的ICR小鼠(雌雄各半),根据单次腹腔注射氟剂量的不同,平均分成两组,每组16只,各组再平均分成实验组和对照组,每组8只。将10 mg/kg(体重)(实验组1)和20 mg/kg(体重)(实验组2)的NaF分别单次注入实验组动物腹腔内,将等剂量的NaCl分别单次注入对照组动物腹腔内,注射量均为10μL/g,完成后所有动物返回各自母亲。在实验前后监测所有动物体重,分析不同浓度氟对体重变化的可能影响。
1.2.2 标本处理 所有小鼠在药物注射24 h后被断颈处死,含有下颌第1磨牙牙胚的下颌骨被分离并取出(其上不含有软组织),立刻将其置于4%多聚甲醛液(4℃,现用现配)中固定24 h;梯度乙醇脱水,二甲苯透明,石蜡定向包埋;从近远中向沿颊面4μm连续切片,以多聚赖氨酸处理的载玻片捞片,在60℃烤箱中烤片12 h,备用。
1.2.3 HE染色 采用常规HE染色含有小鼠下颌第1磨牙牙胚的下颌骨,在光镜下观察不同发育阶段成釉细胞的形态。
1.2.4 免疫组化染色 采用SP法。室温下切片脱蜡至水,灭活内源性过氧化物酶,3% H2O2室温下孵育10 min,0.01 mol/L、pH=7.4的磷酸盐缓冲溶液(PBS)冲洗3~5 min,甩去多余液体。滴加抗原修复,正常羊血清工作液封闭,室温下10 min,倾去勿洗,滴加BMP-2单克隆抗体(1︰300),4℃湿盒过夜,PBS冲洗3~5 min(以0.01 mol/L PBS液代替一抗作阴性对照)。室温下复温半小时,滴加生物素标记二抗试剂,室温下孵育30 min,PBS冲洗3~5 min。滴加辣根过氧化物酶标记的工作液,室温下孵育30 min,PBS冲洗3~5 min。DAB/ H2O2反应染色,蒸馏水充分冲洗后,苏木素复染,常规脱水,透明,干燥,封片。将免疫组化染色结果在JEDA 810D形态学图像分析系统中进行灰度分析,BMP-2阳性染色为棕黄色。
1.3 统计学处理
采用SPSS 13.0统计软件对注射药物24 h后的所有动物体重进行t检验,单因素方差分析(ANOVA)灰度值。
2 结果
2.1 药物注射结果
所有动物实验过程中均未见死亡,实验动物和对照动物的体重在注射药物24 h后的差异无统计学意义(P>0.05)。见表1。
表1 药物注射24 h后动物的体重比较(±s,g)

表1 药物注射24 h后动物的体重比较(±s,g)
药物剂量 对照组(NaCl) 实验组(NaF) tP 10 mg/kg 20 mg/kg 0.117 0.815 3.626±0.149 3.658±0.121 3.728±0.085 3.673±0.131 1.669 0.238
2.2 HE染色结果
对照组:处于分泌阶段的成釉细胞中细胞核远离基底膜,呈高柱状整齐均匀排列,托姆斯突在靠近釉质-牙本质侧形成,红染的釉基质均匀分布;处于过渡阶段的成釉细胞形态显著变短,其中包含退缩的托姆斯突;处于成熟阶段的成釉细胞形态由高柱状逐渐向矮立方状转化。
实验组:氟引起的改变在两组中几乎相同,囊腔样损害形成于部分分泌期和过渡期的成釉细胞下方,囊腔上方的成釉细胞高度变矮,正常的柱状结构丧失,扭曲变性,伴有不同程度的空泡性变,托姆斯突排列紊乱甚至消失,囊腔下方相对的部分釉质表面出现不规则的阳性改变,但这些损害被限制在相对孤立的区域,两组中成熟期成釉细胞及对应的釉质未发现组织学上的异常。见图1。

图1 实验组磨牙组织学观察(×400)
2.3 免疫组化染色结果
对照组中,BMP-2表达在牙乳头细胞、成牙本质细胞、星网状层细胞、中间层细胞及成釉细胞中。实验组与对照组相比,分泌期和过渡期的成釉细胞中阳性表达明显减弱。见图2。
运用成像系统分析标本玻片图像的镜下结果,量化后通过ANOVA检验不难看出,成熟期组P>0.05,未见明显变化,而随着氟浓度的升高,BMP-2的表达逐渐减弱,二者呈负相关,且P值在分泌期和过渡期组中均<0.01。见表2。
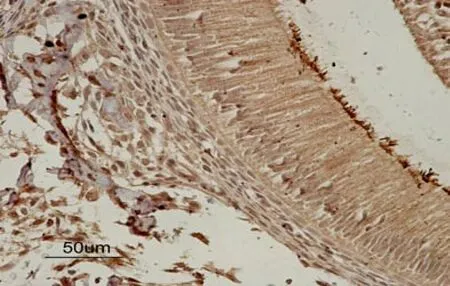
图2 实验组BMP-2在相关组织中的表达(×400)
表2 不同分化时期的成釉细胞中BMP-2表达情况比较(±s)
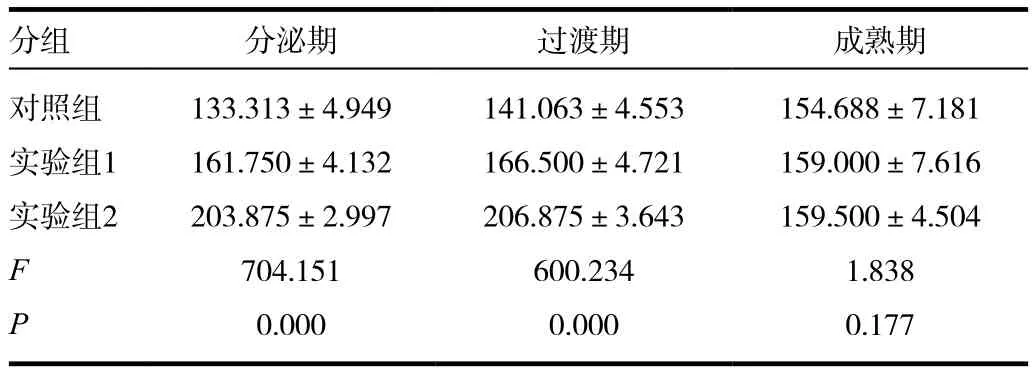
表2 不同分化时期的成釉细胞中BMP-2表达情况比较(±s)
分组 分泌期 过渡期 成熟期对照组实验组1实验组2 FP 133.313±4.949 161.750±4.132 203.875±2.997 704.151 0.000 141.063±4.553 166.500±4.721 206.875±3.643 600.234 0.000 154.688±7.181 159.000±7.616 159.500±4.504 1.838 0.177
3 讨论
骨形成蛋白(bone morphogenetic proteins,BMPs)最初被认为是具有骨诱导性的一种高效充质细胞,转化形成软骨及骨组织,在之后的研究过程中人们进一步发现它是一组多功能生长因子,通过刺激新骨的形成和在上皮-间充质中传递信号等方式影响器官功能发育[2]。BMPs是与骨和牙齿形成相关的生长因子,属于转化生长因子β超家族,在机体多种组织和器官的形态发生中起重要调控作用。在牙髓生物学领域,在牙胚发育、成牙本质细胞分化和牙髓损伤修复中,BMP-2作为上皮间充质之间的一种信号分子,通过细胞黏附分子、核内转录因子的表达、细胞外基质的调节等方面发挥一定的作用[3-5]。Nadiri A[6]发现,BMP-2不仅在成牙本质细胞分化阶段大量表达,而且在鼠牙胚发生和早期发育阶段有表达且与BMP-4关系密切,二者共同参与调控同源盒转录因子表达,BMP-2、BMP-4同时短暂表达于成牙釉细胞和成牙本质细胞分化过程中。Miyoshi K[7]认为,BMP-2 mRNA在帽状期首先被检测出来,胚胎发育的第14天(E14),牙尖部的内釉上皮细胞中局限表达,在上皮中的转录2 d后丧失,随后在牙乳头的间充质细胞有表达,钟状期、E17~E18,BMP-2 mRNA仍然表达于牙髓干细胞,此为牙乳头的中心细胞,到了成牙本质细胞、成釉细胞分化终末这种表达形式才消失。前成牙本质细胞分化终末期时BMP-2 mRNA出现,其表达进一步增加于成牙本质细胞分泌期,并且一直存在于这些细胞中直到出生后4 d。
学者们通过研究认为,氟斑牙的发生是由于在牙齿发育期间机体摄入过量氟所致,相关的形成机制主要有生物个体的差异;处于敏感阶段的成釉细胞暴露在高浓度的氟中,使得后续形成的釉质蛋白的降解和移除被延缓,釉基质蛋白水解酶的分泌和活性降低,从而清除釉基质的时间延长;氟对羟基磷灰石晶体的影响等[8-10]。本实验笔者选择4~5日龄小鼠第一磨牙牙胚为研究模型,可以同时观察到作为釉质形成唯一的上皮源性细胞——成釉细胞处于分泌期,过渡期和成熟期等不同的分化阶段,经历增殖、分化以及形态功能的演变,并且与切牙相比,第一磨牙是有限生长的,与人类牙齿更接近。
通过连续切片可以看出:对于釉质的正常形成起着决定性作用的部分成釉细胞下相对存在囊腔样损害,受侵袭的程度以靠近囊腔的细胞最严重,对F-的敏感性随着成釉细胞处于不同的分化阶段而改变,这些形态学上的不利影响在处于成熟阶段的成釉细胞中几乎未见。笔者推测:本实验药物浓度条件下,在注射药物24 h内,成釉细胞形态上的明显差异未曾发生,或是这些细胞发育时序相同,即由分泌阶段向过渡阶段转化。这与Hirota L等的研究结果部分一致,他们认为摄入过量的氟很难对处于成熟期成釉细胞产生影响,却能够造成分泌期成釉细胞内粗面内质网、线粒体的膨胀损伤,异位物质压迫托姆丝突致使紊乱、使得细胞的水肿变性、空泡形成成为可能[11]。
笔者认为可能在过量氟的影响下, BMP-2蛋白的表达被抑制, 进而引起成釉细胞的分化和随后的基质分泌功能低下,细胞形态和功能上的改变发生于分泌期和过渡期,造成功能性细胞数量减少,从而使得釉质发育障碍,导致了氟斑牙的形成。这可能是高氟致使釉质发育缺陷的机制之一。
[1] DenBesten PK.Biological mechanisms of dental fluorosis relevant to the use of fluoride supplements[J].Community Dent Oral Epidemiol,1999,27(1):41-47.
[2] Nadiri A,Kuchler-Bopp S,Perrin-Schmitt F,et al.Expression patterns of BMPRs in the developing mouse molar[J].Cell Tissue Res,2006,324(1):33-40.
[3] 梁俊,侯铁舟.骨形成蛋白2及骨形成蛋白4在牙胚发育中的时空表达及意义 [J].医学综述,2010, 16(15):2257-2259.
[4] Yao S,Prpic V,Pan F,et al.TNF-alpha upregulates expression of BMP-2 and BMP-3 genes in the rat dental follicle--implications for tooth eruption[J].Connect Tissue Res,2010,51(1):59-66.
[5] Handrigan GR,Richman JM.Unicuspid and bicuspid tooth crown formation in squamates[J].J Exp Zool B Mol Dev Evol,2011,316(8):598-608.
[6] Nadiri A,Kuchler-Bopp S,Haikel Y,et al.Immunolocalization of BMP-2/-4,FGF-4,and WNT10b in the developing mouse first lower molar[J].J Histochem Cytochem,2004,52(1):103-112.
[7] Miyoshi K,Nagata H,Horiguchi T,et al.BMP2-induced gene profiling in dental epithelial cell line[J].J Med Invest,2008,55(3-4):216-226.
[8] 郭媛珠,凌均棨,陈成章.氟与口腔医学[M].北京:科学技术文献出版社,2000:95.
[9] Everett ET,Yin Z,Yan D,et al.Fine mapping of dental fluorosis quantitative trait loci in mice[J].Eur J Oral Sci,2011,119(suppl 1):8-12.
[10] Everett ET,McHenry MA,Reynolds N,et al.Dental fluorosis:variability among different inbred mouse strains[J].J Dent Res,2002,81(11):794-798.
[11] Ribeiro DA,Hirota L,Cestari TM,et al. Ultrastructural morphometric analysis of ameloblasts exposed to fluoride during tooth development[J].J Mol Histol,2006,37(8-9):361-367.
