飞行时间二次离子质谱在生物材料和生命科学中的应用(上)
2012-01-29孙立民
孙立民
(上海交通大学分析测试中心,上海 200240)
在生物和生命科学领域中常常需要对多肽、蛋白质、DNA、细胞组织、脂质、多糖等物质的结构和含量进行表征,而许多化学和生化分析技术能够满足这样的分析要求。但是,当这些生物生命物质分布在表面或界面时,所能胜任的分析手段就局限在表面分析技术。通常需要表征的表面特性包括化学组成、结构、分子取向、不同组分的空间分布以及在生物材料表面上存留的生物分子等[1-2]。在常见的用于化学分析的表面分析技术中,飞行时间二次离子质谱(TOF-SIMS)由于自身所具有的特点,包括结构识别、出色的检出限、高的表面灵敏度及其在微米及纳米尺度上的空间分辨率等,决定了它在生命物质的表征方面具有优异而又独特的功用。TOF-SIMS能够对物质结构进行分析,由于它提供的信息深度在一个分子层内,这决定了它适合做表面的结构分析,并且具有很高的表面灵敏度。这一特性使它区别于其它分析固体样品的质谱技术,包括与其相近的基质辅助激光解吸电离质谱(MALDIMS)。TOF-SIMS具有10-6级的检出限,高的质量分辨率及优异的同位素分辨能力。除此之外,TOF-SIMS还具有化学成像(chemical mapping)及深度剖析(depth profiling)的功能,因此可以提供元素和分子的空间分布信息。在TOF-SIMS刚刚被发明使用的20世纪70年代,它就被用来尝试性地分析生物分子[3];90年代开始较为广泛地被应用于生命领域的研究;近10年来,仪器性能的不断改进,特别是团簇离子源的发明和使用,使得分子离子的二次离子产额及空间分辨率有了较大的改善。大量的应用文献表明,TOF-SIMS技术在生命领域的研究已成为“常规性”的测试手段。应用研究的内容包括蛋白质吸附、蛋白质化学法接枝到衬底表面(定量及空间取向)、组织切片、单细胞的膜结构及其中的生物组分分布(包括磷酸脂,碳氢化合物,氨基酸,多肽及痕量重金属元素等)、生物芯片(包括DNA,多糖和多肽芯片)、生物传感器、药物释放机制、疾病诊断、体内移植材料设计及改性等科学问题。
TOF-SIMS检测的基本原理是基于带有几千电子伏特能量的一次离子束轰击固体样品表面,经过物理相互作用而使样品表面产生二次离子的现象[4-5]。高速一次离子束撞击到样品表面时,导致碎片在撞击区域产生。这些碎片中大部分是中性碎片,还有带正电荷和带负电荷的碎片,这些带电荷的碎片离子被称为二次离子。当一次离子束与样品表面撞击而发生作用时,能够逃逸到真空中的二次离子中只来源于样品的最表面。因此,被收集并检测到的二次离子所反映的信息也仅仅针对样品的最表层,这就决定了TOF-SIMS是一种表面分析技术。另外,在对有机样品做分析时,仪器的操作条件必须符合静态条件,即一次离子束流密度小于1012ions/s·cm。静态条件可以保证二次离子被检测出时样品尚未被一次离子束流破坏。检测的信息深度在一个分子层范围内,即约为10~20Å。TOFSIMS仪器结构简单的讲可分为飞行时间质谱检测器、一次离子源及超高真空检测腔部分。仪器具体构造及仪器改进的历史已经在许多文章[4,6-8]中介绍,在此不再叙述。
自第一台TOF-SIMS仪器由德国的Benninghoven发明以来至今,仪器硬件的制作日趋完善。目前的仪器可以具有10-6级检出限,有出色的深度和横向分辨能力(深度可达1nm,XY可达100nm)。其中一次离子源也不断更新,从而大大改进了TOF-SIMS的使用性能。特别值得一提的是团簇源的发明(比如SF6、Aun、Bin及C60团簇源等)。使用团簇源作为一次离子源大大提高了二次离子的产额,特别是分子离子的二次离子产额,从而增强了TOF-SIMS对有机分子检测的灵敏度和结构认定能力。二次离子产额的提高同时间接地提高了空间分辨率,而使得化学成像功能得到改善。另外,采用团簇源作为溅射源增加了TOF-SIMS进行生物体的深度剖析或三维成像分析的潜力。
TOF-SIMS在生物材料研究领域中也获得了广泛的应用[9-12]。在此,将着重 围绕 TOFSIMS的3种基本分析功能,分别例举它们在生物材料领域的典型应用实例,包括蛋白质吸附机制、单个细胞、组织切片、药物释放机理、生物芯片、体内移植材料设计与改性等。另外,也将简略介绍TOF-SIMS分析方法自身存在的难题,如定量分析和数据解析以及相应的解决方法和策略。为了结构清晰,完整的综述(上下两篇)划分为4部分:有机质谱,化学成像,深度剖析以及TOF-SIMS在生物生命材料领域应用的展望。本篇将介绍应用有机质谱对生物医用高分子材料和生物分子的结构表征及研究相关的科学问题,包括蛋白质吸附,生物材料表面化学改性和生物降解高分子药物释放机理。
1 有机质谱:化学物质结构的鉴别
TOF-SIMS谱图和其他质谱图一样,可以提供化学结构的信息;所不同的是,SIMS的信息来源仅限于表面,质谱图中的谱峰来自表面存在的所有成分,也就是说TOF-SIMS的谱图是混合物的谱图。因此在对TOF-SIMS谱图分析时必须对样品表面的主要化学成分有一定的了解。另外,TOF-SIMS的二次离子产生机制较为复杂,涉及到一次离子束与固体表面相互作用的过程。有关分子二次离子的产生假说包括碰撞级联模型(collision cascade models),又分为经典动力学模型(classical dynamics model)、“先存离子”模型(precursor model)和热振动模型(thermal and vibrational models)[13]。一般说来SIMS谱图中的谱峰可分为几种,包括无特征性小碎片峰;有特征性的碎片峰;分子离子峰(如[M+H]+,[M-H]-),金属螯合离子峰及团簇离子峰。一般来讲在低质量数范围里,主要是无特征性及有特征性小碎片离子峰。一个有机分子化学式可以通过有特征的小碎片峰及分子特征峰来确定。而从高分子SIMS谱图中可以获得的信息包括重复单元,末端基结构化学式,分子质量及分子质量分布等[14]。
1.1 生物医用有机高分子材料
一些合成高分子材料由于具有化学惰性、生物相容性、生物降解性而被用作生物医学材料。常见的高分子材料包括聚乙烯、聚甲基丙烯酸甲酯、聚碳酸脂、聚氨酯、聚四氟乙烯和对苯二甲酸乙二醇酯等。生物相容性是这些材料作为医用材料的重要特性,而从开始设计材料表面时生物相容性就需要考虑。生物材料最表层的化学组成、结构、污染物、元素和分子的富集等因素都会影响其生物反应及长期的稳定性能[2]。因而,材料表面化学的表征对于材料设计及质量检验都是必要的。
对高分子的结构分析包括分子主链、侧链基及末端基的结构表征和分子质量、分子质量分布的确定[1,5]。图1是几种聚丙烯酸甲酯高分子的负离子SIMS谱图[1]。可以看出,4个谱图都显示了代表主链的重复结构单元的m/z 85峰(C4H5O2)。同时,在谱图上标识出4种高分子侧链碎片峰的元素组成,如C2H5O、C2H5O2、C4H9O、C6H5O。对于未知样品可以借助高分子材料的 SIMS谱图手册[14-15],参照其中标准谱图中的“指纹”部分来加以分析。另外,可以使用质谱学中常规的结构演推方法(可以参考McLafferty经典著作[16]),通过识别碎片峰和其形成途径来确定分子结构[1]。共聚高分子或共混高分子表面化学成分的富集现象也可用TOF-SIMS来研究。共聚高分子或共混高分子中的两种组分的表面能有很大差异,具有低表面能的链段或组分倾向于表面富集,即它们的成分在表面的相对含量远高于体相中的浓度,如聚二甲基硅氧烷链段(PDMS),含氟的碳氢分子链段[17-19]。是否在表面有富集现象的发生可以通过比较两种组分的SIMS峰强比值在体相和表面上是否存在差异来判断[5,19]。
1.2 氨基酸,多酞,蛋白质
电喷雾-质谱(ESI-MS)和 MALDI-MS质谱技术常用于氨基酸,多酞,蛋白质结构的表征[20]。相比于这些在生化分析中常规使用的质谱技术,TOF-SIMS具有样品制备简单、检测灵敏度高、可以表面成像等特点。早在仪器发明初期,科学家们就使用它表征放置在金属银衬底上的氨基酸和多肽化合物[21]。以后 Mantus和Ratner应用四极杆SIMS对多肽的氨基酸序列结构测定做了尝试性的研究[22]。在 Mantus的工作中,采集了16种单一组分多肽高分子SIMS谱图,从中总结出对应于每种氨基酸的特征峰,列于表1。借助这个特征峰表,Mantus使用静态SIMS对蛋白质(包括albumin,Fribrogen和insulin)在钛金属和硅衬底上的吸附现象做定性研究。Samul等[23]使用TOF-SIMS测量了15种氨基酸聚合物。与Mantus的工作相比,Samul得到的谱图具有更好的质量分辨率和更高的灵敏度。

图1 几种聚甲基丙烯酸甲酯高分子的负性离子指纹区谱图由高分子侧链基团从高分子骨架上断裂而形成的特征碎片离子峰在图中由箭头标识出来[1]Fig.1 Fingerprint region of the negative ion spectrum for several methacrylate polymers
Sole-Domenech 在 最 近 的 《Analytical Chemistry》杂志上[24],较为详尽地报道了使用Bi3和Au3为一次离子源对两种多肽分子(Opioid和Amyloid)做氨基酸序列分析。结果表明:在低质量数区域,可以检测到单个氨基酸的特征峰;在中、高质量数区域,可以检测到对应于多个氨基酸的碎片峰及分子离子峰。另外,还发现TOF-SIMS谱图的碎片峰分布轮廓与碰撞诱导解离 (collision-induced dissociation,CID)的检测结果相似。因而Sole-Domenech等认为使用Bi3和Au3团簇一次离子源,可以推进TOFSIMS在蛋白组学中的应用。在TOF-SIMS定量分析多肽的研究中,Sun等[25]应用 TOFSIMS进行了多肽药物分子在大气及臭氧环境下的固相氧化反应初始阶段的动力学研究。在这项工作中,选用负性分子离子峰做相对定量分析。通过使用氧化产物与反应物分子离子峰强度比值及标准曲线得出了表观动力学反应常数。结合X射线光电子能谱(XPS),Apte等研究了两种模型低聚多肽分子(14-merα-helix和15-merβ-strand oligopeptides)在自主膜(SAM)上的吸附。通过对比分析不同吸附情况下亮氨酸(L)和赖氨酸(K)的特征峰强比值,说明两种多肽分子在亲水性和疏水性表面所呈现的形态不同[26]。
蛋白质吸附是人工材料放置到生物环境中所发生的第一个生物反应现象。材料表面特性决定了蛋白质在表面上吸附的类型、数量、取向和形态以及空间分布[1]。因而,为了更好地了解人工生物材料的功能及如何控制生物环境与材料之间的反应,需要对蛋白质吸附过程中形成的蛋白质(膜)的表面结构及成分做微观的表征。在过去近30年,TOF-SIMS已经被较为广泛地用于这方面的研究[11]。美国华盛顿大学的Castner和Ratner在这个领域中做了大量的研究工作[11,27]。由于 TOF-SIMS的检测深度在10~20Å,而蛋白质(膜)的厚度约10μm左右。因此,TOF-SIMS不能直接检测到蛋白质分子离子峰,而是碎片离子峰[4,11],这使谱图数据分析工作复杂并且庞大。为了解决这个问题,Castner采用多变量方法(multivariate analysis,MVA)辅 助 处 理 蛋 白 质谱 图 数 据[27-28]。应 用TOF-SIMS技术并结合MVA方法进行了定量分析[29-30]、蛋白质表征及分类[31]、蛋白质膜的形态和取向[32]等方面的研究。在近一二十年里,应用TOF-SIMS做蛋白质研究较为活跃。研究的内容包括蛋白质表面取向和形态表征[32-34],蛋白质吸附的定量分析[35-36],使用主成分分析法(principal component analysis,PCA)(如图2)和人工神经网络方法区分不同蛋白质[37-38];评估蛋白质与不同种金属衬底的键合能力[39],吸附环境(衬底,温度等因素)对蛋白质吸附的影响[33,40]等。
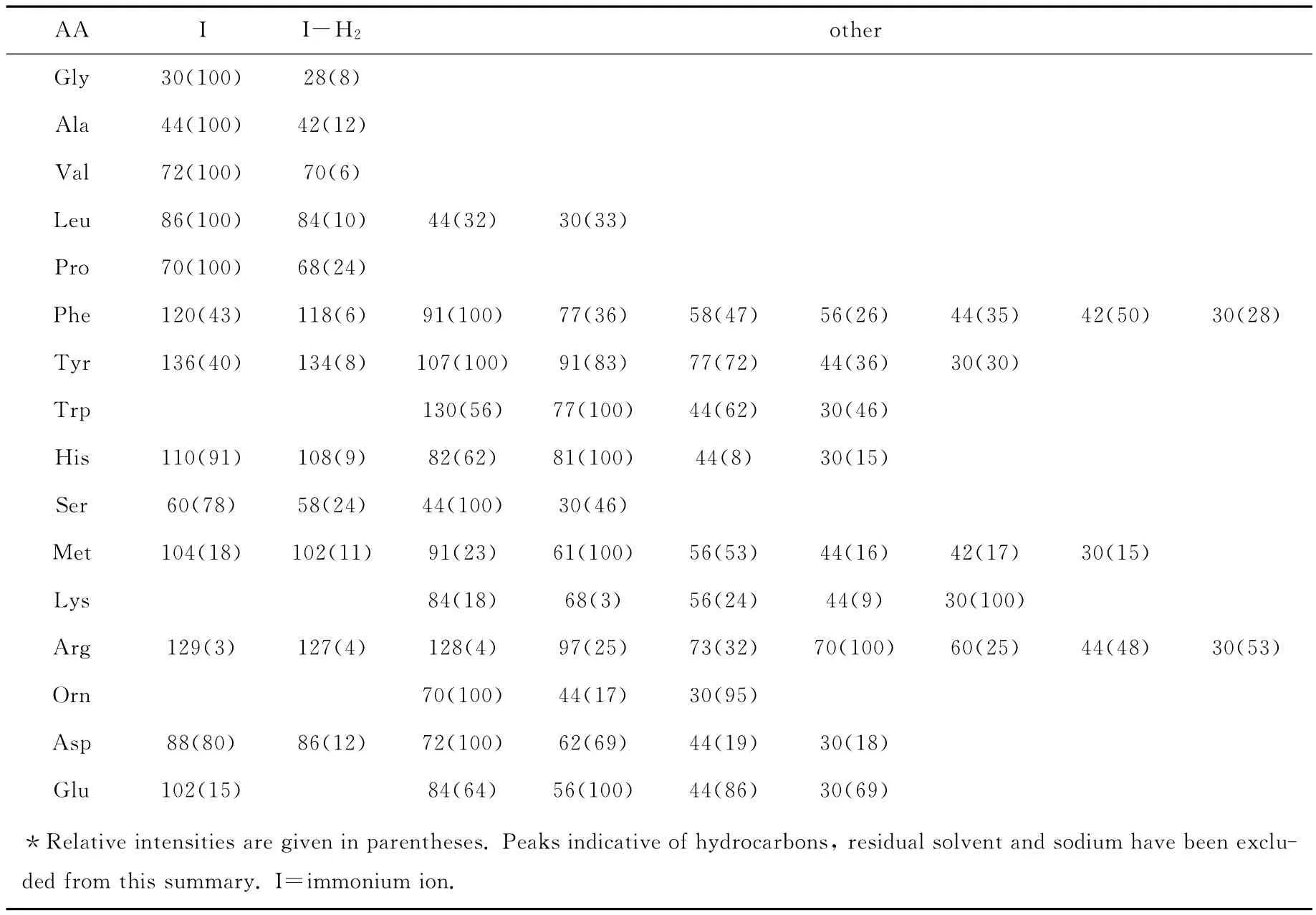
表1 16种氨基酸均聚物的正性SIMS离子特征碎片峰一览表[22]Table 1 Summary of characteristic fragment ions in the positive SIMS spectra of homopolymers of 16Amino acids[22]
1.3 核苷酸,DNA,磷脂膜及多糖[41-45]
May等[43]使用 XPS并结合 TOF-SIMS分析DNA的构成成分。在TOF-SIMS谱图中代表核酸碱基、核苷和核苷酸的特征正负离子峰可以被识别出来。通过单变量或多变量分析方法,可以区分组分非常相近的两个DNA低聚物(oligomer)。在这项工作中,作者建立特征分子离子峰的数据表,并将表中的特征分子离子峰作为标准谱峰,应用于预测较为复杂DNA分子中碱基的相对含量。Prinz等研究了3种磷脂模型结构,冷冻干燥制备的 支撑 1-oleoyl-2-palmitoylsn-glycero-3-phosphocholine (POPC)双 分 子膜、Langmuir-Blodgett POPC单分子膜以及无序的POPC厚膜[44]。通过对比双分子膜与后两种膜的谱图,发现双分子膜谱图中的POPC分子离子峰和双分子离子峰比其他两种膜高出5~10倍。由此作者提出采用此现象来作为推断在细胞或组织切片上磷脂的双分子膜是否存在的依据。糖类分子由于结构相似,特征谱峰也十分相似。因而,导致TOF-SIMS不易区分不同种类的糖分子。但是借助MVA手段辅助处理谱图数据,Berman等成功地区分几种含单一组分的糖分子同构体[45],并且识别出各种同构体的重要离子峰。这项研究成果表明,TOF-SIMS与PCA的结合可以提供对生命材料细微差别的观测,从而渴望能够被应用研究细胞过程中生物现象及作为疾病的诊断手段[45]。
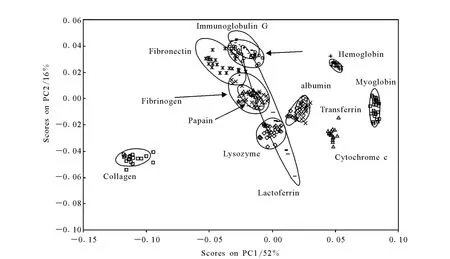
图2 蛋白质的TOF-SIMS正性离子谱图的PCA得分图(PC 1对PC 2)[38]Fig.2 PCA Score plot(PC 1 vs PC 2)of the positive ion ToF-SIMS spectra of the proteins adsorbed onto silicon wafer substrates from 100mg/L single protein solutions[38]
1.4 生物材料表面化学改性
由于TOF-SIMS兼有表面分析和质谱分析的功能,因而,对研究生物材料表面改性的应用显得最为直接和理所当然。Todd[47]设计多步法合成制备酶-响应表面或称为“聪明”的生物材料表面,将具有粘接细胞性能的多肽分子RGD与在玻璃衬底上PEG链段形成化学键合,从而使多肽分子RGD被固定在表面上。在这个研究中TOF-SIMS被用来验证每一步的化学接枝/键合反应。Ti材料作为优良的人工体内移植材料(比如骨骼)已经被广泛使用。为了增强其与骨头的键合强度,Adden在Ti表面上首先形成磷酸单分子层,进而通过与磷酸键合引进生物活性分子,比如BMP-2蛋白质到Ti材料表面。使用XPS和TOF-SIMS来表征并验证磷酸单分子膜的形成[49]。Kalaskar[50]采用化学方法将不同种类氨基酸分子接枝到纤维素表面,目的是使改性过的表面能够影响纤维原细胞(fibroblast cell)的形貌及其细胞伸展。TOFSIMS谱图技术用来检验氨基酸的接枝效率并验证末端基Fmoc的存在。
1.5 生物降解高分子药物释放机理
高分子材料的生物降解性能使得它们可以用于可控制药物释放的载体。为了设计具有可控药物释放性能的材料,需要对高分子降解及同时发生的药物释放机制有较清楚的认识[51]。Gardella课题组开展应用TOF-SIMS对聚(α-羟基酸)类型高分子表面水解动力学的系统性研究[52-54],示于图3。图3是 PGA 膜水解动力学研究的TOF-SIMS谱图,其中图3a为水解处理之前;图3b、图3c均为水解处理之后,图3b的水解时间为2h,图3c的水解时间为6h。水解条件为:缓冲溶液pH 7.4,温度37℃。使用TOF-SIMS检测不同反应时间内在表面的水解产物(低聚物)的分子离子峰分布,进而计算出低聚物的平均分子质量。水解反应速度最终从表面的水解产物(低聚物)平均分子质量与水解时间的定量关系曲线中获得。Chen和Gardella研究了聚乙醇酸(PGA)材料的水解动力学与溶液pH值大小的关系[52]。Lee和Gardella研究了PGA薄膜(约100μm)的近表面的体外水解降解动力学行为[54]。
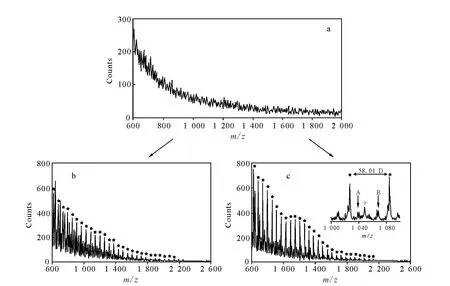
图3 PGA膜的正性TOF SIMS谱图星号标识的离子峰系列为最强的二次离子分布[54]Fig.3 Positive ToF SIMS spectra of PGA films[54]
2 小结
TOF-SIMS作为一种质谱技术具有几个优点:1)样品制备简单,无需样品提纯,样品用量少[24];2)质量准确度高,可以通过同位素分布拟合准确确定分子式;3)表面灵敏度高(10~20 Å深度内),检出限低(10-6量级)。这些优点使得TOF-SIMS对于在表面上分布的生物分子进行化学成分表征及结构鉴定方面相比与其他质谱技术如(ESI-MS和 MALDI-MS)都有很大的竞争力。另外,像任何一种分析技术一样,TOFSIMS也有其弱点:1)定量分析困难。由于存在“基质效应”,对于定量分析不能采用像响应因子的方法来实现;2)谱图数据分析较为困难。一是由于有机分子离子化及形成碎片机理依然不是十分清楚,因而对未知样品的结构分析困难;二是大多数情况下谱图中的谱峰来自混合物,因而增加了数据解析的难度;3)仪器价格相对昂贵。
为了克服这些技术弱点,增强TOF-SIMS使用性,需要扩大标准化合物的谱图数据库,降低仪器成本。另外,虽然“基质效应”决定了TOF-SIMS自身定量分析的困难性,但就某些研究体系,采用峰比值法[25,55]、内标法[56]、标准曲线法[25]、MVA 辅助法[30],借助其它分析技术(比如 XPS)的辅证法[5,29],可以实现可靠的相对定量分析。
[1]BELU A M,GRAHAM D J,CASTNER D G.Time-of-flight secondary ion mass spectrometry:techniques and applications for the characterization of biomaterial surfaces[J].Biomaterials,2003,24(21):3 635-3 653.
[2]SABBATINI L,ZAMBONIN P G.XPS and SIMS surface chemical analysis of some important classes of polymeric biomaterials[J].Journal of Electron Spectroscopy and Related Phenomena,1996,81(3):285-301.
[3]BENNINGHOVEN A.Detection,identification and structural investigation of biologically important compounds by secondary ion mass spectrometry[J].Analytical Chemistry,1978,50(8):1 180-1 184.
[4]VICKERMAN J C,BRIGGS D.TOF-SIMS:Sur-face analysis by mass spectrometry[M].Chichester:IM,2001.
[5]VAN VAECK L,ADRIAENS A,GIJBELS R.Static secondary ion mass spectrometry:(S-SIMS)Part 1.Methodology and structural interpretation[J].Mass Spectrometry Reviews,1999,18(1):1-47.
[6]BRIGGS D.聚合物表面分析 X射线光电子谱(XPS)和静态次级离子质谱(SSIMS)[M].曹立礼,邓宗武,译.北京:化学工业出版社,2001.
[7]贝宁豪文A,查良镇.飞行时间二次离子质谱——强有力的表面、界面和薄膜分析手段[J].真空,2002,(5):10-14.
[8]周 强,李金英,梁汉东,等.二次离子质谱(SIMS)分析技术及应用进展[J].质谱学报,2004,25(2):113-120.
[9]BOXER S G,KRAFT M L,WEBER P K.Advances in imaging secondary ion mass spectrometry for biological samples[J].Annual Review of Biophysics,2009,38:53-74.
[10]LEE T G,PARK J W,SHON H K,et al.Biochemical imaging of tissues by SIMS for biomedical applications[J].Applied Surface Science,2008,255(4):1 241-1 248.
[11]MICHEL R,CASTNER D G.Advances in timeof-flight secondary ion mass spectrometry analysis of protein films[J].Surface and Interface Analysis,2006,38(11):1 386-1 392.
[12]WALKER A V.Why is SIMS underused in chemical and biological analysis challenges and opportunities[J].Analytical Chemistry,2008,80(23):8 865-8 870.
[13]PACHUTA S J,COOKS R G.Mechanisms in molecular SIMS[J].Chemical Reviews,1987,87(3):647-669.
[14]NEWMAN J G,HOHLT T A.Static SIMS handbook of polymer analysis:A reference book of standard data for identification and interpretation of static SIMS data[M].Eden Prairie,Minn:Perkin-Elmer Corp,Physical Electronics Division,1991.
[15]BRIGGS D,BROWN A,VICKERMAN J C.Handbook of static secondary ion mass spectrometry:[(SIMS)][M].Chichester:Wiley,1989.
[16]MCLAFFERTY F W,TURECEK F.Interpretation of mass spectra[M].Mill Valley,Calif:University Science Books,1993.
[17]GARDELLA J A,MAHONEY C M.Determi-nation of oligomeric chain length distributions at surfaces using TOF-SIMS:Segregation effects and polymer properties[J].Applied Surface Science,2004,231-2:283-288.
[18]HOOK D J,VALINT P L,CHEN L,et al.Quantitative and high mass TOF-SIMS studies of siloxane segregation in hydrogel polymers using cryogenic sample handling techniques[J].Applied Surface Science,2006,252(19):6 679-6 682.
[19]CHEN J,GARDELLA JR J A.Solvent effects on the surface composition of poly(dimethylsiloxane)-co-polystyrene/polystyrene blends [J].Macromolecules,1998,31(26):9 328-9 336.
[20]赵玉芬.生物有机质谱[M].郑州:郑州大学出版社,2005.
[21]BENNINGHOVEN A,SICHTERMANN W K.Detection,identification,and structural investigation of biologically important compounds by secondary ion mass spectrometry[J].Analytical Chemistry,1978,50(8):1 180-1 184.
[22]MANTUS D S,RATNER B D,CARLSON B A,et al.Static secondary ion mass spectrometry of adsorbed proteins[J].Analytical Chemistry,1993,65(10):1 431-1 438.
[23]SAMUEL N T,WAGNER M S,DORNFELD K D,et al.Analysis of poly(amino acids)by static time-of-flight secondary ion mass spectrometry(TOF-SIMS)[J].Surface Science Spectra,2001,8(3):163-184.
[24]SOLE-DOMENECH S,JOHANSSON B,SCHALLING M,et al.Analysis of opioid and amyloid peptides using time-of-flight secondary ion mass spectrometry[J].Analytical Chemistry,2010,82(5):1 964-1 974.
[25]SUN L M,GARDELLA J A.The solid state oxidation of methionine containing peptide:A preliminary study using time of flight secondary ion mass spectrometry[J].Pharmaceutical Research,2000,17(7):859-862.
[26]APTE J S,COLLIER G,LATOUR R A,et al.XPS and TOF-SIMS investigation of a-helical and β-strand peptide adsorption onto SAMs[J].Langmuir,2010,26(5):3 423-3 432.
[27]LHOEST J B,WAGNER M S,TIDWELL C D,et al.Characterization of adsorbed protein films by time of flight secondary ion mass spectrometry[J].Journal of Biomedical Materials Research,2001,57(3):432-440.
[28]GRAHAM D J,WAGNER M S,CASTNER D G.Information from complexity:Challenges of TOF-SIMS data interpretation[J].Applied Surface Science,2006,252(19):6 860-6 868.
[29]WAGNER M S,SHEN M,HORBETT T A,et al.Quantitative analysis of binary adsorbed protein films by time of flight secondary ion mass spectrometry[J].Journal of Biomedical Materials Research Part A,2003,64A(1):1-11.
[30]WAGNER M S,SHEN M,HORBETT T A,et al.Quantitative time-of-flight secondary ion mass spectrometry for the characterization of multicomponent adsorbed protein films[J].Applied Surface Science,2003,203:704-709.
[31]WAGNER M S,CASTNER D G.Analysis of adsorbed proteins by static time-of-flight secondary ion mass spectrometry[J].Applied Surface Science,2004,231-232:366-376.
[32]XIA N,MAY C J,MCARTHUR S L,et al.Time-of-flight secondary ion mass spectrometry analysis of conformational changes in adsorbed protein films[J].Langmuir,2002,18(10):4 090-4 097.
[33]MICHEL R,PASCHE S,TEXTOR M,et al.Influence of PEG architecture on protein adsorption and conformation[J].Langmuir,2005,21(26):12 327-12 332.
[34]BAUGH L,WEIDNER T,BAIO J E,et al.Probing the orientation of surface-immobilized protein G B1using TOF-SIMS,sum frequency generation,and NEXAFS spectroscopy[J].Langmuir,2010,26(21):16 434-16 441.
[35]KIM Y P,HONG M Y,KIM J,et al.Quantitative analysis of surface-immobilized protein by TOF-SIMS:Effects of protein orientation and trehalose additive[J]. Analytical Chemistry,2007,79(4):1 377-1 385.
[36]HENRY M,BERTRAND P.Influence of polymer surface hydrophilicity on albumin adsorption[J].Surface and Interface Analysis,2004,36(8):729-732.
[37]CANAVAN H E,GRAHAM D J,CHENG X H,et al.Comparison of native extracellular matrix with adsorbed protein films using secondary ion mass spectrometry[J].Langmuir,2007,23(1):50-56.
[38]SANNI O D,WAGNER M S,BRIGGS D,et al.Classification of adsorbed protein static TOFSIMS spectra by principal component analysis and neural networks[J].Surface and Interface Analysis,2002,33(9):715-728.
[39]SUZUKI N,GAMBLE L,TAMERLER C,et al.Adsorption of genetically engineered proteins studied by time-of-flight secondary ion mass spectrometry(TOF-SIMS).Part A:Data acquisition and principal component analysis (PCA)[J].Surface and Interface Analysis,2007,39(5):419-426.
[40]COLE M A,JASIENIAK M,THISSEN H,et al.Time-of-flight-secondary ion mass spectrometry study of the temperature dependence of protein adsorption onto poly (N-isopropylacrylamide)graft coatings[J].Analytical Chemistry,2009,81(16):6 905-6 912.
[41]LINTON R,GUARISCO V,LEE J J,et al.Analytical surface spectroscopy of phospholipid langmuir-blodgett-films[J].Thin Solid Films,1992,210(1/2):565-570.
[42]PATRICK J S,COOKS R G,PACHUTA S J.Analysis of nucleotides and oligonucleotides immobilized as self-assembled monolayers by static secondary ion mass spectrometry[J].Biological Mass Spectrometry,1994,23(11):653-659.
[43]MAY C J,CANAVAN H E,CASTNER D G.Quantitative X-ray photoelectron spectroscopy and time-of-flight secondary ion mass spectrometry characterization of the components in DNA[J].Analytical Chemistry,2004,76(4):1 114-1 122.
[44]PRINZ C,HÖÖK F,MALM J,et al.Structural effects in the analysis of supported lipid bilayers by time-of-flight secondary ion mass spectrometry[J].Langmuir,2007,23(15):8 035-8 041.
[45]BERMAN E S F,KULP K S,KNIZE M G,et al.Distinguishing monosaccharide stereo-and structural isomers with TOF-SIMS and multivariate statistical analysis[J].Analytical Chemistry,2006,78(18):6 497-6 503.
[46]KALASKAR D M,GOUGH J E,ULIJN R V,et al.Controlling cell morphology on amino acidmodified cellulose[J].Soft Matter,2008,4(5):1 059-1 065.
[47]TODD S J,SCURR D J,GOUGH J E,et al.Enzyme-activated RGD ligands on functionalized poly(ethylene glycol)monolayers:Surface analy-sis and cellular response[J].Langmuir,2009,25(13):7 533-7 539.
[48]VIORNERY C,CHEVOLOT Y,LEONARD D,et al.Surface modification of titanium with phosphonic acid to improve bone bonding:Characterization by XPS and TOF-SIMS[J].Langmuir,2002,18(7):2 582-2 589.
[49]ADDEN N,GAMBLE L J,CASTNER D G,et al.Phosphonic acid monolayers for binding of bioactive molecules to titanium surfaces[J].Langmuir,2006,22(19):8 197-8 204.
[50]KALASKAR D M,ULIJN R V,GOUGH J E,et al.Characterisation of amino acid modified cellulose surfaces using TOF-SIMS and XPS[J].Cellulose,2010,17(4):747-756.
[51]HA C S,GARDELLA Jr J A.Surface chemistry of biodegradable polymers for drug delivery systems[J].Chemical Reviews,2005,105(11):4 205-4 232.
[52]CHEN J,LEE J W,HERNANDEZ DE GATICA N L,et al.Time-of-flight secondary ion mass spectrometry studies of hydrolytic degradation kinetics at the surface of poly(glycolic acid)[J].Macromolecules,2000,33(13):4 726-4 732.
[53]LEE J W,GARDELLA JR J A.Quantitative TOF-SIMS analysis of oligomeric degradation products at the surface of biodegradable poly(αhydroxy acid)s[J].Journal of the American Society for Mass Spectrometry,2002,13(9):1 108-1 119.
[54]LEE J W,GARDELLA J A.In vitro hydrolytic surface degradation of poly(glycolic acid):Role of the surface segregated amorphous region in the induction period of bulk erosion[J].Macromolecules,2001,34(12):3 928-3 937.
[55]SUN L,GARDELLA JR J A.Oxidation-assisted secondary ion mass spectrometry methodology to quantify mixed alkylthiol self-assembled monolayers on gold:Applications to competitive chemical adsorption[J].Langmuir,2002,18 (24):9 289-9 295.
[56]MUDDIMAN D C,GUSEV A I,PROCTOR A,et al.Quantitative measurement of cyclosporin A in blood by time-of-flight mass spectrometry[J].Analytical Chemistry,1994,66(14):2 362-2368.
