一种斑马鱼肝脏特异表达转基因载体的制备方法
2012-01-13陈将飞陈元红靳大庆
陈将飞,陈元红,靳大庆
(1.浙江省模式生物技术与应用重点实验室,温州医学院水域科学与环境生态研究所,浙江 温州325035;2.国家遗传工程实验室,复旦大学生命科学院 上海 200433)
一种斑马鱼肝脏特异表达转基因载体的制备方法
陈将飞1,陈元红1,靳大庆2
(1.浙江省模式生物技术与应用重点实验室,温州医学院水域科学与环境生态研究所,浙江 温州325035;2.国家遗传工程实验室,复旦大学生命科学院 上海 200433)
目的:建立一套快速制备斑马鱼肝脏特异表达转基因载体的新方法。方法:首先利用multi-site gateway技术将斑马鱼肝脏脂肪酸结合蛋白(fabp10a)启动子片段与入门载体进行BP重组获得启动子的入门克隆pENTR-fabp10a,然后将目的基因克隆到载体pME-MCS中形成入门克隆pENTR-interest,最后通过multi-site gateway技术将pENTR-fabp10a、pENTR-interest和含有EGFP标记基因的p3E-IRES-EGFPpA质粒在Tol2转座载体pDestTol2pA2上进行定向重组即可获得斑马鱼肝脏特异性表达转基因载体pTol2-fabp10a-interest-IRES-EGFP。本研究采用红色荧光蛋白基因DsRed2作为目的基因,用上述方法构建了转基因载体pTol2-fabp10a-DsRed2-IRES-EGFP,并将其注射至单细胞期斑马鱼胚胎中进行表达分析。结果:转基因载体pTol2-fabp10a-DsRed2-IRES-EGFP在斑马鱼肝脏组织中能实现红色和绿色荧光蛋白同步特异表达。结论:利用Tol2转座系统以及multi-site gateway技术构建斑马鱼肝脏特异性表达转基因载体是一套行之有效的方法。
Tol2转座子;斑马鱼;multi-site gateway技术;肝脏特异性表达
转基因载体的构建是开展基因功能和转基因动物模型构建研究的基础。传统转基因载体的构建方法主要是通过分子克隆手段将组织特异性启动子、目的基因连入到真核表达载体中来实现的,为了便于观察目的基因的表达,往往还会在目的基因的末端融合表达报告基因。该方法尽管能实现目的基因在动物组织中的特异表达,但存在以下几个缺点:首先,转基因效率较低,不利于得到稳定的转基因品系;其次,在特异启动子下表达的两个融合蛋白,目的蛋白的生物活性可能受到影响;最后,还常需考虑融合蛋白中后一种蛋白的移码突变。为了克服传统方法中的不足,本研究拟以斑马鱼肝脏作为靶器官,根据脂肪酸结合蛋白只在斑马鱼肝脏组织中表达的特性,并结合Tol2转座子能够实现目的基因在基因组中高效整合的特点,通过multi-site gateway技术建立一套快速制备斑马鱼肝脏特异性表达转基因载体的方法并在斑马鱼中验证其表达。
1 材料和方法
1.1 斑马鱼的养殖 斑马鱼(Danio rerio)为野生型AB品系,引自美国Oregon州立大学,喂养方案按照Zebrafish Book描述进行[1]。按照Kimmel等[2]描述对斑马鱼胚胎发育阶段进行分期。受精卵由清晨雌雄鱼交配获得,然后将受精卵放于孵化液(60 mg/mL海盐)中,28.5 ℃孵化。每天更换孵化液。96 h后开始投放人工饲料(Argent Laboratories)。超过24 h的胚胎经0.003%苯硫脲(PTU)处理以防止黑色素的形成。
1.2 multi-site gateway技术工作原理 利用Invitrogen公司的multi-site gateway技术构建表达载体,其原理是首先通过PCR从基因组中获得目的基因,目的基因两侧含有PCR反应引入的attB序列,该序列可以在BP克隆酶的作用下与入门载体上的attP序列进行BP重组反应获得入门克隆(见图1),入门克隆除了原有载体上的CCDB 基因被目的基因置换以外,其attP序列也由于部分置换而形成了新的attL序列。入门克隆可以在LR克隆酶的作用下与目的载体上的attR序列进行LR重组反应进而获得所需的表达克隆(见图1)。
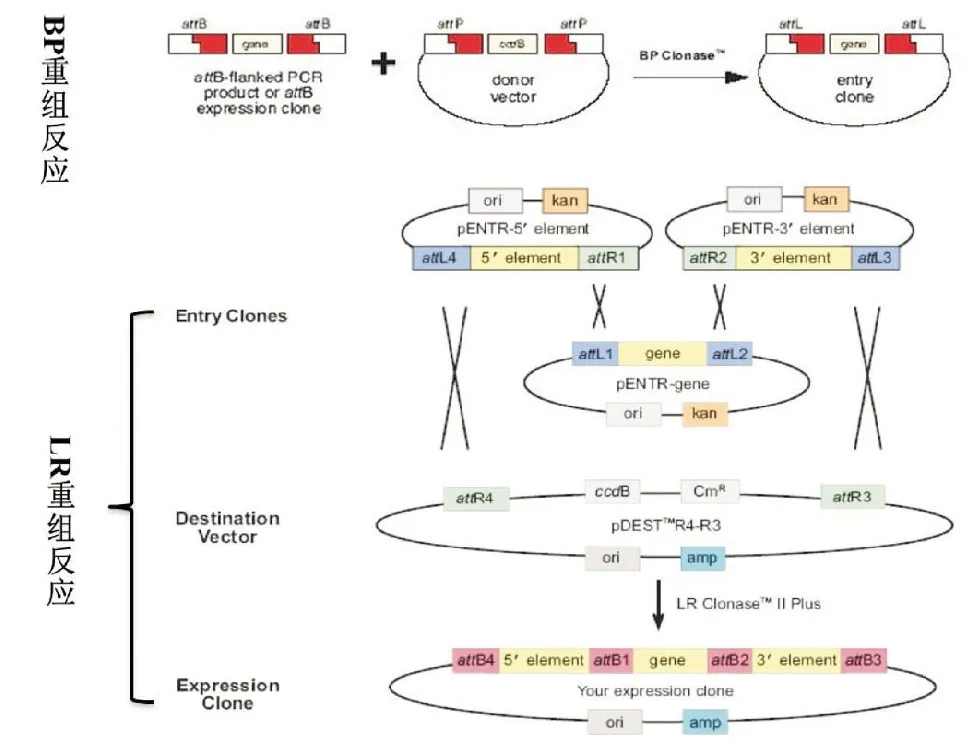
图1 multi-site gateway技术构建转基因表达载体流程图
1.3 Tol2转座子系统工作原理 将载体pCS2FA-transposase进行体外转录产生transposase mRNA,然后将transposase mRNA与转基因载体共注射至单细胞期的斑马鱼胚胎中。Transposase mRNA进入到细胞后,利用细胞内的翻译组件合成进行转座反应的转座酶。转座酶会识别转基因载体上的Tol2序列,然后将其携带的作用元件整合到斑马鱼基因组中(见图2),从而实现外源基因在种系之间的稳定遗传,具体原理可参考文献[3]。
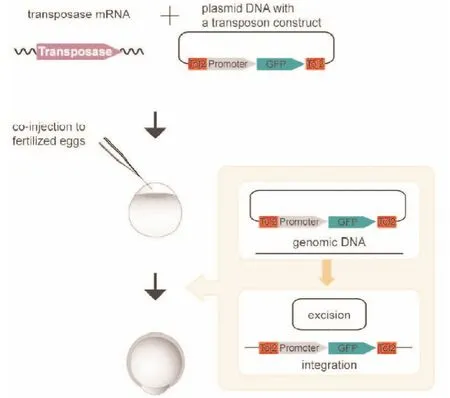
图2 Tol2转座子系统斑马鱼胚胎工作原理
1.4 pENTR-fabp10a载体的构建 根据Gene-Bank上已报道的斑马鱼fabp10a基因上游调控序列(GenBank GI:ID 23308626)设计引物,F:5’-ctgga caatatattattagcccc-3’;R:5’-ttcagatctgcagcttt tatatcg-3’。其中上游引物引入multi-site gateway技术所需要的序列ggggacaactttgtatagaaaagt tg(attB4),下游引物引入ggggactgcttttttgtaca aacttg(attB1)。引物由上海桑尼生物科技有限公司合成。PCR反应以斑马鱼基因组DNA为模板,使用宝生物公司生产的TaKaRa LA Taq聚合酶扩增长度为2885 bp的fabp10a启动子序列,PCR条件如下:94 ℃预变性5 min,每循环包括94 ℃变性1 min,62 ℃复性1 min,72 ℃延伸3 min,共30个循环,最后1个循环结束后再72 ℃延伸7 min。扩增产物在1%的琼脂糖凝胶进行电泳,并进行测序核实。扩增产物与入门载体pDONR-P4-P1R(Invetrogen公司)进行BP重组反应,生成入门克隆pENTR-fabp10a。
1.5 pENTR-DsRed2载体的构建 利用BamHI和NotI限制性内切酶双酶切pDsRed2(Clontech公司)质粒,胶回收DsRed2基因片段,然后将DsRed2基因片段亚克隆到经相同限制性内切酶消化的载体pME-MCS(美国Utah大学医学中心Chien教授惠赠)上,表达载体的多克隆位点(MCS)上含有KpnI、XhoI、SalI、Bsp106、HindIII、EcoRI、PstI、SmaI、BamHI、SpeI、XbaI、NotI、XmaIII、SacII、BstXI和SacI等16个酶切位点,因此能够被限制性内切酶BamHI和NotI切开,酶切产物经T4连接酶连接后转化感受态细胞DH5α,所获重组克隆经酶切、测序鉴定获得pENTR-DsRed2质粒。
1.6 pTol2-fabp10a-DsRed2-IRES-EGFP表达载体的构建 将构建好的 pENTR-fabp10a、pENTR-DsRed2和含有EGFP标记基因的p3E-IRES-EGFPpA质粒(美国Utah大学医学中心Chien教授惠赠)在Tol2转座载体pDestTol2pA2上(美国Utah大学医学中心Chien教授惠赠)进行LR重组(见图3),获得重组质粒pTol2-fabp10a-DsRed2-IRES-EGFP。重组质粒经测序和转基因表达鉴定获得阳性克隆pTol2-fabp10a-DsRed2-IRES-EGFP。
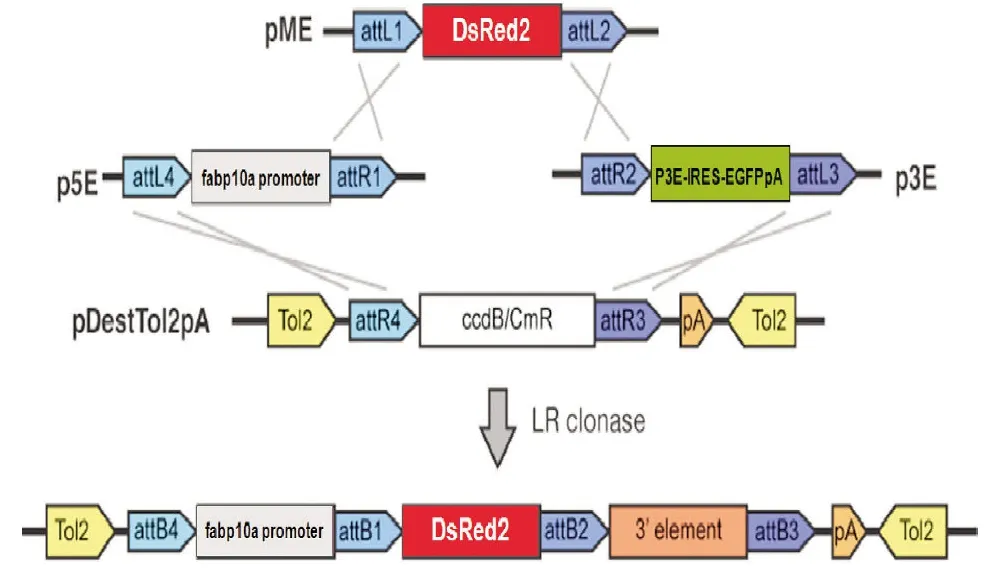
图3 multi-site gateway技术构建重组质粒pTol2-fabp10a-DsRed2-IRESEGFP流程图
1.7 斑马鱼肝脏特异表达转基因表达载体的表达分析 ① 转座酶基因的体外转录:用体外转录试剂盒Message Machine TM SP6 Kit(Ambion,TX,USA)将含有转座酶基因的pCS-TP质粒(Kawakami实验室惠赠)进行转录。转录产生的RNA用酚氯仿抽提,无水乙醇沉淀后溶于DEPC水中,并稀释成200 μg/mL的终浓度保存在-80 ℃。② 斑马鱼胚胎收集:显微注射前一天下午在投喂丰年虫完30 min后,从孵化箱内捞取雌、雄各四条斑马鱼分别放入tank(交配缸)的隔板两侧,隔离过夜。注射当天开灯后,实验准备就绪后将交配缸中的隔板拉开。10 min后开始收集胚胎,分选和清洗胚胎到有琼脂糖的表面皿中。注射外源DNA的浓度为30 ng/μL,DNA体积约2 nL。受精卵的动物极注射完毕后,慢慢抽出注射针,将受精卵放入加有抗生素的干净胚胎培养液中,使其恢复发育,光照培养箱28 ℃培养,分别在24、48和72 h后荧光显微镜下观察筛选肝脏组织具有荧光蛋白的个体,有绿色荧光蛋白的个体表示成功载入目的基因的嵌合个体。
2 结果
2.1 fabp10a启动子的PCR扩增以及pENTR-fabp10a克隆的构建 以斑马鱼基因组DNA为模板进行PCR扩增,其产物以1%的琼脂糖进行凝胶电泳分析,可见约2.8 kb的特异条带(见图4)。将扩增产物与pDONR P4-P1R 进行BP重组,由于pDONR P4-P1R上含有CCDB基因,CCDB基因能表达相应蛋白,该蛋白会破坏细菌的DNA gyrase,造成细菌染色体的降解从而导致细菌死亡,因此,重组后阳性克隆中的fabp10a启动子能够替换pDONR P4-P1R中的CCDB基因而在培养基上长出菌落,没有重组的阴性产物由于含有CCDB基因而不能长出菌落。由于利用重组技术制备的DNA没有限制性内切酶位点,重组DNA经测序证实pENTR-fabp10a克隆构建成功。
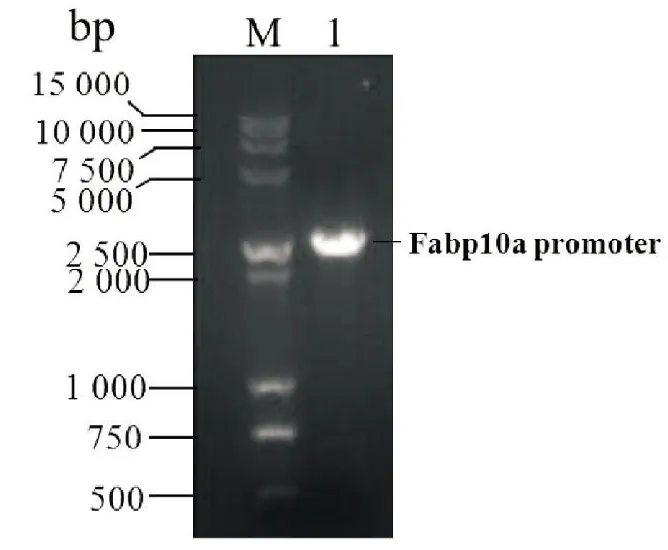
图4 PCR扩增Fabp10a 启动子片段
2.2 pENTR-DsRed2载体的构建 pDsRed2载体经限制性内切酶BamHI和NotI双酶切,酶切产物纯化后与经相同限制性内切酶消化后的载体pME-MCS进行连接,连接产物转化感受态细胞DH5α,挑选含有pENTR-DsRed2重组质粒的阳性克隆,提取质粒后,利用限制性内切酶BamHI和NotI进行双酶切,酶切产物用1%的琼脂糖凝胶进行电泳,电泳产生两条带,大小分别为2765和708 bp(见图5),这与预期结果相符,说明pENTR-DsRed2重组质粒克隆成功,该结果得到了进一步的测序证实。
2.3 pTol2-fabp10a-DsRed2-IRES-EGFP表达载体的构建 将构建好的pENTR-fabp10a入门克隆与已构建的pENTR-DsRed2以及p3E-IRES-EGFP pA和pDestTol2pA2质粒按照Invitrogen公司的multi-site gateway技术说明书进行LR重组反应,重组产物转化DH5α感受态细菌,挑选含有pTol2-fabp10a-DsRed2-IRESEGFP表达载体的克隆。由于利用重组技术制备的DNA没有限制性内切酶位点,所以提取质粒后直接测序确定,并在下一步通过斑马鱼单细胞胚胎显微注射表达载体的方法进一步证实pTol2-fabp10a-DsR ed2-IRES-EGFP构建成功。

图5 pENTR-DsRed2酶切鉴定图
2.4 斑马鱼肝脏特异表达转基因载体的表达分析
将纯化好的表达载体pTol2-fabp10a-DsRed2-IRES-EGFP和体外转录得到的转座酶mRNA以等比例(浓度分别为25 ng/μL)注射到单细胞期的斑马鱼胚胎中,在转座酶的作用下,pTol2-fabp10a-DsRed2-IRES-EGFP会整合到斑马鱼基因组中。在胚胎发育至72 h后,荧光显微镜观察发现显微注射了pTol2-fabp10a-DsRed2-IRES-EGFP表达质粒的斑马鱼胚胎肝脏组织既有红色荧光蛋白也有绿色荧光蛋白的特异表达,且绿色荧光蛋白表达的时空模式与红色荧光蛋白相同(见图6)。这说明我们用于构建斑马鱼肝脏特异性表达转基因载体的方法是可行的。
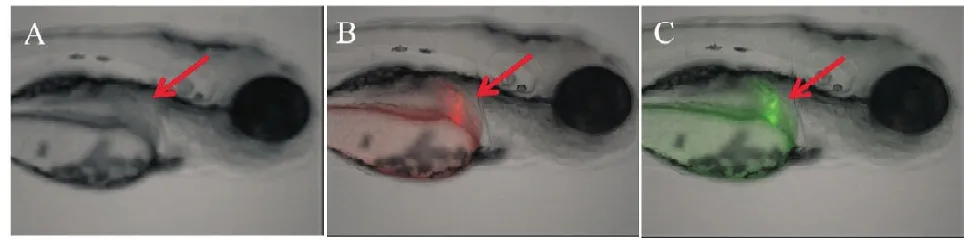
图6 红色荧光蛋白和绿色荧光蛋白在斑马鱼肝脏组织中的特异表达
3 讨论
长期以来,在脊椎动物的转基因模型构建过程中无可避免的会碰到三大技术难题[4],首先传统的分子克隆构建过程费时、费力;其次,转基因载体上缺乏标记基因,给多世代的筛选带来了不便;第三,转基因载体无法实现在基因组上的高效整合和子代个体中的高频表达。以往采用传统方法构建斑马鱼肝脏特异表达目的基因的转基因表达载体,首先需要在待表达目的基因上游引入肝脏特异性启动子来驱动目的基因的表达;其次,为了实现可视化检测目的基因表达与否,还需在目的基因下游引入报告基因(如GFP或RFP);最后,为了克服目的基因和报告基因形成的融合蛋白可能对目的基因功能的影响,还需要引入内部核糖体进入位点(IRES),以保证其能够翻译一条mRNA上的两个开放性阅读框,实现目的基因和报告基因的同步表达[5-7]。上述表达载体的构建需要把多个元件通过限制性内切酶和连接酶整合到一起,工作不仅费时费力,还可能因为限制性内切酶位点受限而不能实现。此外,以传统方法构建的表达载体由于片段太大,很难采用胚胎显微注射线性化表达载体的方法使目的基因高效地整合到斑马鱼基因组中。本实验针对传统方法可能遇到的上述难题,把multi-site gateway技术和Tol2转基因技术结合起来,建立了快速、方便、基因组整合效率高的转基因表达载体构建方法。
本实验所采用的gateway技术是把肝脏特异性基因Fabp10a启动子序列、待表达的目的基因(本实验为红色荧光蛋白)及报告基因(绿色荧光蛋白)按照一定的顺序整合到Tol2转座系统,这大大简化了基因克隆和亚克隆的步骤,同时具有较高的克隆效率,并可以保证正确的方向和阅读框。重要的是gateway技术利用了位点特异重组,所以在构建入门载体后,不再需要使用限制性内切酶和连接酶,就能把不同的入门载体整合到经gateway技术改造过的表达载体pDestTol2pA2中。pDestTol2pA2是以Tol2转座子系统为基础,因为Tol2转基因技术具有可携带大片段外源DNA、单拷贝整合效率高、转座子活性强等优点,使得以Tol2转座子系统为载体的转基因技术在多种生物中得到应用。斑马鱼中利用传统的显微注射超螺旋或线性化质粒到单细胞胚胎中的转基因技术效率低,仅能获得1%~10%的种系传代亲本[8-9]。而利用Tol2转座载体,可将这一效率提升至50%,同时可携带长达11 kb的外源性标记基因整合到受体基因组的染色体上[10]。
本实验以红色荧光蛋白基因DsRed2作为目的基因,构建了转基因表达质粒pTol2-fabp10a-DsRed2-IRES-EGFP,同时将pME-MCS与其他质粒进行定向重组,构建了pTol2-fabp10a-MCS-IRES-EGFP表达质粒,将这两组质粒分别显微注射到单细胞期的斑马鱼胚胎中,72 h后荧光显微镜下观察发现表达质粒pTol2-fabp10a-MCS-IRES-EGFP在斑马鱼肝脏组织中有绿色荧光蛋白特异表达(数据未显示),pTol2-fabp10a-DsRed2-IRES-EGFP则在斑马鱼肝脏中既有红色荧光蛋白的表达也有绿色荧光蛋白表达(见图6),这说明我们用于构建斑马鱼肝脏特异表达转基因载体的方法是可行的。
本研究通过multi-site gateway技术和Tol2转基因技术建立的制备斑马鱼肝脏特异性表达的转基因载体的方法可以实现肝脏发育候选基因在基因组上的高效整合,另外通过荧光显微镜观察绿色荧光蛋白的表达情况,就可以准确判定目的基因的时空表达。因此,利用该方法构建的转基因载体对于肝脏发育候选基因的转基因模型构建以及相关基因功能方面的研究具有重大的意义。另外,此构建思路对于其他脏器的转基因表达载体的构建也具有一定的参考价值。
[1] Westerfield M. The Zebrafish Book. A guide for the laboratory use of zebrafish (Danio rerio)[M].3rd Edition. Eugene,OR,USA:University of Oregon Press, 1995.
[2] Kimmel CB, Ballard WW, Kimmel SR, et al. Stages of embryonic development of the zebrafish[J]. Dev Dyn, 1995,203(3):253-310.
[3] Kawakami K.Tol2:a versatile gene transfer vector in vertebrates[J]. Genome Biol, 2007, 8 (Suppl 1):S7.
[4] Kwan KM, Fujimoto E, Grabher C, et al. The Tol2 kit:A multisite gateway-based construction kit for Tol2 transposon transgenesis constructs[J]. Dev Dyn, 2007, 236(11):3088-3099.
[5] Sasaki Y, Sone T, Yahata K, et al. Multi-gene gateway clone design for expression of multiple heterologous genes in living cells: Eukaryotic clones containing two and three ORF multi-gene cassettes expressed from a single promoter[J]. J Biotechnol,2008,136(3-4):103-112.
[6] Ito T, Tahara SM, Lai MM. The 3’-untranslated region of hepatitis C virus RNA enhances translation from an internal ribosomal entry site[J]. J Virology,1998,72(11):8789-8796.
[7] 陈婷芳, 罗娜, 谢华平, 等. 利用Tol2转座子构建斑马鱼心脏组织特异表达转基因载体及其表达分析[J]. 生物工程学报,2010,26(2):230-236.
[8] Stuart GW, McMurray JV, Westerfield M. Replication, integration and stable germ-line transmission of foreign sequences injected into early zebrafish embryos [J]. Development,1988,103(2):403-412.
[9] Stuart GW, Vielkind JR, McMurray JV, et al. Stable lines of transgenic zebrafish exhibit reproducible patterns of transgene expression[J].Development,1990,109(3):577-584.
[10]Urasaki A, Morvan G, Kawakami K. Functional dissection of the Tol2 transposable element identified the minimal cissequence and a highly repetitive sequence in the subterminal region essential for transposition[J]. Genetics,2006,174(2):639-649.
One method for preparing zebrafish liver-specific expression transgenic vectors
CHEN Jiangfei*,CHEN Yuanhong,JIN Daqing.
*Zhejiang Provincial Key Laboratory for Technology and Application of Model Organisms,Institute of Watershed Science and Environmental Ecology,Wenzhou Medical College,Wenzhou,325035
Objective:To establish a simple and efficient method for preparing zebrafish liver specific expression vector.Methods:The promoter of fatty acid-binding protein(FABP10a), specifically expressed in liver of zebrafish, was firstly cloned into the vector by multi-site gateway BP recombination reaction to generate a entry clone pEnter-fabp10a. Then the interest gene was inserted into pME-MCS to generate another entry clone pENTR-interest.Finally, the transgenic vector pTol2-fabp10a-interest-IRES-EGFP were prepared through LR recombination reaction between pENTR-fabp10a Entry and plasmids(pENTR-interest、p3E-IRESEGFPpA and pDestTol2pA2)using the multi-site gateway technique. To test the effectiveness of this method,repoter gene dsRed2 was used as a target gene. The constructed gene vector pTol2-fabp10a-DsRed2-IRES-EGFP was microinjected to single cell stage zebrafish embryos for expression analysis.Results:The transgenic vector pTol2-fabp10a-DsRed2-IRES-EGFP achieved the red and green fluorescent protein specific expression in zebrafish liver tissue.Conclusion:It is an effective method using Tol2 transposable element and multi-site gateway technology to construct the zebrafish liver specific expression vectors.
Tol2 transposon;zebrafish;multi-site gateway technology;liver-specific expression
Q812
A
1000-2138(2012)05-0453-05
2012-05-04
浙江省大学生科技创新项目(2010R413049)。
陈将飞(1984-),女,河南洛阳人,助理实验师,理学硕士。
吴健敏)
·护理研究·
