人参锈腐病菌双胞柱孢的鉴定及其生物转化功能研究
2012-01-12吕国忠张薇孙晓东
吕国忠,张薇,2,孙晓东
(1.大连民族学院环境与资源学院,辽宁大连 116605;2.辽宁师范大学生命科学学院,辽宁大连 116029)
人参锈腐病菌双胞柱孢的鉴定及其生物转化功能研究
吕国忠1,张薇1,2,孙晓东1
(1.大连民族学院环境与资源学院,辽宁大连 116605;2.辽宁师范大学生命科学学院,辽宁大连 116029)
从采自辽宁省桓仁县患有锈腐病的人参组织中分离得到多株柱孢属真菌。通过柯赫氏法则证明柱孢属真菌对人参具有致病性,可引起典型人参锈腐病。经形态学鉴定,确定致病真菌SR79、SR86、SR88、SR90、SR91、SR94、SR95、SR96为双胞柱孢Cylindrocarpon didymium。进一步研究这些菌株对人参皂苷的生物转化作用,通过TLC和HPLC检测,证明菌株SR79具有较强的转化活性,能够将人参皂苷Rb1和人参皂苷Rd转化成稀有人参皂苷Rh2。结果表明,人参锈腐病菌SR79菌株具有人参皂苷生物转化开发潜力。
锈腐病;致病真菌;双胞柱孢;生物转化
人参Panax ginseng C.A.Meyer是名贵药用植物,因其具有悠久的药用历史和特殊功效,自古以来就受到东、西方人的普遍青睐,在中国、朝鲜、日本等国家被广泛用于滋补保健和医疗[1]。在人工栽培条件下,人参常发生多种病害,其中最为普遍、严重的病害是人参锈腐病[2]。人参锈腐病(Cylindrocarpon destructans)是人参根部最严重的一种真菌病害,也是一种常见土传病害,直接影响人参的产量和商品价值[3]。另外,人参是多年生宿根植物,连作障碍十分严重[4],常导致栽种过患病人参的土壤几十年内不能再种植人参。中国东北地区是人参主要产区之一,人参锈腐病发病率在90%以上,造成人参减产30%左右,其危害以吉林和黑龙江省最为严重[5]。
目前,国内外报道的人参锈腐病菌有4种真菌,尤其是C.destructans(Zinss)Scholten最为普遍,危害严重[6]。本研究中分离得到一株致病真菌C.didymium Harting,该致病菌与其他4种致病菌在大孢子形态和产孢结构上存在差异。人参根感染锈腐病菌后,多种有机物含量发生变化,其中人参皂苷最为显著[7]。皂苷是人参药物活性的主要成分[8],因此,人参皂苷含量多少和人参皂苷类型是评价人参内在质量的关键。人参感染锈腐病菌后,其人参皂苷含量较健康人参含量减少18.4%,并且随着病级的升高而继续下降[7]。作者认为,人参感染锈腐病菌后人参皂苷含量下降,说明锈腐病菌具有皂苷降解或生物转化功能。为了明确人参锈腐病菌SR79菌株是否存在对人参皂苷的生物转化功能,本文对此展开了深入研究。
1 材料与方法
1.1 材料
由辽宁省桓仁县参茸场提供新鲜人参样品。人参单体皂苷Rb1、Rb2、Rc、Rd、Rg1、Rg3、Rh1、Rh2及对照品均购自吉林大学基础医学院。
1.2 仪器及试剂
薄层层析板Silica Gel-60F254(德国MERCK);高效液相色谱分析仪(岛津LC-20AD),色谱柱为C18 kromasil ODS2(250 mm×4.6 mm,5μm),由大连化物所提供。乙腈、甲醇为色谱纯,其他试剂均为分析纯。
1.3 培养基
PDA培养基(马铃薯200 g,葡萄糖20 g,琼脂20 g,去离子水1 000 mL);液体发酵培养基(麦麸20 g,5°麦芽汁80 mL,混匀,121℃灭菌30 min)。
1.4 人参锈腐病菌的分离和鉴定
1.4.1 人参锈腐病菌的分离
参考张天宇方法[9],用自来水将罹病的新鲜人参冲洗干净,用滤纸吸干水分,然后,先用0.1%升汞浸泡1~1.5 min,经无菌水冲洗4~5次,用75%酒精浸泡1~1.5 min,再经无菌水冲洗3~4次。处理后在无菌条件下,用经灭菌的手术剪将人参根系组织剪成小块(4 mm×4 mm),分别置于直径9 cm的PDA平板上。在25℃恒温箱中培养5~7 d后观察组织块周围有无菌落形成。待产生菌落后,挑取菌丝接种到PDA斜面培养基上进行纯化和保藏备用。
1.4.2 滤纸培养法
参考张天宇方法[9]将待分离的病组织冲洗干净后,选择典型罹病部位,切取组织块(4 mm×4 mm)若干,经升汞表面灭菌2~3 min,无菌水反复冲洗3次,置于铺有无菌滤纸的培养皿中,向皿中加人适量无菌水,于28℃下培养,待组织块上长出菌丝时,将外观不同的菌落进行转接纯化,于25℃培养7~10 d,然后进行菌落及形态的观察。
1.5 致病性测定
试验采用3年生健康人参根,用自来水冲洗干净后于1%过氯酸钠中消毒5 min,再用无菌水反复冲洗4次。采用针刺法接种菌株孢子悬液。在预定的接种点上接种,每根选取10个点,共接3根。接种后置于直径20 cm的培养皿中,于28℃保湿培养,分别在8,15 d观察接种点发病情况。以接种无菌水为空白对照。
1.6 菌种鉴定
对分离纯化的菌株在培养6~12 d后进行菌落特征和显微形态观察,参照相关真菌分类资料[10-11],对菌株进行形态鉴定。
1.7 微生物转化培养
参考李梁等方法[12],将已鉴定的柱孢属真菌菌株接种于液体发酵培养基中,于28℃摇床振荡培养3~5 d。将发酵液搅拌1~2 h,用双层纱布过滤,滤液经10 000 r·min-1离心10 min,取上清液加入300 mL 95%冰乙醇,4℃沉淀4 h。经10 000 r·min-1离心10 min,倒掉上清,沉淀溶于10 mL0.02 mmol·L-1、pH5.0的醋酸-醋酸钠缓冲液中,经13 000 r·min-1离心10 min,最后得到上清酶液。取0.1 mL酶液与等体积单体人参皂苷混合,40℃下反应24 h,加入0.2 mL正丁醇萃取1 h,取上清进行TLC检测,同样取0.1 mL失活的酶液加入对应单体皂苷作为空白对照。
1.8 转化产物的检测
用移液枪吸取正丁醇层进行TLC检测,在V (氯仿)∶V(甲醇)∶V(水)=7∶3∶0.5的系统中展开,喷10%H2SO4水溶液,110℃下烘干显色,与空白对照的标准品单体人参皂苷比对。萃取液减压回收正丁醇,蒸干后用0.1 mL甲醇充分溶解,取5 μL进行HPLC检测。色谱条件:色谱柱C18 kromasil ODS2(250 mm×4.6 mm,5 μm);检测波长203 nm;柱温35℃;流动相A为乙腈,流动相B为高纯水。梯度洗脱:流速0.6 mL· min-1,进样量5 μL。梯度洗脱时间见表1。

表1 高效液相梯度洗脱时间表
2 结果与讨论
2.1 病原菌分离结果
从罹锈腐病的人参病根中经多次分离得到多株柱孢属真菌,经对各菌株进行针刺接种试验,结果表明,在30个接种点中有18个接种点出现褐色病斑。8 d后,针刺接菌处出现典型锈腐病黑褐色病斑。15 d后,病斑扩散,表皮呈黑褐色,组织破坏,皮内深处腐烂、凹陷。上述经接种发病的人参根按柯赫氏法则进行病菌再分离,均获得与接种时相同的病菌。
2.2 菌株鉴定
PDA上25℃培养7 d,菌落直径达到25~30 mm,伴随有白色菌丝生成。菌落初为米黄色,随培养时间增加,菌落颜色逐渐加深,最后为褐色,培养基背面呈深褐色。在菌落初期大量产生单胞小型分生孢子(5~9 μm×3~4.5 μm),无色,椭圆形;分生孢子梗(16~25 μm×2.5~4 μm)细长,瓶梗形。不久产生大型分生孢子,1~2个隔膜,少数3个隔膜,多呈圆柱形,直或略弯曲;无隔大型分生孢子为8~20 μm×2.5~5 μm;单隔大型分生孢子为15~25 μm×3~7 μm;双隔大型分生孢子为24~36 μm×5~8 μm。在菌落生长后期形成厚垣孢子,链生,球状,壁光滑,直径为8.5~12.5 μm,初无色,后呈深褐色(如图1)。经形态学鉴定,该致病菌为双胞柱孢C.didymium Harting。
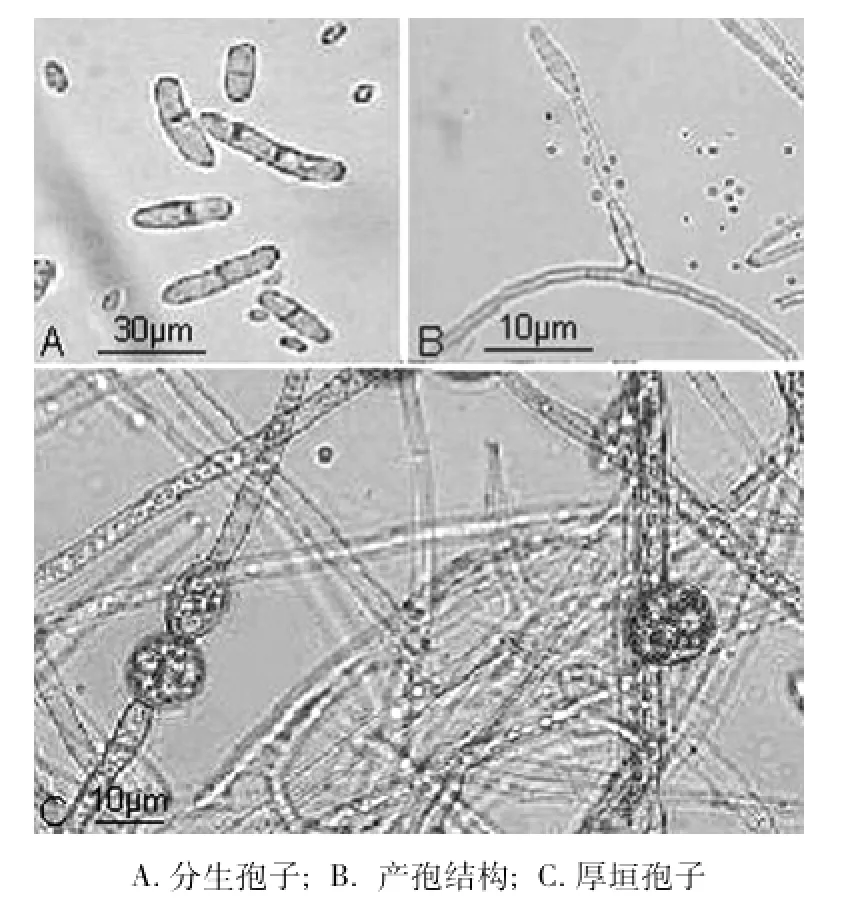
图1 双胞柱孢Cylindrocarpon didymum
人参锈腐病菌SR79菌株与文献中描述的典型柱孢属致病菌毁灭柱孢C.destructans的显微形态比较见表2。

表2 菌株SR79与毁灭柱孢的形态特征比较
2.3 转化产物的检测
2.3.1 TLC分析
将Rb1、Rb2、Rc、Rd、Rg1作为底物与真菌菌株SR79、SR86、SR88、SR90、SR91、SR94、SR95、SR96进行反应,用移液枪吸取人参皂苷标准品及样品各5~10 μL,分别点样于薄层层析板上,层析结果显示,菌株SR79的转化作用最强。菌株SR79的层析图如图2,从中可以看出,该株真菌对各种人参皂苷均有转化作用,其Rf值与标准品对应的转化效果见表3。从表3中可以明确看出,该菌株对人参皂苷Rb1、Rd转化效果强,均能产生稀有人参皂苷20(s)-Rg3和Rh2。

图2 人参皂苷Rb1、Rb2、Rc、Rd、Rg1转化产物的TLC分析

表3 SR79菌株转化不同型人参皂苷的产物
2.3.2 HPLC检测
在TLC分析基础上,对菌株SR79底物Rb1和Rd的转化产物进行了HPLC检测,结果如图3 (截取0~50 min色谱图)。经HPLC检测,在特定时间下,Rb1和Rd的主要代谢物分别与标准品Rd、20(s)-Rg3和Rh2有相同保留时间峰。因此,可以进一步确定其转化产物。
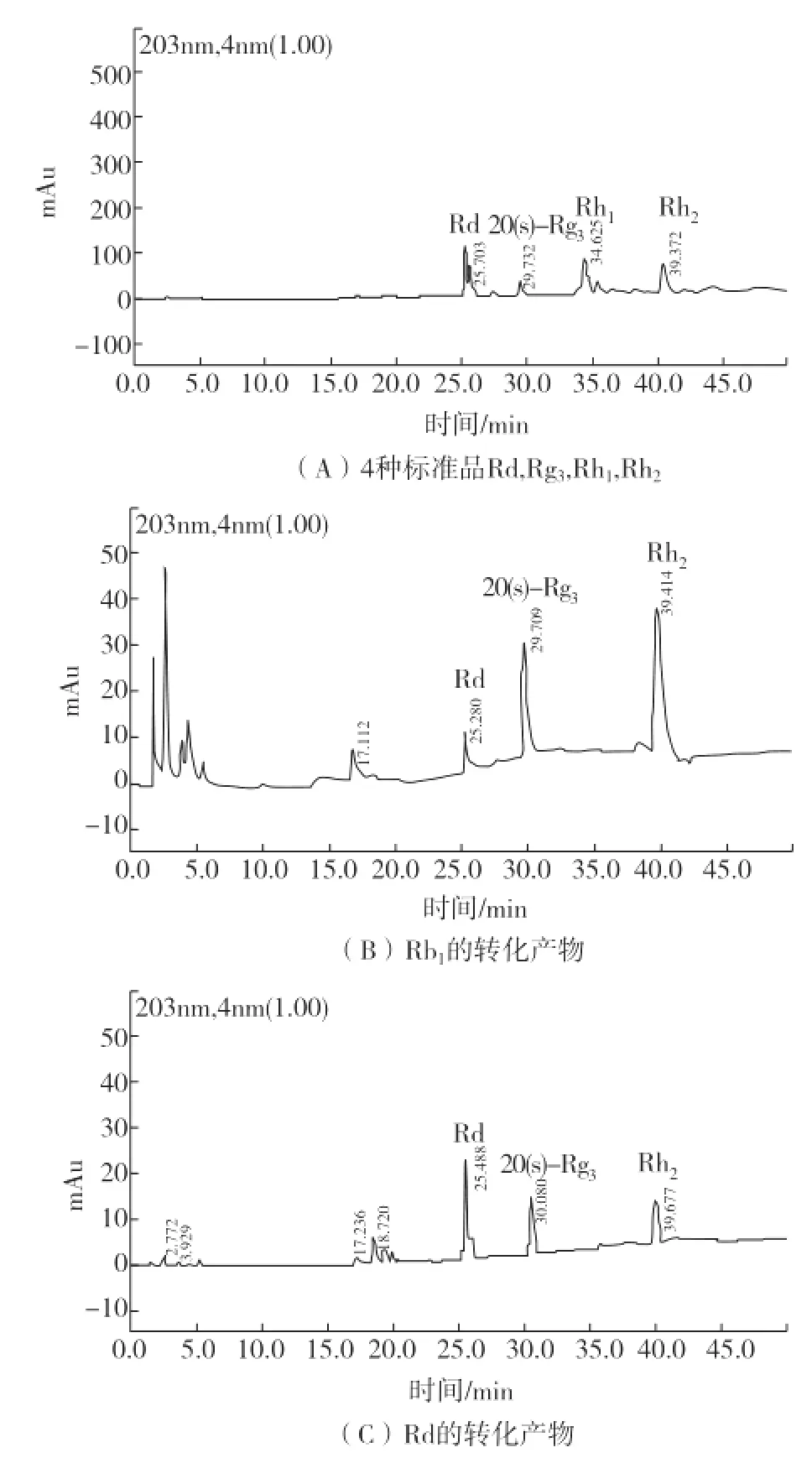
图3 活性菌株SR79转化产物HPLC检测图(0~50 min)
3 结语
目前,国内外对人参锈腐病菌C.didymium的研究较少。Brayford研究发现该病菌具有弱致病性[10]。Mackinaite&Strukcinskas发现该菌是引起立陶宛紫花苜蓿根腐病的病原菌[13]。另外,据报道,与C.didymium形态相近的C.ehrenbergii是引起加拿大和美国红车轴草和草木樨根腐病的病原菌[14-15]。Barbetti研究发现该菌对三叶草具有致病性,并对其真菌毒素进行了相关研究[16]。然而,Blok&Bollen(1995)研究认为,虽然该菌从天冬根系中分离频率较高,但对天冬无致病性[17]。张天宇研究认为该菌对西洋参无致病性[9]。由此看来,寄主不同,该菌致病性不同,而且不同菌株之间可能存在致病性差异。本研究筛选出8株柱孢属真菌,经形态学鉴定都为C.didymium,并通过致病性测定,证明该菌能够引起人参锈腐病,影响人参的营养价值和经济价值。作为我国新发生的人参锈腐病菌,该病菌应引起重视。
许多研究表明,人参中二醇组的稀有人参皂苷(如Rh2、Rg3、Compound K等),在抗肿瘤活性方面表现出了独特的作用,尤其对人参皂苷Rh2在肿瘤细胞凋亡中的作用研究较多[18]。由于人参皂苷Rh2在人参属植物中的含量极低,只存在于红参和山参中,一些研究者便采用化学方法进行制备,但化学法有污染环境、副产物多等诸多缺点,相比之下,微生物转化法资源丰富、种类繁多、底物特异性强,因此,目前很多研究者都在寻找能够将二醇类人参皂苷转化成Rh2的微生物或者酶[19-21]。本研究所筛选出的双胞柱孢C.didymium能够将人参二醇类皂苷Rb1和Rd转化成Rh2,其转化机理是由于其能产生β-葡萄糖苷水解酶,水解人参皂苷Rb1和Rd C位上的β-葡萄糖基而得到的[22]。本研究仅就该菌株对人参皂苷的转化作用进行了初步探讨,但该菌株产生的酶催化活性、酶分子结构以及提高转化效率等方面还有待进一步研究。
[1]张怡轩,陈晓莹,赵文倩.人参皂苷生物转化的研究进展[J].沈阳药科大学学报,2008,25(5):419-422.
[2]李玉.农业植物病理学[M].长春:吉林科学技术出版社,1992.
[3]白容霖.我国人参锈腐病综合防治研究进展[J].植物保护,1990,16(2):40-41.
[4]李世昌.老参地与土壤微生物生态[J].生态学杂志,1984,(5):62-64.
[5]李世昌,葵晓凤,邓春生,等.人参锈腐病菌Cylindrocarpon destructans生物学特性的研究[J].微生物学杂志,1986,6(1):22-26.
[6]徐中志.人参锈腐病研究概况[J].云南农业科技,1994(1):19-21.
[7]白容霖,王子权.人参锈腐病参根体内若干生物化学变化[J].植物病理学报,1989,19(2):75-78.
[8]PARK J D,RHEE D K,LEE Y H.Biological activities and chemistry of saponins from Panax ginseng C.A.Meyer[J].Phytochemistry,2005(4):159-175.
[9]张天宇.西洋参锈腐病病原研究[J].西北农业大学学报,1991,19(1):43-48.
[10]BRAYFORD D.Cylindrocarpon didymium[J].Mycopathologia,1987(100):119-120.
[11]严雪瑞,傅俊范.柱孢属(Cylindrocarpon)真菌和参类锈腐病的研究历史与现状[J].沈阳农业大学学报,2002,33(1):71-75.
[12]李梁,卢明春,鱼红闪,等.从一种新筛选的菌中找出人参皂苷酶[J].大连轻工业学院学报,2003,22 (3):164-167.
[13]MACKINAITE R,STRUKCINSKAS M.Micromycetes-Medicago L.root rot agents in Lithuania.2.Root rot agents of wild alfalfa species and red clover growing beside[J].Ekologija,1992(4):95-104.
[14]MCDONALD W C.The distribution and pathogenicity of the fungi associated with crown and root rotting of alfalfa in Manitoba[J].Canadian Journal of Agricultural Science,1955(35):309-321.
[15]CORMACK M V.Cylindrocarpon ehrenbergii Wr.,and other species,as root parasites of alfalfa and sweet clover in Alberta[J].Canadian Journal of Forest Research,1937(45):403-424.
[16]BARBETTI M J.Cylindrocarpon didymium-a root pathogen of subterranean clover in the lower south-west of Western Australia[J].Australasian Plant Pathology,2005,34(1):111-114.
[17]BLOK W J,BOLLEN G J.Fungi on roots and stem bases of asparagus in the Netherlands:species and pathogenicity[J].European Journal of Plant Pathology,1995,101(1):15-24.
[18]吴秀丽,王艳,赵文倩,等.一种真菌对人参皂苷Rg3的转化[J].微生物学报,2008,48(9):1181-1185.
[19]CHEN G T,YANG M,SONG Y,et al.Microbial transformation of ginsenoside Rb1by Acremonium strictum[J].Applied Microbiology and Biotechnology,2008,77 (6):1345-1350.
[20]CHENG L Q,KIM M K,LEE J W,et al.Conversion of major ginsenoside Rb1to ginsenoside F2by Caulobacter leidyia[J].Biotechnology Letters,2006,28(14): 1121-1127.
[21]DONG A,YE M,GUO H,et al.Microbial transformation of ginsenoside Rb1by Rhizopus stolonifer and Curvularia lunata[J].Biotechnology Letters,2003,25(4): 339-344.
[22]SON J W,KIM H J,OH D K.Ginsenoside Rd production from the major ginsenoside Rb1by β-glucosidase from Thermus caldophilus[J].Biotechnology Letters,2008,30(4):713-716.
Identification of Ginseng Root Rust-rot Pathogen Cylindrocarpon didymium and Its Biotransformation of Ginsenosides
LV Guo-zhong1,ZHANG Wei1,2,SUN Xiao-dong1
(1.College of Environment and Resources,Dalian Nationalities University,Dalian Liaoning 116605,China; 2.College of Life Science,Liaoning Normal University,Dalian Liaoning 116029,China)
Several Cylindrocarpon strains were obtained from rust rot disease-suspected roots of ginseg grown in Huanren areas of Liaoning province.They were confirned to be of pathogenicity to ginseng roots according to Koch's postulation.The pathogenic strains SR79,SR86,SR88,SR90,SR91,SR94,SR95,SR96 were morphologically identified as Cylindrocarpon didymium.Among these pathogens strain SR79 was found to show the specificity to transform Rb1and Rd ginsenosides into ginsenoside Rh2by methods of TLC and HPLC.This strain was shown to possess commercial potential in ginsenoside transformation.
root rust rot;pathogenic fungi;Cylindrocarpon didymium;biotransformation
S435.675
A
1009-315X(2012)03-0193-05
2011-11-07;最后
2011-11-27
国家自然科学基金资助项目(30770009);中央高校基本科研业务费专项资金资助项目(DC10020109)。
吕国忠(1964-),男,辽宁昌图人,教授,博士,学校优秀学科带头人,主要从事真菌分类与资源利用研究。
(责任编辑 邹永红)
