CD4+CD25+Foxp3hi细胞在夏氏疟原虫感染DBA/2小鼠作用研究
2012-01-12冯辉潘艳艳李莹朱晓彤曹雅明
冯辉,潘艳艳,李莹,朱晓彤,曹雅明
(中国医科大学基础医学院免疫学教研室,辽宁沈阳110001)
体内建立适时适度的保护性免疫应答有赖于免疫调节机制的精确调控。大量研究表明,调节性T细胞(regulatory T cell,Treg)在宿主免疫调控网络中发挥举足轻重的作用。Treg细胞是一群异质性细胞,从来源分为胸腺来源的特征性表达Foxp3和组成性表达CD25的天然调节性T细胞和在外周诱导产生的Tr1和Th3等。Foxp3因其是天然调节性T细胞在胸腺内发育的重要转录因子,对Treg发育及功能发挥起重要作用[1]。鼠疟或流行区个体均已经发现疟疾感染会引起Treg数量变化。近期研究发现,利用靶向基因“knockin”法下调小鼠内源性Foxp3基因表达导致Treg的抑制功能缺失[2]。流行区个体对疟疾感染的抵抗性增强源于Treg功能性缺失[3]。对西非人群疟疾易感性研究表明,Fulani人群表现为对疟疾感染抵抗与体内Treg功能相关基因Foxp3和CTLA-4低表达密切相关[3]。同时,利用恶性疟原虫感染红细胞(iRBC)与正常人外周血单个核细胞(PBMC)体外混合培养发现,iRBC能够以剂量依赖性方式诱导CD4+CD25hiFoxp3hi细胞扩增,并且对炎症性细胞因子的分泌和保护性免疫应答发挥免疫抑制作用[4]。由此,疟疾感染Foxp3表达水平与Treg功能密切相关。本研究室曾利用不同鼠疟模型研究显示,小鼠对疟原虫的易感性与Treg活化密切相关[5-6]。目前,DBA/2小鼠对致死型夏氏疟原虫(Plasmodium chabadudi chabadui AS,P.c chabadui AS)呈现易感性的原因尚不明确。为深入探讨Treg在疟疾感染中的作用地位,研究P.c chabadui AS感染DBA/2小鼠Treg活化特点,探讨Foxp3表达水平和Treg细胞功能与疟疾易感性的相互关系。
1 材料与方法
1.1 材料
1.1.1 实验动物、疟原虫6~8周龄DBA/2小鼠,购自中国科学院上海实验动物中心;P.c chabaudi AS,日本爱媛大学分子寄生虫学教研室惠赠。
1.1.2 主要试剂以下单克隆抗体(mAb)均购自美国BD Bioscience:抗-CD4-FITC mAb(GK 1.5)、抗-CD25-PE mAb(PC61)和FcγIII/II封闭抗体(2.4G2);抗-Foxp3-APC mAb(FJK-16S)和Foxp3胞内染色试剂盒,购自美国eBioscience公司。
1.2 方法
1.2.1 实验动物感染和Treg细胞消除模型制备
小鼠经腹腔感染1×106P.c chabaudi AS寄生的红细胞(pRBC),小鼠经尾静脉采血,制备薄血膜,Giemsa染色,显微镜检计数红细胞感染率。小鼠在P.c chabaudi AS感染前1 d、感染后1 d和3 d间隔腹腔注射Anti-CD25mAb(7D4,IgM)1 mg/只/次,构建Treg细胞消除鼠疟模型。对照组在同一时间点注射等量PBS。
1.2.2 脾CD4+CD25+Foxp3+细胞流式染色无菌取出小鼠脾脏,常规方法制备脾细胞悬液,用0.17 mol/L NH4Cl裂解红细胞。以含10%胎牛血清(FCS)的RPMI 1640调整脾细胞终浓度为1×107/mL。取0.1 mL脾细胞悬液,预先加入FcγⅢ/Ⅱ封闭抗体1 μg封闭30 min。设阴性对照管,抗-CD4-FITC、抗-CD25-PE和抗-Foxp3-APC单标管。每份样品同时用抗-CD4-FITC mAb和抗-CD25-PE mAb进行细胞表面双色标记,4℃孵育
30 min。洗涤1次,弃上清。每管加0.25 mL Foxp3固定透膜剂,4℃孵育30 min。洗涤1次,弃上清。每管再加入抗-Foxp3-APC mAb进行胞内染色,4℃孵育30 min。洗涤1次,弃上清。用0.5 mL FBS/PBS重悬细胞,待流式细胞仪进行检测。
1.2.3 细胞获取与分析利用流式细胞仪(FACAria II,美国B&D公司)获取细胞,使用前向散射角(FSC)及侧向散射角(SSC)确定淋巴细胞群。以阴性对照为参考,将对照管所示的非特异荧光的99%以上作为本底扣除,以单标管为对照,调整不同荧光通道补偿。每个样品获取10 000~50 000个细胞。结果以二维点阵图显示。利用FAC expressV3 software分析流式结果。
1.2.4 统计学分析应用SPSS 11.5统计学分析软件,Student's t test比较分析组内和组间均值的显著性差异。P小于或等于0.05为差异显著。
2 结果与分析
2.1 P.c chabaudi AS感染小鼠原虫血症和生存率
DBA/2对照组小鼠经腹腔感染1×106P.c chabaudi AS寄生的红细胞(pRBC),于感染后5 d外周血可见疟原虫感染红细胞,随后红细胞感染率迅速上升。在感染后5~7 d,红细胞感染率从1%升至28%。在感染后8~9 d,红细胞感染率达到峰值(40.3%)(图1b),小鼠于感染峰值后全部死亡(图1a)。在Treg消除组,疟原虫感染的红细胞在外周血中延迟出现(感染后6~7 d),红细胞感染率在原虫血症达峰值前(5~7 d)明显低于对照组(P<0.01)。原虫血症达峰值(37.5%)时间延迟至感染后10 d(图1b)。随后,红细胞感染率陡然下降。在感染后10~15 d从35%降至3%,在感染后20 d疟原虫被清除,小鼠生存期明显延长(图1a)。
2.2 P.c chabaudi AS感染小鼠CD4+T细胞表面CD25和Foxp3表达水平
与未感染小鼠相比,对照组小鼠感染P.c chabaudi AS后Foxp3表达水平明显增加。Foxp3平均荧光强度(MFI)显示,Foxp3表达水平在感染后3d出现上升且维持增高水平,直到感染后10 d,小鼠出现死亡(P<0.01,图2)。与对照组相比,Treg消除组从感染后3 d,Foxp3表达出现降低,随后有所回升。但在感染后5~8 d,Foxp3表达水平明显低于对照组(P<0.01),直到感染后10 d Foxp3表达水平回升至对照组水平(图2b)。与Foxp3表达水平相比,Treg消除组CD25表达在感染后3 d出现一个短暂性明显降低(P<0.01),随后迅速恢复至对照组水平(图2c)。

图1 P.c chabaudi AS感染DBA/2小鼠CD25消除和对照组感染过程Fig.1 P.c chabaudi AS infection in DBA/2 control and CD25-depleted mice
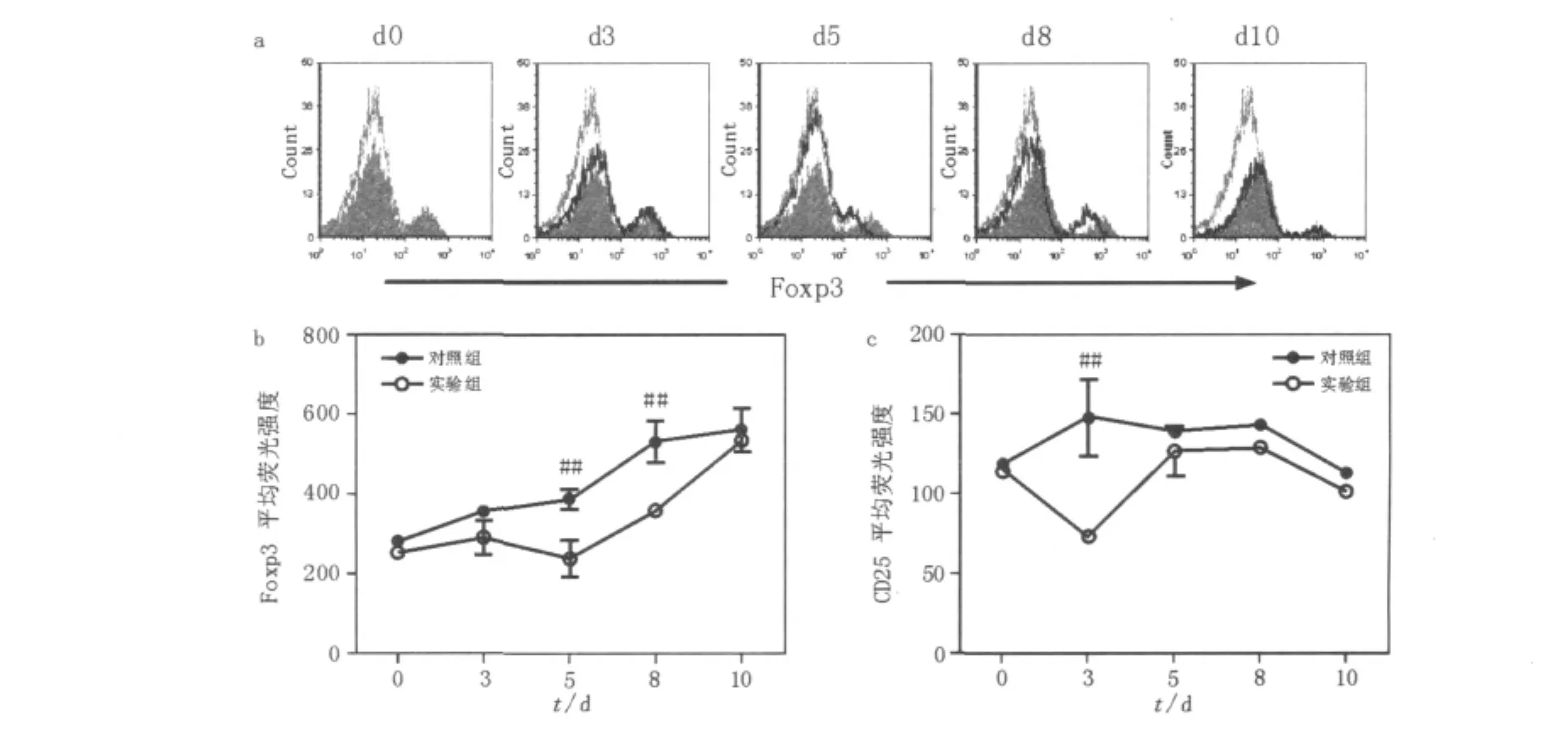
图2 P.c chabaudi AS感染中小鼠脾脏CD4+T细胞表面CD25和Foxp3表达水平比较Fig.2 The expression levels of Foxp3+on CD25+from CD4+T cells from DBA/2 control and CD25-depleted mice infected with P.c chabaudi AS
2.3 P.c chabaudi AS感染小鼠脾脏CD4+CD25+Foxp3+Treg细胞数量
鉴于P.c chabaudi AS感染后,对照组小鼠脾脏Foxp3表达出现明显增加。根据Foxp3表达的荧光强度,将高表达Foxp3的Treg细胞单独划分为CD4+CD25+Foxp3hi细胞(图3a)。与未感染小鼠相比,在感染后3 d,对照组CD4+CD25+Foxp3+细胞百分含量和绝对值数量均明显增加(P<0.01,图3d),在疟血症峰值时CD4+CD25+Foxp3+细胞绝对值达到峰值。CD4+CD25+Foxp3hi细胞的百分含量和绝对值与CD4+CD25+Foxp3+具有相似的变化趋势。然而,CD4+CD25+Foxp3hi细胞总数比CD4+CD25+Foxp3+细胞增加幅度明显(图3b、c、d、e)。与对照组相比,在感染后3~8 d,Treg消除组CD4+CD25+Foxp3hi细胞总数明显降低(P<0.01,图3b、c),在感染后10 d出现回升。在感染后3 d,Treg消除组脾脏CD4+CD25+Foxp3hi细胞总数是对照组的30%,随着对照组CD4+CD25+Foxp3hi细胞总数的增加,Treg消除组CD4+CD25+Foxp3hi细胞所占比例进一步降低。在对照组CD4+CD25+Foxp3hi细胞总数达峰值时,Treg消除组CD4+CD25+Foxp3hi细胞总数是对照组的15%。
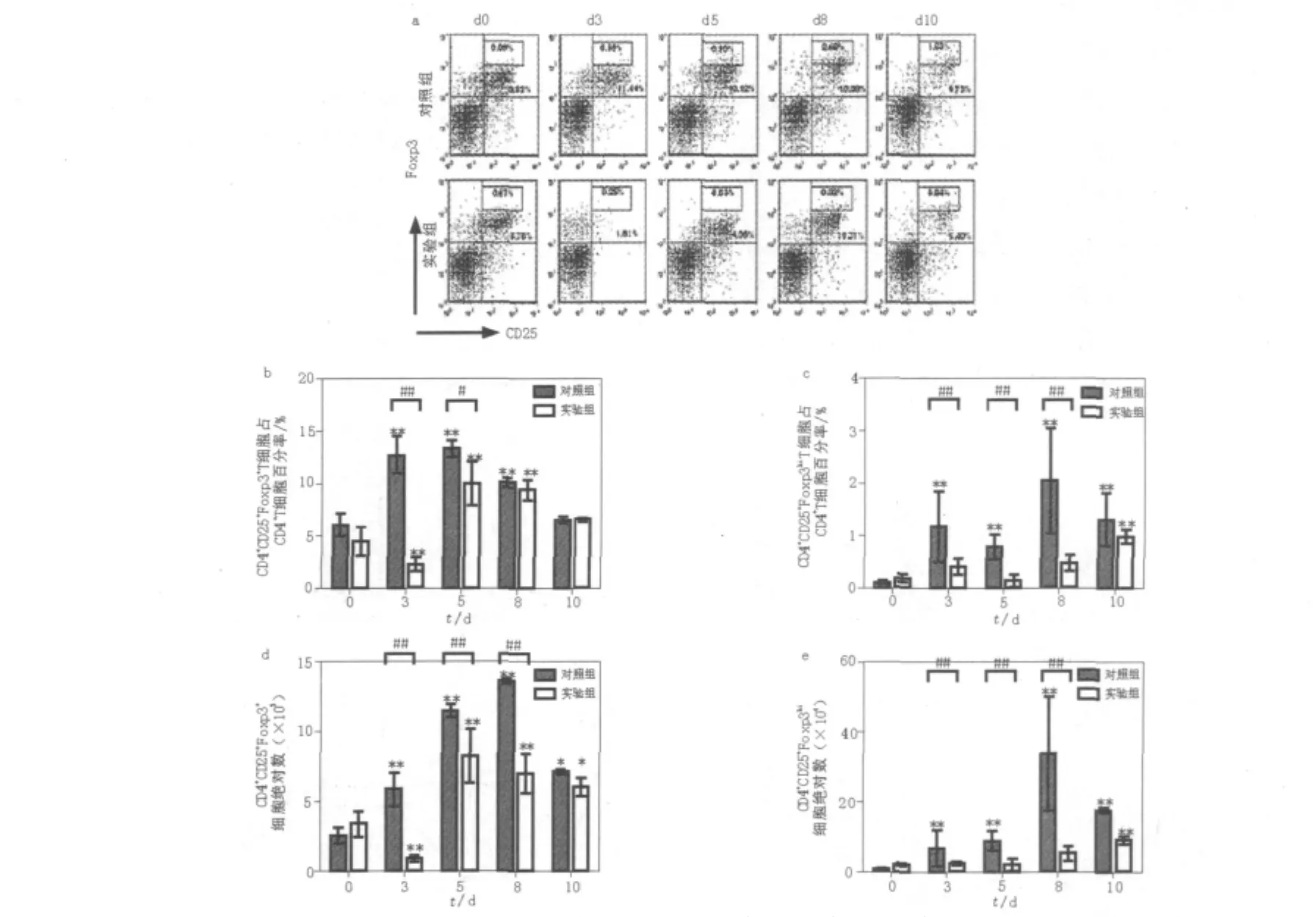
图3 P.c chabaudi AS感染中小鼠脾脏CD4+CD25+Foxp3+细胞数量比较Fig.3 The percentage and absolute number of splenic CD4+CD25+Foxp3+cells from DBA/2 control and CD25-depleted mice infected with P.c chabaudi AS infection
3 讨论
本研究结果显示,DBA/2小鼠对P.c chabaudi AS感染易感,在原虫血症达峰值后小鼠相继死亡。在感染过程中,DBA/2小鼠CD4+CD25+Foxp3+细胞数量明显增加,且以CD4+CD25+Foxp3hi增加更为明显。伴随着疟血症峰值出现CD4+CD25+Foxp3hi细胞数量亦达到峰值。相比,Treg消除鼠的原虫出现时间和疟血症峰值时间均明显延迟,且在疟血症达峰值前(5~8 d)原虫血症水平明显低于对照组。与之相应,CD4+CD25+Foxp3hi细胞数量明显处于低水平。同时,Treg消除鼠生存期明显延长。由此提示,P.c chabaudi AS感染导致Foxp3表达增加,扩增的CD4+CD25+Foxp3hi细胞有利于疟原虫复制和逃避宿主免疫应答,进而影响疟疾感染的进程和最终结局。
恶性疟患者体内Treg的活化与疟原虫高水平增殖密切相关[7]。同时,间日疟原虫感染中Treg活化数量增高与原虫负荷增加有关[8]。但同时有研究证实Treg不能对疟疾急性期感染发挥调控作用[9]。Hiseada等多个研究小组[10-14]证实Treg能够辅助原虫逃避宿主免疫监视,Treg可能是宿主对原虫发生免疫耐受的主要原因。但近期有研究显示,消除Treg将导致宿主贫血、原虫负荷增加和病理性炎症应答等不良症状出现[15]。由此可见,疟疾感染中Treg对宿主发挥免疫调控作用的利弊效应仍存在争议。
在小鼠模型中,经典消除Treg的方法是利用IgM anti-CD25 antibody 7D4[10]或IgG1 anti-CD25 antibody PC61[8]消除CD25+细胞,最终降低CD4+CD25+Foxp3+细胞数量。2种方法具有各自的优势,7D4mAb消除Treg细胞速度快但维持时间短,而PC61mAb发挥作用慢维持时间长。本研究利用7D4mAb作用快速的特点来达到短期消除CD25+细胞的效果。结果显示,7D4mAb对Foxp3高表达的影响非常明显,能够显著降低CD4+CD25+Foxp3hi细胞数量。CD4+CD25+Foxp3hi细胞的免疫抑制功能可能更为显著。
综上,P.c chabaudi AS感染导致CD4+CD25+Foxp3hi细胞数量与原虫复制密切相关。CD4+CD25+Foxp3hi细胞可能辅助原虫逃避宿主免疫应答,进而影响疟疾感染的进程和最终结局。因此,充分认识CD4+CD25+Foxp3hi细胞的免疫调控机理,对研制和开发有效的疟疾疫苗和抗疟新药将具有重要的科学意义。
[1] Fontenot JD,Gavin MA,Rudensky AY.Foxp3 programs the development and function of CD4+CD25+regulatory T cells[J].Nat Immunol,2003,4(4):330-336.
[2] Wan YY,Flavell RA.Regulatory T-cell functions are subverted and converted owing to attenuated Foxp3 expression[J].Nature,2007,445(7129):766-770.
[3] Torcia MG,Santarlasci V,Cosmi L,et al.Functional deficit of T regulatory cells in Fulani,an ethnic group with low susceptibility to Plasmodium falciparum malaria[J].Proc Natl Acad Sci U S A,2008,105(2):646-651.
[4] Scholzen A,Mittag D,Rogerson SJ,et al.Plasmodium falciparum-mediated induction of human CD25Foxp3 CD4 T cells is independent of direct TCR stimulation and requires IL-2,IL-10 and TGFbeta[J].PLoS Pathog,2009,5(8):e1000543.
[5] Zheng W,Wang QH,Feng H,et al.CD4+CD25+Foxp3+regulatory T cells prevent the development of Th1 immune response by inhibition of dendritic cell function during the early stage of Plasmodium yoelii infection in susceptible BALB/c mice[J].Folia Parasitol(Praha),2009,56(4):242-250.
[6] Chen G,Liu J,Wang QH,et al.Effects of CD4(+)CD25(+)Foxp3(+)regulatory T cells on early Plasmodium yoelii 17XL infection in BALB/c mice[J].Parasitology,2009,136(10):1107-1120.
[7] Walther M,Tongren JE,Andrews L,et al.Upregulation of TGF-beta,FOXP3,and CD4+CD25+regulatory T cells correlates with more rapid parasite growth in human malaria infection[J].Immunity,2005,23(3):287-296.
[8] Bueno LL,Morais CG,Araujo FF,et al.Plasmodium vivax:induction of CD4+CD25+Foxp3+regulatory T cells during infection are directly associated with level of circulating parasites[J].PLoS One,5(3):e9623.
[9] Walther M,Jeffries D,Finney OC,et al.Distinct roles for FOXP3 and FOXP3 CD4 T cells in regulating cellular immunity to uncomplicated and severe Plasmodium falciparum malaria[J].PLoS Pathog,2009,5(4):e1000364.
[10] Hisaeda H,Maekawa Y,Iwakawa D,et al.Escape of malaria parasites from host immunity requires CD4+CD25+regulatory T cells[J].Nat Med,2004,10(1):29-30.
[11] Long TT,Nakazawa S,Onizuka S,et al.Influence of CD4+CD25+T cells on Plasmodium berghei NK65 infection in BALB/c mice[J].Int J Parasitol,2003,33(2):175-183.
[12] Nie CQ,Bernard NJ,Schofield L,et al.CD4+CD25+regulatory T cells suppress CD4+T-cell function and inhibit the development of Plasmodium berghei-specific TH1 responses involved in cerebral malaria pathogenesis[J].Infect Immun,2007,75(5):2275-2282.
[13] Tetsutani K,Ishiwata K,Ishida H,et al.Concurrent infection with Heligmosomoides polygyrus suppresses anti-Plasmodium yoelii protection partially by induction of CD4(+)CD25(+)Foxp3(+)Treg in mice[J].Eur J Immunol,2009,39(10):2822-2830.
[14] Wu Y,Wang QH,Zheng L,et al.Plasmodium yoelii:distinct CD4(+)CD25(+)regulatory T cell responses during the early stages of infection in susceptible and resistant mice[J].Exp Parasitol,2007,115(3):301-304.
[15] Cambos M,Belanger B,Jacques A,et al.Natural regulatory(CD4+CD25+FOXP+)T cells control the production of proinflammatory cytokines during Plasmodium chabaudi adami infection and do not contribute to immune evasion[J].Int J Parasitol,2008,38(2):229-238.
