产纳豆激酶菌株Bacillus sp.ZLK08的分离及酶纯化
2012-01-12李蓓龙梅郭放何雪梅邹立扣罗燕
李蓓,龙梅,郭放,何雪梅,邹立扣,罗燕
(四川农业大学都江堰校区微生物学实验室,四川都江堰611830)
纳豆激酶(nattokinase)是在纳豆发酵过程中由纳豆芽胞杆菌产生的具有纤溶活性的丝氨酸蛋白酶。1987年日本的Sumi等[1]首次从纳豆中提取出具有溶血栓作用的纳豆激酶(nattokinase NK),该酶能显著分解血栓的主要成分—纤维蛋白,激活静脉内皮细胞产生纤溶酶原激活剂(t-PA),从而增加内源性纤溶酶的量及作用效果。纳豆激酶可作为一种具有开发潜力的食品性溶栓药物,源于传统发酵食品,安全性较高,随着人民生活水平的提高,心血管疾病致死率不断提高,纳豆激酶产品具有溶栓效果好、可口服及半衰期长等特点,具有广阔的应用前景,鉴于此,本研究拟筛选出高酶活纳豆激酶菌株,并对其分离纯化,为纳豆激酶产生菌的发酵、产品的研制奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株国内外产纳豆样品,产纳豆激酶Bacillus subtilis ZLK08菌株为四川农业大学都江堰校区微生物学实验室分离获得。
1.1.2 培养基普通营养琼脂培养基购自杭州微生物试剂有限公司。菌种分离培养基(%):葡萄糖0.5,蛋白胨1,牛肉膏0.5,酵母浸出物0.5,NaCl 0.5,琼脂粉1.8,pH 7.0~7.2;种子液培养基(%):葡萄糖1,酵母浸出物1,MgSO4·7H2O 0.05,K2HPO4·3H2O 0.1,pH 7.0~7.2;发酵培养基(%):葡萄糖2,CaCl20.64,酵母浸出物0.74,K2HPO4·3H2O 0.1,MgSO4·7H2O 0.05,pH 7.0~7.2,药品均为化学纯。
1.1.3 试剂DNA分子量标准DL2000、dNTP及TaqDNA聚合酶等购自天根生化科技(北京)有限公司;蛋白质低范围分子量Marker,16S rDNA引物:27F:5'-AGAGTTTGATCCTGGCTCAG-3',1492R:5'-TACGGCTACCTTGTTACGACTT-3'引物由上海Sangon生物工程公司合成;纤维蛋白原、凝血酶购自Sigma公司。
1.1.4 仪器与设备Eppendorf微量移液器、Olympus显微镜、PCR仪(Bio-Rad)、层析仪(Biological LP,Bio-Rad)、高速冷冻离心机(Eppendorf 5804R,德国)、电泳仪DYY-2C型(北京市六一仪器厂)、电泳成像仪(Bio-Rad)、低温冷冻柜BD25-5LT型(青岛海尔特种电冰柜有限公司)、双人单面净化工作台SW-SJ-2FD型(苏州净化设备有限公司),小型涡旋振荡器、水浴锅及电热恒温培养箱等。
1.2 方法
1.2.1 产酶菌株的分离与培养取各来源的纳豆制品,从中取2~5粒放入灭菌试管中并加入9 mL无菌生理盐水,将菌悬液梯度稀释,取少量各稀释度的液体涂布于分离培养基表面,倒置培养皿于37℃培养18~24 h,观察菌落特征,将获得的菌株划线于普通营养琼脂培养基,37℃培养18~24 h,挑取菌株接种至20 mL种子液培养基,37℃,170 r/min摇震培养18~24 h,至OD600=7~8时,按5%(体积比)接种于发酵培养基,37℃,170 r/min摇震培养72 h。
1.2.2 菌株的鉴定挑取普通营养琼脂培养基上菌落,革兰染色后显微镜下观察其形态。PCR扩增体系50 μL,包括超纯水41 μL,10×Buffer 5.0 μL,4×dNTP 1.0 μL,27F和1492R各1.0 μL,Taq酶0.5 μL用无菌牙签挑取牛肉膏蛋白胨培养基上菌落作模板。每个反应为30个循环,每个循环包括94℃变性1 min,50℃退火1 min,72℃延伸1.5 min,首次循环先在94℃预变性7 min,最后1次循环后在72℃延伸10 min,扩增产物经0.8%琼脂糖凝胶电泳后用凝胶成相系统(Bio-Rad)观察并保存。样品送上海生工生物工程有限公司测序,将测序序列在GenBank中blast(http://www.ncbi.nlm.nih.gov/)比对,选取相关序列利用分子生物学软件分析同源性,菌株确认后用于下步实验。
1.2.3 纳豆激酶酶活测定纳豆激酶的活性测定参照文献[2-3]。首先,取0.4 mL浓度为0.72%的纤维蛋白原放入试管中,并加入0.1 mL 245 mmol/L磷酸盐缓冲液(pH 7.0)混匀,37℃孵育5 min,加0.1 mL 20 U/mL凝血酶溶液,37℃孵育10 min,加入0.1 mL稀释酶液(发酵液),继续于37℃孵育60 min,分别于20、40 min摇匀1次,60 min后加入0.7 mL 0.2 mol/L TCA终止反应,混合液经10 000 r/min离心10 min后,于275 nm测定上清吸光度。1 unit(Fibrin degradation unit,FU)定义为275 nm每分钟吸光度增加0.01的值。
1.2.4 纳豆激酶的纯化取种子培养液,4℃10 000 r/min离心10 min,取上清,65%硫酸铵过夜沉淀,4℃10 000 r/min离心20 min,取上清液,85%硫酸铵过夜沉淀,4℃10 000 r/min离心20 min,弃上清液,沉淀溶于10 mmol/L Tris-HCl(pH 7.0)中,充分溶解后透析过夜,聚乙二醇过夜浓缩,Sephacryl S-200 HR凝胶过滤后收集,分别测定各管酶活。
1.2.5 纳豆激酶SDS-PAGE分离胶浓度12.5%,浓缩胶浓度4.4%。经诱导培养后,取1 mL培养液,离心取上清,10 000 r/min室温离心5 min后,取20 μL上清液(纯化酶液)加入等量的2×SDS加样缓冲液(100 mmol/L Tris-HCl pH 6.8,200 mmol/L DTT,4%SDS,0.2%溴酚蓝,20%甘油),沸水煮5 min,取10 μL上样聚丙烯酰胺凝胶(4.4%的浓缩胶,12.5%的分离胶)。同时以诱导前样品作为对照,观察是否有新生蛋白带出现。
2 结果与分析
2.1 产酶菌株的鉴定
根据酶活测定结果,共筛选出产酶菌株6株,选取其中酶活最高、产酶稳定菌株做形态学、分子生物学鉴定。结果表明,选取的菌株在普通营养琼脂培养基上菌落不透明,微黄色,整体易挑起或成丝状,镜检为G+,成竹节状,芽胞中端或偏生,不膨大(图1),液体培养基中生长时,形成菌醭。

图1 Bacillus sp.ZLK08显微镜下特征Fig.1 Characteristic of Bacillus sp.ZLK08 under microscope
目前,16S rDNA已成功用于纳豆激酶菌株的鉴定[4]。选取的菌株16S rDNA测序结果表明其长度为1 461 bp,(G+C)=55.3%。GenBank中序列比对显示,其与BacillussubtilisT429(HQ441254),B.subtilis Baws1(HQ711983),Bacillus sp.DYJL24(HQ317164),B.amyloliquefaciens NMSX4(GU568185),B.amyloliquefaciens IMAUB1034(FJ641035),B.methylotrophicus(HQ325853),B.polyfermenticus bA8(JF772465)及B.subtilis BRZ4(GQ395246)的同源率均达到99%,据此,结合形态特征,确定此菌属芽胞杆菌属,命名为Bacillus sp.ZLK08。
2.2 产酶菌株的酶活测定
按5%(体积比)接种于发酵培养基,37℃摇震培养72 h后取上清,反应前纤维蛋白原凝固且不透明,反应后纤维蛋白原被纳豆激酶溶解且透明(图2),60 min于275 nm测定上清吸光度,结果表明其酶活达到2.5 FU/mL,与San-Lang等[3]报道相当,可见Bacillus sp.ZLK08菌株具有较高纳豆激酶活性,重复性试验显示Bacillus sp.ZLK08菌株产酶稳定。

图2 纳豆激酶反应前后纤维蛋白原的变化Fig.2 The change of fibrinogen before and after reaction
2.3 纳豆激酶的SDS-PAGE
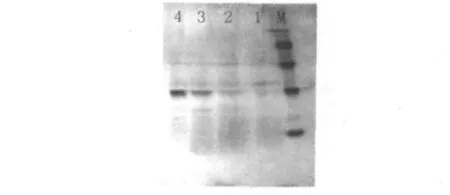
图3 上清液SDS-PAGEFig.3 SDS-PAGE of supernatant
Bacillus sp.ZLK08菌株诱导后上清SDSPAGE见图3。经过硫酸铵盐溶、盐析后纳豆激酶浓度增加,Sephacryl S-200 HR凝胶过滤后得纳豆激酶单一条带,经分析分子量为28.46 ku,与Fujita M.[5]、Xin-mian H.等[6]报道相似。
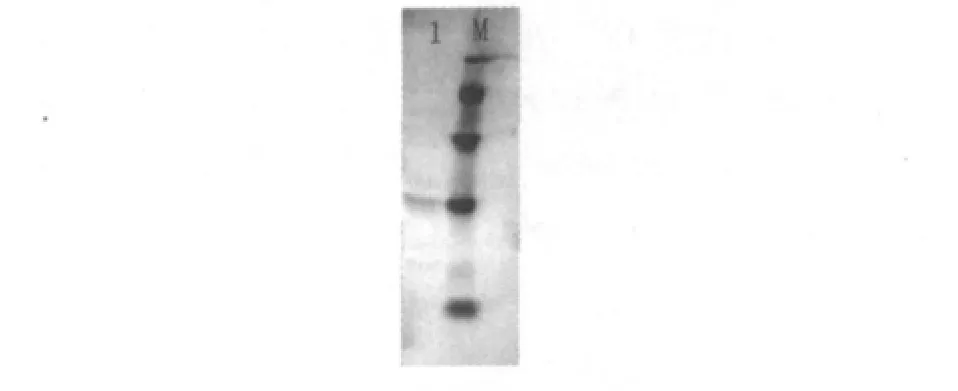
图4 纯化纳豆激酶SDS-PAGEFig.4 SDS-PAGE of purified nattokinase
3 讨论
本研究成功获得稳定产酶的芽胞杆菌Bacillus sp.ZLK08,16S rDNA分析表明其与GenBank中序列同源率达到99%,液体发酵表明酶活达到2.5 FU/mL,SDS-PAGE表明纳豆激酶分子量为28.46 ku。可见,分离出的Bacillus sp.ZLK08菌株能稳定产纳豆激酶且具有较高酶活,并可用于纳豆激酶产生菌的发酵及产品的研制。
[1] Sumi H.,Hamada H.,Tsushima H.,et al.A novel fibrinolytic enzyme(nattokinase)in the vetetable cheese Natto:a typical and popular soybean food in the Japanese diet[J].Experientia,1987,43(10):1110-1111.
[2] Junguo Liu,Jianmin Xing,Tianshi Chang,et al.Optimization of nutritional conditions for nattokinase production by Bacillus natto NLSSE using statistical experimental methods[J].Process Biochemistry,2005,40(8):2757-2762.
[3] San-Lang Wang,Hsin-Jen Chen,Tsu-Wen Liang,et al.A novel nattokinase produced by Pseudomonas sp.TKU015 using shrimp shells as substrate[J].Process Biochemistry,2009,44(1):70-76.
[4] 马明,杜金华,王因,等.1株产纳豆激酶菌株的分离筛选及鉴定[J].食品与发酵工业,2007,33(5):37-41.
[5] Fujita M.,Nomura K.,Hong K.,et al.Purification and characterization of a strong fibrinolytic enzyme(Nattokinase)in the vegetable Cheese Natto,a popular Soybean fermented food in Japan[J].Biochemical and Biophysical Research Communications,1993,197(3):1340-1347.
[6] Xin-mian H.,Run-fang G.,Hong-wei Y.,et al.Cloning and expression of one fibrinolytic enzyme from Bacillus sp.zlw-2[J].Agricultural Sciences in China,2009,8(5):591-596.
