6个烟草杂交组合花药再生苗的培养和DH群体的构建
2011-12-31陈学军彭双玉罗建蓉杨彦明肖炳光
陈学军,彭双玉,2,罗建蓉,2,杨彦明,肖炳光,①
烟草(Nicotiana tabacum L.)育种过程中,加倍单倍体(doubled haploid,DH)在缩短育种进程、提高目标性状筛选效率及构建数量性状基因定位群体等方面发挥着越来越重要的作用[1-3]。目前,利用花药培养构建烟草DH群体的研究已有报道:朱惠琴等[4]构建了‘G28’בNC2326’和‘K326’בCoker176’2个烤烟杂交组合DH群体;柴利广等[5]构建了‘B37’(高烟碱)בLAB21’(低烟碱)和‘B37’(中抗黑胫病)בB67’(感黑胫病)2个DH群体。但是,尚未见以不同类型栽培烟草杂交组合后代为材料进行烟草DH群体构建的相关研究报道。
烟草DH群体构建的方式通常是先将花药培养成再生植株,然后再利用秋水仙素进行人工处理使染色体加倍。虽然目前有关烟草花药培养的技术已经比较成熟,但要想获得大量加倍单倍体苗、建立烟草DH群体尚有一定的难度。
鉴于此,作者在前人实验的基础上对花药培养步骤进行简化,并改进了DH群体构建方法,选择在品质方面表现突出的不同类型烟草品种作为杂交亲本开展6个杂交组合DH群体的构建,为下一步开展特色烟叶品质育种、遗传连锁图谱构建及在烟草常规育种工作中开展单倍体育种奠定研究基础。
1 材料和方法
1.1 材料
供试的烟草杂交组合为‘红大’בHicks’、‘红大’בK326’、‘红大’ב白肋21’、‘红大’ב巴斯玛’、‘白肋21’בTN86’和‘巴斯玛’ב沙姆逊’,分别以DH1~DH6表示。所有杂交组合于2008年12月10日移栽至云南省烟草农业科学研究院试验基地温室内,2009年3月20日植株开始陆续现蕾时,选取处于花粉单核中、后期的花蕾(花冠刚露出花萼或两者平齐),将花蕾置于4℃冰箱中冷藏,备用。
1.2 方法
1.2.1 花药培养 在超净台上小心剥去花萼及花冠,将花药直接接种到装有H基本培养基[6](不含生长激素)的兰花培养瓶中,每瓶50枚花药,于温度25℃、光照时间14 h·d-1、光照度4 000 lx的条件下培养。接种35 d后统计出苗的花药数。然后将具有2~4片真叶的再生苗分别转接到MS基本培养基中,每瓶转接约30株苗。
1.2.2 添加H液体基本培养基对花药出苗状况的影响 选取开花较早的杂交组合DH1和DH2的花药,按上述方法前处理并接种培养,约15 d后添加20 mLH液体基本培养基,对照则不添加H液体基本培养基,在上述条件下培养20 d后统计每枚花药的出苗数。每处理100枚花药,各重复3次。
1.2.3 染色体加倍处理及再生苗大田移栽 待再生苗长至高3~4 cm(4~6片叶)时,采用秋水仙素浸苗法(秋水仙素质量体积分数为0.4%)[4]进行染色体加倍处理,浸苗时间为48 h。取出小苗,用清水洗去根部残余的培养基后移植于漂浮育苗盘(长66 cm、宽34 cm,每盘有162个直径3 cm的育苗孔)上;将育苗盘置于育苗池(长7.4 m、宽1.3 m)中,覆盖塑料薄膜保湿炼苗7 d后将幼苗移到大棚温室中培养;30 d后移栽至大田中,株距30 cm、行距50 cm,采用常规栽培措施。统计各杂交组合的处理苗数、成苗数(温室培养30 d)、大田移栽苗成活数(移栽后7 d)及染色体加倍苗数,并计算成苗率、大田移栽成活率及染色体加倍率。染色体加倍苗数以开花期观察的不同倍性苗的叶片、花器官形态及结实情况为准。
1.2.4 单倍体苗和加倍单倍体苗叶片气孔保卫细胞叶绿体数测定 选取DH1单倍体苗及其加倍单倍体苗,于移栽后8~13片真叶时取植株顶端向下第5片叶,撕取叶下表皮置于载玻片上并滴加质量浓度5.00 g·L-1的碘-碘化钾(质量比1∶4)溶液染色,加盖玻片后在40倍显微镜下统计气孔保卫细胞内的叶绿体数;每一叶片随机选取5个气孔保卫细胞观察统计叶绿体数并计算平均值。
1.3 数据统计分析
烟草杂交组合花药再生苗的成苗率、大田移栽成活率及染色体加倍率的计算公式分别为:成苗率= (加倍处理后成活的再生苗数/用于加倍处理的再生苗数)×100%;大田移栽成活率=(大田移栽后成活的再生苗数/加倍处理后成活的再生苗数)×100%;染色体加倍率=(染色体加倍的植株数/大田移栽后成活的再生苗数)×100%。
采用SAS 8.0分析软件对实验数据进行统计和方差分析。
2 结果和分析
2.1 烟草杂交组合花药出苗数的比较
6个烟草杂交组合的花药在接种1个月左右开始出苗,各杂交组合的出苗数见表1。6个杂交组合接种的花药数为4 766~6 949枚,出苗数为9 061~15 925株。其中,DH6花药的出苗数最少,为9 061株;DH5接种的花药数并不是最多,但出苗数最多,达到15 925株。6个杂交组合每枚花药的出苗数差异较大,其中,DH5的每枚花药出苗数最多,达到3.30株,显著高于其他杂交组合(P<0.05);另外5个杂交组合每枚花药的出苗数为1.57~2.01株,各杂交组合间无明显差异(P>0.05)。
2.2 添加H液体基本培养基对烟草杂交组合花药出苗的影响
在花药培养约15 d后添加H液体基本培养基,DH1和DH2每枚花药的平均出苗数分别达到3.45和3.52,均高于各自未添加H液体基本培养基的对照组(2.21和2.03),差异达显著水平(P<0.05)。
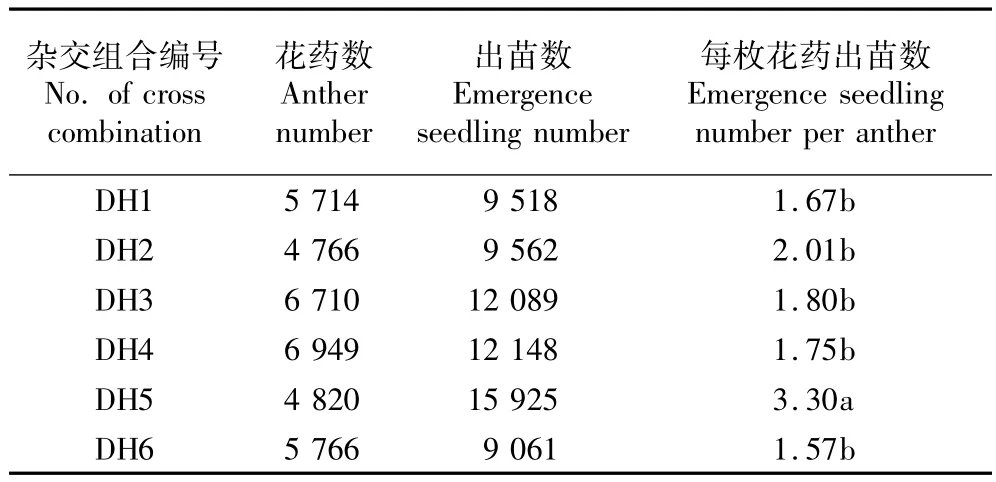
表1 6个烟草杂交组合花药出苗数的比较1)Table1 Comparison of emergence seedling number of anthers of six cross combinations of Nicotiana tabacumL.1)
2.3 烟草杂交组合花药再生苗的染色体加倍率及成苗率的比较
6个烟草杂交组合的47 763株花药再生苗经加倍处理后移栽至大田,不同杂交组合的成苗率、大田移栽成活率及染色体加倍率见表2。经加倍处理后各杂交组合再生苗的成苗率为21.12%~33.42%,其中,DH3的成苗率最低,为21.12%;DH6的成苗率最高,为33.42%。各杂交组合植株的大田移栽成活率都在90%以上,其中,DH6的大田移栽成活率最高,为98.86%;DH3的大田移栽成活率最低,为91.87%。DH1~DH6再生苗的染色体加倍率为6.64%~10.78%,其中,DH5的染色体加倍率最低,为6.64%;DH4的染色体加倍率最高,为10.78%。
通过上述的花药培养、染色体加倍处理及大田移栽等一系列步骤,获得了6个烟草杂交组合的DH群体,包含的加倍单倍体株数为126~203株。

表2 经加倍处理后6个烟草杂交组合花药再生苗成苗、大田移栽成活及染色体加倍状况的比较Table 2 Comparison of seedling,surviving of transplanted in field and chromosome doubling status of regenerated seedlings from anthers of six cross combinations of Nicotiana tabacum L.after doubling treatment
2.4 烟草杂交组合DH1单倍体苗及其加倍单倍体苗叶片气孔保卫细胞叶绿体数的比较
DH1单倍体苗及其加倍单倍体苗叶片气孔保卫细胞中的叶绿体数分别为5~13和16~19,平均数分别为9.27和17.46;二者的比值接近1∶2,且差异显著(P<0.05)。朱惠琴等[7]认为,烟草气孔保卫细胞叶绿体数随染色体倍性的提高而增加,气孔保卫细胞中的叶绿体数可作为烟草染色体倍性的鉴定依据。根据本研究结果也可对烟草杂交组合染色体加倍单倍体苗的倍性进行鉴定。
3 讨 论
3.1 花药培养及染色体加倍方法的改进
与常规花药培养方法相比,作者在无菌环境下用无菌镊子剥去花萼及花冠后直接将花药接种到H基本培养基上进行培养,无需对花药进行消毒处理,减少了操作过程中对花药的损伤,提高了花药的出苗数并极大降低了污染率,简化了操作步骤。同时,在培养过程中向已培养约15 d的烟草花药培养瓶中滴加20 mL H液体基本培养基,既使花药出苗数得到显著提高又无需转瓶,提高了培养效率,也减轻了劳动强度,对大规模开展花药培养具有一定的意义。
本研究中,作者对花药再生苗的染色体加倍步骤也进行了一定的简化,直接用质量体积分数0.4%秋水仙素对单倍体苗进行浸苗,48 h后将处理苗取出并清洗后直接转移到漂浮育苗盘上,再经室内保湿锻炼1周后移至温室中培养30 d,然后将植株移栽到大田中,这样的操作步骤既提高了工作效率又降低了污染率。另外,用于加倍处理的秋水仙素比较昂贵,在用秋水仙素处理时将培养基倒扣(生长点向瓶底,培养基向瓶盖),可节省试剂的用量。同时,将已经使用过1次的秋水仙素灭菌后重复使用1次,可以节省试剂损耗,但此方法对DH群体成活率及染色体加倍率的影响有待进一步实验研究。
3.2 花药培养及DH群体构建中存在的问题
在本研究中,接种1个月左右花药开始出苗,不同批次、不同培养瓶及不同群体间的出苗状况差别极大。例如,个别批次几乎所有杂交组合的花药均未出苗;同一培养瓶中有些花药出苗几十株,有些只有1至几株,有些花药甚至不出苗。这一现象可能与培养基配制、消毒步骤、花药选取时间、花药部位及花药的生理状况有关。在整个培养过程中共诱导出68 303株再生苗,其中的2 200株出现白化现象,由于这些白化苗不能正常进行光合作用,在育种上没有利用价值,造成一定的浪费。虽然白化苗的产生可能是基因型决定的,但也不排除温度过高的影响。
如今,花药培养技术已作为一种常规手段应用于育种工作中,但由于研究的对象和内容尚不够广泛深入,这项技术还没有达到完全成熟的地步。目前,花药培养技术存在的主要问题是:1)白化苗的产生会影响花药培养效果,虽然有研究者对此进行了一些研究,但是尚未找到能从根本上克服白化苗形成的方法;2)染色体加倍技术有待进一步改进。
本研究中,在进行大批量花药再生苗染色体加倍时,采用的是秋水仙素浸苗法,经加倍处理后再生苗的成活率仅约30%,不可避免地造成加倍单倍体优异材料的丢失,而且存活再生苗的染色体加倍率均不到11%,有些甚至更低。因而,在烟草单倍体育种实践中,建议采用离体快繁方法开展单倍体加倍研究[8],这将对加速烟草品种选育具有重要意义。
[1]Kumashiro T,Oinuma T.Comparison of genetic variability among anther-derived and ovule-derived doubled haploid lines of tobacco[J].Japanese Journal of Breeding,1985,35:301-310.
[2]Wernsman E A,Matzinger D F,Rufty R C.Androgenetic vs.gynogenetic double haploids of tobacco[J].Crop Science,1989,29:1151-1155.
[3]肖炳光,徐照丽,陈学军,等.利用DH群体构建烤烟分子标记遗传连锁图[J].中国烟草学报,2006,12(4):35-40.
[4]朱惠琴,张宪银,薛庆中.开发实用的染色体加倍体系构建成烟草DH群体[J].分子植物育种,2004,2(5):643-648.
[5]柴利广,张俊杰,林国平,等.白肋烟两个DH群体的构建与染色体倍性的鉴定[J].中国烟草学报,2007,13(2):33-37.
[6]Bourgin J P,Nitsch J P.Production of haploid Nicotiana from excised stamens[J].Annales de Physiologie Vegetale,1967,9: 377-382.
[7]朱惠琴,张宪银,薛庆中.烟草染色体倍性快速鉴定方法[J].农业生物技术学报,2006,14(2):255-258.
[8]Kasperbauer M J,Collins G B.Reconstitution of diploids from leaf tissue of anther-derived haploid in tobacco[J].Crop Science,1972,12:98-101.
