大泷六线鱼(Hexagrammos otakii)荧光AFLP分析体系的建立及优化
2011-12-28仝颜丽李海东王玲王波郑明刚
仝颜丽,李海东,王玲,王波,郑明刚
(1.日照职业技术学院,山东 日照 276826;2.青岛大学,山东 青岛 266061;3.国家海洋局第一海洋研究所 海洋生态中心,山东 青岛 266061)
大泷六线鱼(Hexagrammos otakii)荧光AFLP分析体系的建立及优化
仝颜丽1,李海东1,王玲2,王波3,郑明刚3
(1.日照职业技术学院,山东 日照 276826;2.青岛大学,山东 青岛 266061;3.国家海洋局第一海洋研究所 海洋生态中心,山东 青岛 266061)
以大泷六线鱼为材料,通过对DNA提取质量和浓度、EcoRⅠ/MseⅠ酶切反应时间、Mg2+浓度、dNTPs浓度、引物浓度以及选择性扩增中预扩增产物稀释倍数等关键因素进行研究,建立并优化了大泷六线鱼荧光AFLP分子标记反应体系。用优化的反应体系,筛选到10对适合大泷六线鱼的引物,为今后利用AFLP标记技术进行大泷六线鱼的遗传多样性研究提供了标准化程序。
大泷六线鱼;AFLP;分子标记;反应体系
大泷六线鱼(Hexagraminos otakii)又名欧式六线鱼,俗称黄鱼,隶属于蚰形目(Scorpaeniformes)、六线鱼科(Hexagrammidae)、六线鱼属(Hexagrammos)。大泷六线鱼属冷温性近海底层鱼类,主要分布于我国山东和辽宁等地的近海多岩礁海区以及日本、朝鲜及俄罗斯远东诸海[1]。六线鱼为沿岸浅海定居性鱼类,耐低温、适应能力较强、肉味鲜美,深受国内沿海地区人民的喜爱,已被列为我国名贵海水养殖对象。目前对该鱼的研究多集中于其生物学、育苗和营养方面[2-4],遗传多样性方面的研究还未见报道。
扩增片断长度多态性(amplified fragment length polymorphism,AFLP)标记是由荷兰科学家Zabeau和Vos在PCR和RFLP技术的基础上发展起来的一种DNA多态性检测方法,具有RAPD和RFLP技术的双重优点。AFLP对基因组的多态性检测不需要预知该基因组的序列特征,易于标准化,被认为是一种理想有效的分子标记技术,现已被广泛应用于遗传多样性分析、品系分析、生态分析等诸多方面[6]。在海洋生物领域,AFLP技术已在栉孔扇贝[7]、虹鳟[8]、日本对虾[9]、大黄鱼[10]等生物中得到了应用, 但是在大泷六线鱼中的研究还未见报道。
针对不同的试验材料,建立合适的AFLP反应体系对于试验结果显得尤为重要。本研究通过对大泷六线鱼荧光AFLP反应体系进行优化,建立了适合大泷六线鱼的荧光AFLP分析体系,为大泷六线鱼的遗传多样性分析及种质资源的保护提供支持。
1 材料与试剂
1.1 实验材料
本实验所用大泷六线鱼取自青岛近岸水域,实验样品液氮速冻后置-80℃冰箱保存。
1.2 试剂与仪器
EcoRⅠ、Mse Ⅰ(NEB),T4 DNA ligase(MBI),Taq酶(TaKaRa),Mse I/EcoR I接头(上海生工),荧光引物(上海生工),GeneScan-500 LIZ(Applied Biosystems),Hi-Di Formamide(Applied Biosystems),超微量分光光度计(GEHC),PCR扩增仪(Bio-Rad),DL2000 marker(TaKaRa),凝胶成像分析仪(SYNGENE),ABI3130 genetic analyzer(Applied Biosystems),Bullet Blender快速组织细胞破碎仪(Next Advance)
2 方 法
2.1 基因组DNA提取
采用改进的蛋白酶K消化法进行DNA的提取:取-80 ℃冷冻保藏的肌肉组织100 mg,用灭菌的双蒸水冲洗干净,用吸水纸将表面的水吸干,置于1.5 mL离心管。加入450 μL 裂解缓冲液(4.5 μL 10 mmol/L Tris-HCl pH=8.0;90 μL 100 mmol/L EDTA pH=8.0和355 μL双蒸水),于细胞破碎仪将组织破碎,加入10%SDS 150 μL、ProtenaseK 7.5 μL混匀,55 ℃消化(上下缓慢颠倒数次以充分消化至澄清(约3~5 h),加入150 μL NaCl(5mol/L) 混匀,8 000 r/min 离心10 min,吸取上清。加入等体积预冷的异丙醇,混匀,-20 ℃放置30 min,6000 r/min 离心5 min,沉淀用70%乙醇(600~800 μL)洗涤2~3遍。500 μL双蒸水溶解上述沉淀,加等体积饱和酚液,缓慢来回颠倒混匀10 min,12 000 r/min离心10 min;吸取上层水相,加等体积酚︰氯仿︰异戊醇(25︰24︰1)缓慢颠倒混匀10 min,12 000 r/min离心10 min;吸取上层水相,加等体积氯仿︰异戊醇=24︰1缓慢颠倒混匀10 min,12 000 r/min离心10 min取上清。上清中加入1/10体积2 mol/L NaAc和2倍体积预冷的无水乙醇,-20 ℃放置30 min,12 000 r/min离心10 min去乙醇,500μL 70%乙醇洗涤沉淀,风干加适量双蒸水溶解。取3 μL DNA进行琼脂糖凝胶电泳检测DNA质量,用核酸超微量分光光度计进行定性定量分析。
2.2 酶切体系的优化
酶切反应采用EcoRI和MseI双酶切组合,酶切体系为:10×NEB buffer 5 μL,100×牛血清白蛋白(BSA)0.5 μL,EcoRI-HF(20 U/μL)1 μL,MseI(10 U/μL)1 μL,模板DNA用量2 μg加双蒸水至50.0 μL。37 ℃水浴1 h,2 h,4 h,6 h以优化酶切时间,65 ℃水浴20 min,使酶失活。1%琼脂糖凝胶电泳检测酶切结果。
2.3 接头连接体系
酶切产物加入已退火的EcoRI接头和MseI接头以及T4 DNA连接酶于16 ℃过夜连接。连接体系如下:酶切产物20.0 μL,T4 Ligase(3 U/μL) 0.2 μL,10×T4 Ligase buffer 0.5 μL,EcoRI接头(10 μmol/L) 0.5 μL, MseI接头(100 μmol/L)0.5 μL,加双蒸水至25.0 μL。
2.4 预扩增反应体系
以连接产物作为模板进行预扩增反应。预扩增反应体系为:10×PCR Buffer 2.0 μL ,dNTPs(各2.5 mmol/L)0.4 μL,E +A(10 mmol/L)0.6 μL,M+C(10 mmol/L)0.6 μL,Taq DNA聚合酶1 U,MgCl(225 mmol/L)1.2 μL,连接产物2 μL,加ddH20至总体积为20 μL 。扩增程序为:94 ℃ 5 min;94 ℃30 s,56 ℃ 1 min,72 ℃ 1 min, 20个循环;72℃10 min。预扩增产物用1%琼脂糖凝胶电泳检测。
2.5 选择性扩增反应体系及其优化
参照预扩增产物的粗略浓度稀释一定倍数后作为选扩模板,选扩引物为 E+3/M+3引物组合,其中E+3为荧光标记引物。选扩反应体系为:预扩增产物稀释液5 μL,10×PCR Buffer 2.0 μL, dNTPs(各2.5 mmol/L)1.6 μL,选择性扩增引物(10 μmol/L)各0.8 μL,Taq DNA聚合酶0.5 U,MgCl2(25 mmol/L)1.6 μL,加ddH20至总体积为20 μL。作者就对选扩结果影响较大的4个因素进行了优化(表1)。 对其中一个因素优化时,保持其它因素不变,比较不同处理结果对扩增结果的影响。
收集2015年1月~2015年12月来我院口腔科门诊就诊的粘液腺囊肿病人260例,男116例,女144例,年龄16~50岁,囊肿直径0.5—2.0 cm,其中上下唇105例,舌部155例。所有病例均为首次出现的粘液腺囊肿。

表 1 PCR反应体系中各因素处理方案Tab.1 Different treatments of PCR systems
扩增程序为:94 ℃ 5 min;94 ℃变性30 s,65~56 ℃(每个循环降0.7 ℃)退火30 s,72 ℃延伸1 min,共12个循环;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min,共20个循环;72 ℃延伸10 min。选扩产物用2%的琼脂糖凝胶电泳检测,确定扩增片度大小范围,用于后续荧光检测。
2.6 PCR产物的荧光检测
取选扩产物0.5 μL,加0.25 μL内标(GeneScan TM-500 LIZ1 Size Standard),9.25 μL 去离子甲酰胺(Hi-Di Formamide),混匀后加入96孔板,置于PCR仪95 ℃变性 3 min,立即冰浴5 min。利用POP-7™分离胶在ABI-3130xl自动遗传分析仪上对扩增结果进行分析。用相应的Run moduLe进行电泳,并接收荧光信号。所得光谱数据用遗传图谱4.0软件(GeneMapper 4.0 software)进行分析。
3 结果与分析
3.1 模板DNA的提取
模板DNA的制备是非常重要的一个环节,若DNA发生断裂,酶切结果显然不能代表真实的DNA结构,实验数据不能反映真实的情况。本实验采用改进的蛋白酶K消化法进行三次抽提以最大限度的除去杂蛋白,提取结果经过1%琼脂糖凝胶电泳检测,条带清晰明亮(图1)。经超微量分光光度计测定,各样品 A260/A280≥1.80,A260/A230≥2.0,表明样品纯度较高,蛋白质等杂质去除较干净,可以用来进行大泷六线鱼AFLP分析。
3.2 酶切时间对酶切反应的影响
基因组DNA酶切质量是决定AFLP成功与否的关键,酶切不充分,所得片段不能涵盖整个基因组导致所得多态性不真实,因此要对酶切体系进行优化。酶切时间是影响酶切质量的一个重要因素,不同实验材料因基因组的大小不同,酶切时间长短也有所差异。本试验用两个不同的样品作为模板进行酶切。酶切产物经1%琼脂糖电泳检测(图 2),随着酶切时间的延长,酶切片段越小浓度越大,酶切6 h所得片度均匀分布在500 bp以下,由于酶切片段在500 bp以下时,在AFLP反应中能被优先扩增,且扩增产物能在凝胶中很好的分离开,便于多态性的检出。因此本试验酶切时间选择6 h。

图 1 DNA琼脂糖电泳检测(1~4道均为大泷六线鱼DNA)Fig.1 Agarose gel electrophoresis of DNA
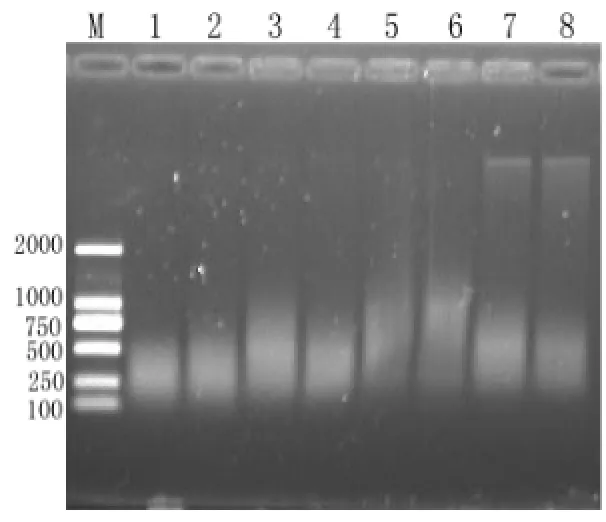
图 2 基因组双酶切电泳检测结果(M:DNA Marker;1,2: 酶切6 h;3,4:酶切4 h;5,6:酶切2 h;7,8:酶切1 h;奇数,偶数分别代表不同样品的模板)Fig.2 Result of double enzyme digestion at different reaction times
3.3 预扩增体系结果分析
预扩增的质量直接影响选择性扩增的结果,本实验设置的反应体系经1%琼脂糖凝胶电泳检测(图 3):其弥散带主要分布在100~750 bp之间,稀释后可作为选择性扩增的模板。
3.4 AFLP选择性扩增反应体系的优化
3.4.1 预扩增产物的用量对选择性扩增的影响AFLP对模板浓度要求不高,在浓度相差1000倍的范围内,得到的结果基本一致,但当模板浓度低于1×10-6μg/μL时得到的AFLP结果往往不可靠[11]。1.0 %琼脂糖凝胶电泳检测结果也显示,一定范围内,浓度对选择性扩增的结果影响不大,如图依次是以稀释5、10、20、30、50倍预扩产物作为选择性扩增的模板得到的谱带,其大小都处在500 bp以下。通过比较,本试验选择预扩增产物稀释30倍作为选择性扩增的模板。

图 3 预扩增产物电泳检测(M:Marker 1~4为不同样品的预扩增产物)Fig.3 Agarose gel electrophoresis of pre-amplification productions
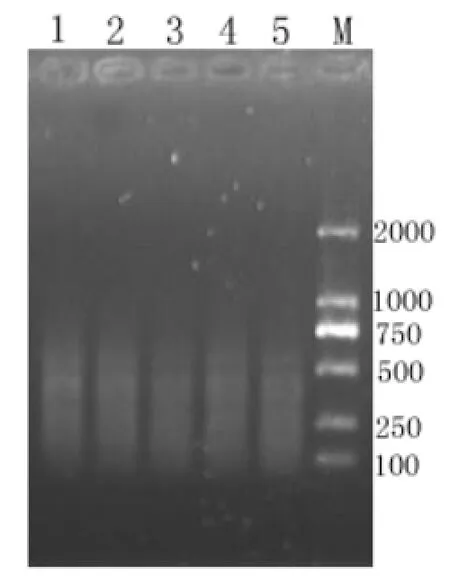
图 4 不同稀释倍数预扩增产物的选择性扩增产物电泳检测(M: Marker 1~5:分别为稀释5,10,20,30,50倍的预扩增产物为模板的选扩产物)Fig.4 Detection of the selective amplification products with different diluted templates
3.4.2 dNTPs对选择性扩增的影响 dNTPs作为扩增产物的原料对扩增效率有密切的影响, dNTPs浓度过高时会使碱基的错误掺入率增高,而过低时又会降低PCR产率,本实验的优化结果表明,dNTPs浓度为0.20 mmol/L时扩增产物清晰且稳定。
3.4.3 引物浓度对选择性扩增的影响 引物浓度对扩增效率也具有很大的影响,浓度偏高时易出现错配现象且会增加引物二聚体的合成量,而偏低时扩增出的条带少,由图可知:当引物终浓度为0.1~0.2 μmol/L时,扩增条带少不利于多态性的研究,当引物浓度为0.4~0.5 μmol/L扩增条带虽然多但非特异性条带较多影响结果的真实性,而引物浓度为0.3 μmol/L时条带较多且稳定,因此最佳引物终浓度为0.3 μmol/L。
3.4.4 Taq DNA聚合酶用量对选择性扩增的影响Taq DNA聚合酶催化PCR产物的合成,其用量过大合成效率较高但易引起错配而用量过低会降低PCR产物的合成量,因此,优化Taq DNA聚合酶用量对PCR产物的合成量非常重要。当Taq DNA聚合酶用量为0.5 U时,扩出的条带少,Taq DNA聚合酶用量为1.5~2.5 U时,非特异性条带较多,而当Taq DNA聚合酶用量为1 U时,结果较好,条带较多且稳定。所以选择 Taq DNA聚合酶用量为1 U。
3.4.5 MgCl2浓度对择性扩增的影响 MgCl2通过影响Taq DNA聚合酶的活性影响选扩结果且对引物和模板的结合及特异性也具有一定的影响[12],MgCl2浓度过高时非特异性条带较多,MgCl2浓度过小时影响Taq DNA聚合酶的活性扩出的条带少或无扩增产物,在本扩增体系选择MgCl2浓度为0.200 mol/L。
3.5 大泷六线鱼AFLP优化反应体系的验证
本研究为验证AFLP优化体系的可靠性,以E+AGG/M+CGA为选择性引物对不同的大泷六线鱼样品进行选择性扩增,扩增产物用ABI3130自动遗传分析仪进行检测(部分峰谱如图5所示)。结果表明不同样品峰谱清晰,且主要集中在100~350 bp范围内,说明优化的AFLP体系能产生较为理想的结果。
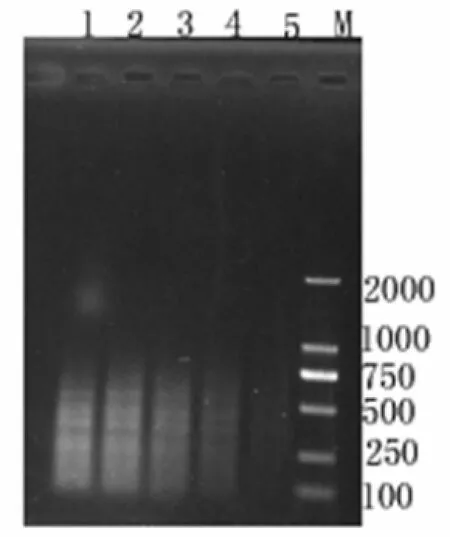
图 5 不同引物浓度的选择性扩增结果检测(M : Marker 1~5分别为引物0.5、0.4、0.3、0.2、0.1μmol/L时的选择性扩增产物)Fig.5 Detection of the selective amplification products with different primer concentrations

图 6 不同个体的毛细管电泳检测结果(1-3代表不同个体在同一选扩引物E+AGG/M+CGA下经基因图谱分析软件分析得到的电泳峰谱)Fig.6 Capillary electrophoresis of different individuals
4 讨 论
AFLP是4大分子标记(AFLP、SSR、RAPD、RFLP)中公认的最有效的分子标记技术,具有标记多态性强、鉴定灵敏度高、稳定性强、重复性高等诸多优点,是各物种遗传标记的主要应用技术。
AFLP操作过程较复杂,影响结果的因素较多,不同的材料存在差异,因此笔者针对大泷六线鱼对影响其结果的几个重要因素进行了优化以期得到真实且准确的结果。高纯度的基因组是AFLP成功的最基础条件,本研究采用改进的蛋白酶K消化法将抽提次数增加到三次,提取的基因组DNA纯度较高,各样品 A260/A280≥1.80,A260/A230≥2.0,符合AFLP技术对基因组的要求。酶切质量直接影响后续扩增的成功与否,50 μL酶切体系中2 μg模板,酶切6 h为宜。预扩反应是对限制性酶切片段的初步筛选即起到对选扩模板纯化的作用,预扩产物的质量对后续的选扩影响较大。本试验就预扩产物的稀释倍数对选扩结果的影响进行了优化,优化结果显示:一定范围内稀释倍数选扩结果影响不大。对于大泷六线鱼稀释30倍得到的选扩产物符合预期要求,选扩片度大多处在500 bp以下,亮带主要集中在100~350 bp。对选择性扩增体系的优化得到了针对大泷六线鱼的最佳体系即:预扩增产物30倍稀释液5 μL,10×PCR Buffer 2.0 μL,dNTPs(各2.5 mmol/L)1.6 μL,选择性扩增引物(10 μmol/L)各0.6 μL,Taq DNA聚合酶1 U,MgCl2(25 mmol/L)1.6 μL,加ddH20至总体积为20 μL。该体系得到的选扩产物稳定且清晰便于观察。
本研究中,采用F-AFLP(Fluorescent AFLP)分子标记技术,用荧光染料代替传统的放射性同位素来标记引物,从而得到荧光染料标记的片段,然后用先进的ABI3130遗传分析仪进行片段多态性的检测,该方法和放射性同位素及银染法技术相比,具有高灵敏度、更为快速准确、易于操作且易标准化,可获得更多的信息,且省时省力效率又高,还可以避免直接用肉眼观察造成的误差,其结果也更客观。
综上所述,本研究建立了适合大泷六线鱼基因组DNA的AFLP反应体系,为以后利用AFLP技术对大泷六线鱼进行遗传连锁图谱构建、群体遗传结构及多样性研究等方面的应用奠定了基础,以及对其他鱼类的相关研究具有借鉴意义。
[1]唐启升, 叶懋中.山东近海渔业资源开发与保护 [M].北京:农业出版社, 1990.
[2]叶青.青岛近海欧氏六线鱼食性的研究 [J].海洋湖沼通报, l992, 4: 51-54.
[3]吴立新, 秦克静, 姜志强, 等.大泷六线鱼人工育苗初步试验[J].海洋科学, 1996, 4: 32-34.
[4]王书磊, 姜志强, 苗治欧.大连海区大泷六线鱼生物学指标的季节变化 [J].水产科学, 2005, 24(5): 1-3.
[5]Vos P, Hogers R, Bleeker M, et a1.AFLP: a new technique for DNA finger- printing [J].Nucleic Acids Research, 1995, 23(21): 4407-4414.
[6]Vantoai T T, Peng J, Martin S K S.Using AFLP markers to determine the genomic contributions of parents to populations [J].Crop Science, 1997, 37: 1370-1373.
[7]Roa A C, Maya M M, Duque M C, et a1.AFLP analysis of relationships among cassava and other Manihot speices [J].Theoretical and Applied Genetics, 1997, 95: 741-750.
[8]潘洁, 包振民, 赵洋, 等.栉孔扇贝不同地理群体的遗传多样性分析 [J].高技术通讯, 2002, 12: 78-82.
[9]Young W P, Wheller P A, Coryell V H, et al.A detailed linkage map of rainbow trout produced using doubled haploids [J].Genetics, 1998, 148: 839-850.
[10]Moore S S, Whan V, Davis G P, et al.The development and application of genetic markers for the Kuruma prawn Penaeus japonicas [J].AquacuLture, 1999, 173: 19-32.
[11]王志勇, 王艺磊, 林利民, 等.福建官井大黄鱼AFLP指纹多态性的研究 [J].中国水产科学, 2002, 9(3): 198-201.
[12]Sambrok J, David W R.分子克隆实验指南 [M].北京: 科学出版社, 1993.
Establishment and optimization of fluorescence-based AFLP markers forHexagrammos otakiis
TONG Yan-li1, LI Hai-dong1, WANG Ling2, WANG Bo3, ZHENG Ming-gang3
(1.Rizhao Polytechnic, Rizhao 276826, China; 2.Qingdao University, Qingdao 266061, China;3.The First Institute of Oceanography, Qingdao 266061, China)
In this study, we optimized the main factors influencing the results of AFLP, including the quality and concentration of the extracted DNA, reaction time of enzymes EcoRI/MseI digestion, and the concentration of Mg2+, dNTPs, selective primer and the dilute multiple of pre-amplification production were also optimized in selective amplification reaction system.Ten pairs of primers were identified from eighty-one pairs of primers by optimizing the AFLP reaction system.The result established a strong foundation for the AFLP analysis of H.otakii which provided a standardized program for studying genetic diversity of H.Otakii.
Hexagrammos otaki; fluorescence-based AFLP markers; reaction system
P735; S917
A
1001-6932(2011)06-0668-06
2010-08-19;
2011-03-07
国家海洋公益性行业科研专项(201009);国家农业科技成果转化资金项目(2009-511-208)。
仝颜丽(1989-),女,山东菏泽市人,主要从事海洋生物基因工程研究。电子邮箱:tong111222333@yeah.net。
郑明刚, 电子邮箱:zmg@fio.org.cn。
