嗜热四膜虫金属硫蛋白基因MMT2和MTT4的表达规律比较与进化模式分析
2011-12-25冯立芳
畅 悦, 冯立芳, 熊 杰, 缪 炜
(1. 中国科学院水生生物研究所 水生生物多样性与保护重点实验室,湖北 武汉 430072; 2. 浙江工商大学 食品与生物工程学院,浙江 杭州 310012; 3. 中国科学院研究生院,北京 100049)
嗜热四膜虫金属硫蛋白基因MMT2和MTT4的表达规律比较与进化模式分析
畅 悦1,3, 冯立芳1,2, 熊 杰1,3, 缪 炜1,*
(1. 中国科学院水生生物研究所 水生生物多样性与保护重点实验室,湖北 武汉 430072; 2. 浙江工商大学 食品与生物工程学院,浙江 杭州 310012; 3. 中国科学院研究生院,北京 100049)
多个金属硫蛋白基因异构型已在四膜虫中被鉴定, 这些异构型可分为7a和7b两个亚家族。该文利用实时荧光定量PCR技术检测了嗜热四膜虫金属硫蛋白基因MTT2和MTT4在Hg、Cu、Cd、Zn、H2O2暴露下的表达水平, 结果显示两者表达规律相似, 均为:Cu暴露下上调最高(>200倍), Hg次之, Cd、Zn上调倍数不大, H2O2有下调趋势。此表达规律明显有别于7a亚家族, 具有7b亚家族的表达特征。同种诱导物暴露下MTT4的上调表达幅度比MTT2高出数倍, 结合生物信息学分析结果, 推测可能与MTT2和MTT4上游调控元件(如AP-1、MRE等)的数量差异有关。基于MTT2和MTT4在结构和功能上的高度相似性, 推测两者可能是经近期基因复制事件产生, 并遵循基因剂量模型进化而来。
嗜热四膜虫; 金属硫蛋白基因; 实时荧光定量PCR; 表达分析; 基因复制
金属硫蛋白(metallothionein, MTs)是一类广泛分布于生物体内的超家族蛋白, 能够依靠巯基与金属离子结合形成具有光谱学特征的金属-巯基簇(metal-thiolate clusters)。MTs于1957年首次从马的肾脏皮质中被分离得到, 随后类似的生物分子在众多的真核生物物种及不同组织和细胞类型中得到鉴定。其典型特征包括:相对分子质量低(<7× 103~10×103), 具有较高的重金属离子结合率(以Zn、Cu和Cd为主), 含有18~23个高度保守的半胱氨酸(Cysteine, Cys)位点, 缺少芳香族氨基酸和组氨酸等(Coyle et al, 2002)。
MTs不仅在动物界中广泛分布, 在其他的真核生物(真菌、高等植物和原生动物)及原核微生物中也均有发现(Binz & Kagi, 1999)。由于MTs高度保守的特征和分布的广泛性, 人们推测此类蛋白在生物体内的重要代谢通路中扮演着不可缺少的角色。近几十年来, 围绕其功能展开的深入研究证实, MTs作为一类多功能蛋白参与众多不同的生物过程, 已知的有:清除自由基、抗电离辐射(Dabrio et al, 2002); 重金属解毒(Liu & Klaassen, 1996); 参与微量元素的代谢(Coyle et al, 2009); 参与机体应激反应、增强对抗不良状态的适应能力(Colangelo et al, 2004); 影响 DNA 复制、转录及蛋白质的合成(Ostrakhovitch et al, 2006); 抗细胞凋亡(Niu et al, 2006)等。同时, 人们开始认识到MTs的不同功能及其相对重要性是基于不同物种或组织在进化过程中所产生的特殊生理需要和物种对不断变化环境的适应结果。因此, MTs的产生、基因重复与普遍存在的体内表达等现象背后的进化原因逐渐成为研究的热点。
目前, 在单细胞原生动物中有关金属硫蛋白的研究仅见于纤毛虫类的数种四膜虫(Tetrahymena)。Piccinni et al (1994)报道, 在T. pryformis和T. pigmentosa中分离得到了首个纤毛虫镉金属硫蛋白(Cd-MT), 随后, 在T. pigmentosa中分离鉴定到了首个四膜虫铜结合金属硫蛋白基因型(Cu-MT)(Santovito et al, 2001)。通过不同金属的诱导实验证明, Cd-MT和Cu-MT具有显著不同的转录响应模式。近年来, 在T. pigmentosa、T. thermophila和T. rostrata中也陆续发现了不同的 MTs异构型(Amaro et al, 2008; Boldrin et al, 2003; Fu & Miao, 2006; Guo et al, 2008; Santovito et al, 2001; Shang et al, 2002)。根据四膜虫MTs的系统发育关系、氨基酸序列中半胱氨酸保守簇、赖氨酸与半胱氨酸保守位点的相对位置以及各异构型对Cd或Cu的不同诱导表达响应模式等四个方面的特征, 四膜虫MTs被进一步划分为7a和7b两个亚家族, 7a为Cd-MT , 7b为Cu-MT (Diaz et al, 2007)。基于不同的MTs异构型在基因内串联重复上的差异性, 推测基因复制(gene duplication)是四膜虫金属硫蛋白基因在进化过程中的一个典型特征。Boldrin et al (2003)提出现今不同四膜虫物种中分布的金属硫蛋白基因很可能是由一个祖先功能单元发生多重复制和分化事件形成的, 期间也可能伴随着片段的丢失, 但具体进化路线依然不明。
目前, 围绕四膜虫金属硫蛋白结构、功能和进化的研究工作主要集中在7a亚家族(Diaz et al, 2007; Dondero et al, 2004; Santovito et al, 2007), 而对7b亚家族成员的研究则相对较少。本文在对 7b亚家族中嗜热四膜虫(T. thermophila)MTT2(基因 ID: TTHERM_00433520)和MTT4(基因ID: TTHERM_ 00433530)基因序列分析和不同诱导物暴露下表达变化情况进行考察的基础上, 探讨了两者的功能异同和进化机制。
1 材料与方法
1.1 四膜虫的培养与胁迫处理
嗜热四膜虫 SB210株由美国加州大学圣巴巴拉分校Eduardo Orias教授惠赠。四膜虫培养基配制方法如下:2% Tryptone (Oxide)和0.1% yeast extract (Oxide)溶于双蒸水, 经103 kPa、120 ℃灭菌20 min后冷却至室温。30 ℃无菌培养细胞至平台早期后,分别用于Cu浓度梯度处理实验和不同诱导物暴露实验。Cu浓度梯度处理实验按终浓度356、500、630、783、922和 1 067 μmol/L梯度依次加入CuCl2·2H2O。不同诱导物暴露实验中, 我们选择的诱导物为HgCl2、CuCl2·2H2O、ZnCl2、CdCl2·2.5H2O和 H2O2(国药集团), 并参照相关文献报道(Nilsson, 1989)和预实验结果, 使用了不影响细胞生长率的最高处理浓度, 依次为 10、630、306、45和 200 μmol/L。对照组培养基中加入相应体积的无菌水,处理时间均为2 h。
1.2 mRNA提取与cDNA合成
吸取1 mL 步骤1.1中处理过的四膜虫, 8 000 r/min离心10 min (Beckman Instruments Inc., Fullerton, U.S.A.)富集, 参照试剂盒TRIzol Reagent (Invitrogen)操作说明提取总 RNA, 琼脂糖凝胶电泳鉴定所提RNA 质量, 经分光光度计(Malcom)测得样品OD260/280在 2.02~2.08范围内。总 RNA用 RQ1 RNase-free DNase (Promega)消化处理后, 用M-MLV逆转录酶RNase H+(TOYOBO)逆转录合成cDNA, 50 μL反应体系中包括100 U酶, 5 pmol/L Oligo_(dT)20primers (Promega), 反应步骤依照试剂说明书。
1.3 实时荧光定量PCR检测基因表达水平
PCR反应在 96孔 Chromo4型实时荧光定量PCR仪(MJ Research)上进行。MTT2和MTT4共用的正向引物为:F-5'-TCTGCAAATGTGGAACTAC TGCTGCTTG-3'。MTT2和MTT2反向引物均设计在基因3'端旁侧区, 具有很好的特异性, 序列分别为:R-5'-ACATATCTTCTCAATAAAATACATTCAATAAT-3'和 R-5'-TATATTCAATACATACTTTAGATTTGG TTAAGA-3'。PCR产物经测序验证了产物的正确性。内参为看家基因β-actin, 正向引物为:5'-TCCACGA ACTTACCTTCAACTC-3', 反向引物为:5'-GGAAC CACCAATCCAGACAG-3', GenBank no. M13939 (Cupples & Pearlman, 1986)。实时荧光定量PCR反应体系如下: 2.5 μL 10×buffer, 0.5 μL 10 mmol/L dNTP, 0.4 μmol/L引物, 1.2 μL EvaGreen (Biotium), 1 U Hot start Taq酶(天为时代), 最后加双蒸水配成25 μL PCR反应体系。反应条件如下:94 °C预变性5 min, 中间40个循环94 °C 20 s, 54 °C 30 s, 72 °C 30 s, 81°C β-actin读板1 s, 84.4 °CMTT2和MTT4读板1 s, 接着72 °C延伸10 min, 最后制作溶解曲线70~90 °C, 以0.3 °C/s速率读取数据。每个cDNA样品设置3个平行样。反应数据通过软件Opticon 2 (MJ Research)读取。MTT2和MTT4的相对表达水平由分析工具Relative Expression Software Tool计算(Pfaffl et al, 2002), 统计方法采用软件默认的ANOVA,P<0.05为有统计学意义。具体分析方法参照以往文献(Feng et al, 2007)。
1.4 MTT2与MTT4 序列分析
通过 Tetrahymena Genome Database (TGD) (http://www.ciliate.org/)的GBrowse查询两者位置信息。使用ClustalW比对MTT2和MTT4编码区序列。利用Paml44软件包(Yang, 2007)中的yn00程序, 使用Nei-Gojobori法(Nei & Gojobori, 1986)计算MTT2和MTT4的非同义替换率和同义替换率比值(Ka/Ks)。同时, 我们从MTT2和MTT4编码区上游各截取长度 1 kb的序列, 利用在线分析工具TFSearch(http://www.cbrc.jp/research/db/TFSEARC H.html)进行调控元件的预测分析, 并且根据文献中关于四膜虫MT基因重要表达调控元件MRE(metalresponsive element)(Boldrin et al, 2003)和MTCM1 (Metallothionein Conserved Motif 1)(Diaz et al, 2007)序列的保守性预测了MTT2和MTT4上游的MRE和MTCM1。
1.5 共表达基因分析
MTT2和MTT4基因表达数据来自四膜虫基因表达数据库 Tetrahymena Genome Expression Database(TGED, http://tged.ihb.ac.cn/(Xiong et al, 2011), 通过计算所有基因表达谱间的相关系数分别得到四膜虫MTT2和MTT4基因的共表达基因(相关系数>0.9) (Miao et al, 2009)。之后用Blast2GO对共表达基因进行Gene Ontology (Aury et al, 2006)基因功能注释, 通过分析和比较共表达基因及其功能注释, 推测MTT2和MTT4基因功能间的关系。
2 结 果
2.1 不同浓度Cu暴露下MTT2与MTT4表达水平的变化
在356、500、630、783、922和1 067 μmol/L 6个浓度Cu暴露下,MTT2与MTT4的表达量随着浓度的增高有着明显的变化。MTT2在356 μmol/L和 500 μmol/L浓度处理下表达量较高, 并且在500 μmol/L下达到最大值, 为对照组的237倍。随着浓度的进一步增加,MTT2的表达量呈下降趋势。MTT4表达量的变化趋势与MTT2相似, 但是变化幅度远大于MTT2。MTT4同样在500 μmol/L下达到最大值, 为对照组的1 983倍。考虑到相应的p值较大, 以及基因表达量太高导致产生的荧光信号值可能已超出仪器正确读取的范围等因素, 该具体上调倍数可能不准确, 但MTT4在Cu诱导下上调倍数明显高于MTT2是可以确定的。此规律在各个浓度下均有体现(图1)。
2.2 MTT2与MTT4不同诱导物处理下表达水平的差异
Cu处理组中MTT2和MTT4表达量分别上调219倍和 425倍, 是其他诱导物处理组的数倍。另外 Hg暴露下, 两者的表达量也有较大幅度上调,MTT4的表达量上调101倍, 高于MTT2的17倍。与前两个处理条件相比, Zn和Cd处理组中两者的表达变化幅度很小, 仅在1~3倍之间。H2O2处理组则均呈现下调的趋势(图2)。
2.3 MTT2和MTT4基因的序列分析
通过TGD的GBrowse查询可知MTT4位于MTT2上游1 391 bp处, 两者中间没有其他基因。MTT2和MTT4基因编码区长度均为327 bp, 其中只有8个碱基的差异, 导致了2个氨基酸的不同(图3)。Nei-Gojobori法计算得到两者Ka/Ks值为0.0816。

图1 不同浓度Cu暴露下MTT2和MTT4的表达水平变化Fig.1 Gene expression levels of MTT2 and MTT4 in Tetrahymena induced by Cu of serial concentrations

图2 MTT2和MTT4在Hg、Cu、Zn、Cd和H2O2分别诱导下的表达变化Fig.2 Gene expression levels of MTT2 and MTT4 induced by Hg, Cu, Zn, Cd, and H2O2, respectively
利用TFSEARCH在MTT2和MTT4上游1 kb区分别预测到了TATA-box、AP-1等多种调控元件。在MTT2上游预测到一个AP-1结合位点, 而MTT4上游共预测到3个AP-1位点。另外, 基于序列保守性的预测结果显示,MTT2上游可能存在5个金属应答元件(metal response element, MRE), 而MTT4上游可能存在3个MRE和1个与AP-1重叠的MTCM1位点(图3)。
2.4 共表达基因分析
MTT2和MTT4共表达基因的数量分别为80和 110, 其中65个基因是重叠的。有GO功能注释的基因数在MTT2中是20, 在MTT4中是25, 其中16个基因为两者共有(表1)。进一步对比这些具有GO功能注释的基因在生物学过程(biological process)方面的功能描述, 发现MTT2共表达基因的115条功能描述包括了MTT4共表达基因的全部107条功能描述。两者的功能分类情况差别不大(图4), 仅发现一条MTT2特有的与信号处理相关(signal process)的功能描述。
3 讨 论
MTs在细胞内行使多种功能, 其多种异构型在多细胞生物中广泛存在, 在哺乳动物中多态性最高,所有被检测物种都拥有2种或以上数量的异构型。不同异构型在功能上有着分工, 但部分功能有可能发生重叠。在对金属的响应程度上, 不同异构型存在明显的差异(Binz & Kagi, 1999)。另外, 一些异构型在某些组织中特异表达并执行特定的功能(Kramer et al, 1996; Miles et al, 2000; Syring et al, 2000)。这些现象揭示了金属硫蛋白所涉及生物学功能的广泛程度与其多样的异构型种类存在关联。这些异构型功能上的分化程度, 其产生和进化的机制和生物学意义都是值得关注的。同样, 在单细胞生物中也有大量金属硫蛋白异构型存在。嗜热四膜虫中至今已有5个MT基因被鉴定, 异构型种类明显比其他单细胞真核生物丰富。因此, 嗜热四膜虫是研究 MT不同异构型功能分化和进化关系的理想对象。
MTT2和MTT4对Cu的响应要远远高于Cd以及其他3种诱导物; 在Hg诱导下也有一定程度的上调。尽管Zn能够普遍诱导哺乳动物中的MT基因的高表达(Kagi, 1993),MTT2和MTT4在其暴露下表达水平却没有明显的提升。而在 H2O2暴露下两者表达量稍有下降。这些现象与以往报道中 7a亚家族成员的表达情况有着明显差异。7a亚家族成员在Cd诱导下表达量均要高于Cu(Boldrin et al, 2003; Diaz et al, 2007; Fu & Miao, 2006; Piccinni et al, 1999), 在Zn诱导下也能够有较高程度的上调(Diaz et al, 2007; Fu & Miao, 2006), 同时MTT1被报道在H2O2暴露下表达水平大幅提高(Dondero et al, 2004),而7b亚家族中的MTT2和TpigMT-2则对Cu响应远高于Cd(Boldrin et al, 2003)。MTT2和MTT4对诱导物响应情况与以往报道相符, 呈现出 7b亚家族的特征, 同时与7a亚家族存在明显的区别, 验证了四膜虫中MT异构型存在明显的功能分化。值得注意的是, 尽管对不同诱导物响应的程度不同, 但MTT2和MTT4对这些诱导物的响应趋势完全一致,说明它们可能在胁迫条件下行使相似的功能。

图3 MTT2和MTT4序列及预测调控元件Fig.3 Sequences of MTT2 and MTT4 with the predicted regulatory elements
考虑到两者对诱导物的响应程度不同可能是由编码区上游调控序列的差异造成的, 我们截取MTT2和MTT4编码区上游1 kb长度的序列进行了调控元件预测, 所得重要元件被标记在图3中。其中MRE是MT基因5'端旁侧序列中普遍存在的调控元件(Stuart et al, 1985; Thiele, 1992), 能够被金属响应转录因子 MTF-1接合进而激活下游基因转录活性(Haq et al, 2003)。四膜虫MT基因上游预测有多个MRE拷贝存在(Boldrin et al, 2008; Diaz et al, 2007), 但是未发现MTF-1的同源基因(Diaz et al, 2007)。Boldrin et al (2003)分析了四膜虫中MRE的保守序列和位置特点, 以此为依据, 我们在MTT4上游预测到3个MRE, 在MTT2上游预测到5个。多个拷贝的 MRE之间存在共同作用, 并且拷贝数被认为与转录活性相关(Imbert et al, 1990)。因此,MTT2和MTT4上游多个拷贝MRE的存在可能是两者在Cu暴露下表达倍数能够显著提高的重要条件
之一。另一方面, MTCM1是在四膜虫MT基因7a亚家族中发现的一段保守基序, 被推测参与转录因子发生协同作用进而产生特异性响应(Diaz et al, 2007)。MTCM1保守序列(TGANTCA)在T. thermophila和T. pryformis中的7a亚家族成员中高度保守, 因与 AP-1结合存在序列上的重合而被认为与 AP-1存在联系(Shaulian & Karin, 2002), 而AP-1是真核生物重要的转录调控因子之一, 在酵母中被报道与重金属抗性密切相关(Wu et al, 1993)。我们在MTT4上游预测到了3个AP-1结合位点, 其中 1个与 MTCM1保守序列重合。而在MTT2上游仅有 1个 AP-1接合位点, 未发现MTCM1。因此, 上游AP-1结合位点的数量不同可能是引起MTT2和MTT4对重金属响应程度差异的主要原因。
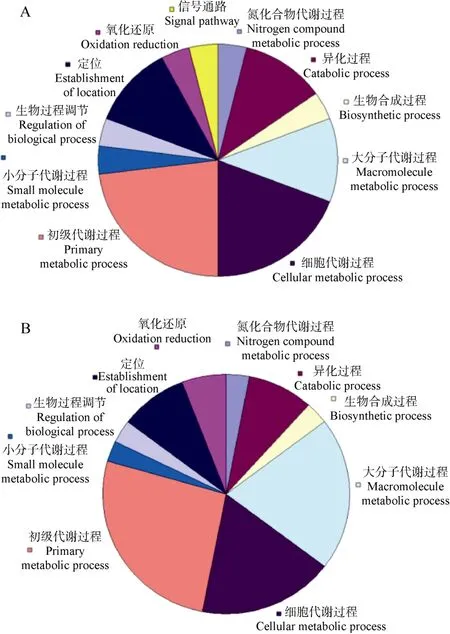
图4 MTT2和MTT4共表达基因的功能注释分类情况,按照生物学过程第三级描述绘制Fig. 4 Function classification of MTT2 and MTT4 according to description of level 3 in biological process
MTs除了在异常状态下对机体起保护作用, 也参与多种正常生理过程, 如微量元素代谢、个体发育和细胞分化过程等(Coyle et al, 2009)。MTT2和MTT4在三种生理状态 20个阶段的表达模式一致,仅表达量有些许差异, 并且在普通生理时期(生长、接合)表达量较高, 说明两者除了在胁迫条件下发生作用外, 也在四膜虫正常生理活动中起重要作用。GO功能注释显示,MTT2和MTT4共表达基因的功能繁多但分类相似, 如初级代谢、氧化还原等(图3)。因此,MTT2和MTT4在四膜虫正常生理状态下也可能行使相似的功能。
在核酸水平上,MTT2和MTT4的编码序列的长度完全一致, 序列一致性为 97.6%, 仅存在 8个碱基的区别。而在氨基酸水平上, 这8个碱基的不同仅导致了两者蛋白序列中两个氨基酸位点的差异。MTT2和MTT4的序列具有高度的同源性, 并且两个基因的编码核酸序列的同义替换率较小(Ks=0.0958), 说明两者极有可能是由近期的基因复制(gene duplication)所产生, 与推测的四膜虫中MTs基因的分化模式相符(Boldrin et al, 2003)。
生物体中的同源基因可能来源于全基因组的复制事件, 比如同样是原生动物的草履虫(Aury et al, 2006), 或是高等动物辐鳍鱼(Zhou et al, 2006);同源基因也有可能来自于部分基因片断的复制事件, 随后生物个体中复制所产生的基因可能会丢失,但少数在基因组中得以保留。而在基因组中保留下来需要经历复杂的过程。复制后的基因必须先在整个生物群体中得以固定, 而随后逐渐累积的突变将会决定其命运。目前已有多个经典的模型来解释复制基因的命运, 其中包括新功能化模型、亚功能化模型、假基因化模型和基因剂量模型(Innan & Kondrashov, 2010)。新功能化模型和亚功能化模型解释了复制后产生的两个基因在个体功能上的差异; 假基因化模型则解释了复制基因的去功能化;基因剂量模型则用解释了复制后产生的两个基因功能相同并在基因组中得以保留是由于基因所需剂量决定。
基因剂量模型通常可应用于三类基因, 包括介导机体与环境作用的基因、蛋白互作基因和对基因剂量有高要求的基因(如核糖体蛋白),MTT2和MTT4基因属于第一类。复制基因由于基因的剂量在基因组中保留后会受到负选择作用以保证其功能上的相似。对MTT2基因和MTT4基因的分析表明, 其非同义替换率和同义替换率的比值(Ka/Ks)为 0.0816, 远远小于 1, 说明其受到了强烈的负选择。同时, 在序列上,MTT2基因和MTT4具有很高的相似性, 其所具有的上游调控元件类型一致, 仅存在数量上的差别。功能上, 尽管存在响应程度的不同(可能由上游调控元件的数量导致),MTT2基因和MTT4基因在对不同诱导物处理条件下的表达趋势非常相似; 基因芯片的结果显示MTT2基因和MTT4基因在嗜热四膜虫三个重要的生理和发育时期表达变化很相似, 仅存在表达量的些许差异; GO分析两者的共表达基因也表明其存在功能上的相似性(图4)。因此,MTT2和MTT4的功能高度相似。由此可见,MTT2基因和MTT4基因复制后在基因组中保留下来更符合基因剂量模型。
致谢:本实验所用嗜热四膜虫SB210株系由美国加州大学圣巴巴拉分校的 Eduardo Orias教授惠赠, 在此表示衷心感谢。
Amaro F, de Lucas MD, Martin-Gonzalez A, Gutierrez JC. 2008. Two new members of theTetrahymenamulti-stress-inducible metallothionein family: Characterization and expression analysis ofT.rostrataCd/Cu metallothionein genes [J].Gene, 423(1): 85-91.
Aury JM, Jaillon O, Duret L, Noel B, Jubin C, Porcel BM, Segurens B, Daubin V, Anthouard V, Aiach N, Arnaiz O, Billaut A, Beisson J, Blanc I, Bouhouche K, Camara F, Duharcourt S, Guigo R, Gogendeau D, Katinka M, Keller AM, Kissmehl R, Klotz C, Koll F, Le Mouel A, Lepere G, Malinsky S, Nowacki M, Nowak JK, Plattner H, Poulain J, Ruiz F, Serrano V, Zagulski M, Dessen P, Betermier M, Weissenbach J, Scarpelli C, Schachter V, Sperling L, Meyer E, Cohen J, Wincker P. 2006. Global trends of whole-genome duplications revealed by the ciliateParamecium tetraurelia[J].Nature, 444(7116): 171-178.
Binz PA, Kagi JHR. 1999. Metallothionein: Molecular Evolution and Classification [M]//Klaassen CD. Metallothionein IV. Basel: Birkhauser Verlag, 7-13.
Boldrin F, Santovito G, Formigari A, Bisharyan Y, Cassidy-Hanley D, Clark TG, Piccinni E. 2008.MTT2, a copper-inducible metallothionein gene fromTetrahymena thermophila[J].Comp Biochem Phys C, 147(2): 232-240.
Boldrin F, Santovito G, Negrisolo E, Piccinni E. 2003. Cloning and sequencing of four new metallothionein genes fromTetrahymena thermophilaandT. pigmentosa: Evolutionary relationships inTetrahymenaMT family [J].Protist, 154(3-4): 431-442.
Colangelo D, Mahboobi H, Viarengo A, Osella D. 2004. Protective effect of metallothioneins against oxidative stress evaluated on wildtype and MT-null cell lines by means of flow cytometry [J].Biometals, 17(4): 365-370.
Coyle P, Martin SA, Carey LC, Summers BL, Rofe AM. 2009. Ethanol-mediated fetal dysmorphology and its relationship to the ontogeny of maternal liver metallothionein [J].Alcohol Clin Exp Res, 33(6): 1051-1058.
Coyle P, Philcox JC, Carey LC, Rofe AM. 2002. Metallothionein: The multipurpose protein [J].Cell Mol Life Sci, 59(4): 627-647.
Cupples CG, Pearlman RE. 1986. Isolation and characterization of the actin gene fromTetrahymena thermophila[J].Proc Natl Acad Sci USA, 83(14): 5160-5164.
Dabrio M, Rodriguez AR, Bordin G, Bebianno MJ, De Ley M, Sestakova I, Vasak M, Nordberg M. 2002. Recent developments in quantification methods for metallothionein [J].J Inorg Biochem, 88(2): 123-134.
Diaz S, Amaro F, Rico D, Campos V, Benitez L, Martin-Gonzalez A, Hamilton EP, Orias E, Gutierrez JC. 2007.Tetrahymenametallothioneins fall into two discrete subfamilies [J].PLoS One, 2(3): e291.
Dondero F, Cavaletto M, Ghezzi AR, La Terza A, Banni M, Viarengo A. 2004. Biochemical characterization and quantitative gene expression analysis of the multi-stress inducible metallothionein fromTetrahymena thermophila[J].Protist, 155(2): 157-168.
Feng L, Miao W, Wu Y. 2007. Differentially expressedgenes ofTetrahymena thermophilain response to Tributyltin (TBT) identified by suppression subtractive hybridization and real time quantitative PCR [J].Aquat Toxic, 81(1): 99-105.
Fu CJ, Miao W. 2006. Cloning and characterization of a new multi-stress inducible metallothionein gene inTetrahymena pyriformis[J].Protist, 157(2): 193-203.
Guo LN, Fu CJ, Miao W. 2008. Cloning, characterization, and gene expression analysis of a novel cadmium metallothionein gene inTetrahymena pigmentosa[J].Gene, 423(1): 29-35.
Haq F, Mahoney M, Koropatnick J. 2003. Signaling events for metallothionein induction [J].Mutat Res, 533(1-2): 211-226.
Imbert J, Culotta V, Furst P, Gedamu L, Hamer D. 1990. Regulation of metallothionein gene transcription by metals [J].Adv Inorg Biochem, 8: 139-164.
Innan H, Kondrashov F. 2010. The Evolution of gene duplications: Classifying and distinguishing between models [J].Nat Rev Genet, 11(2): 97-108.
Kagi JHR. 1993. Evolution, Structure and Chemical Activity of Class-I Metallothioneins - an Overview [M]//Suzuki KT, Imura N, Kimura M. Metallothionein III - Biological Roles and Medical Implications. Basel: Birkhauser Verlag, 29-55.
Kramer KK, Liu J, Choudhuri S, Klaassen CD. 1996. Induction of metallothionein mrna and protein in murine astrocyte cultures [J].Toxicol Appl Pharm, 136(1): 94-100.
Liu J, Klaassen CD. 1996. Absorption and distribution of cadmium in metallothionein-I transgenic mice [J].Fund Appl Toxicol, 29(2): 294-300.
Miao W, Xiong J, Bowen J, Wang W, Liu YF, Braguinets O, Grigull J, Pearlman RE, Orias E, Gorovsky MA. 2009. Microarray analyses of gene expression during theTetrahymena thermophilalife cycle [J].PLoS One, 4(2): e4429.
Miles AT, Hawksworth GM, Beattie JH, Rodilla V. 2000. Induction, regulation, degradation, and biological significance of mammalian metallothioneins [J].Crit Rev Biochem Mol, 35(1): 35-70.
Nei M, Gojobori T. 1986. Simple methods for estimating the numbers of synonymous and nonsynonymous nucleotidesubstitutions [J].Mol Biol Evol, 3(5): 418-426.
Nilsson JR. 1989. Tetrahymena in cytotoxicology - with special reference to effects of heavy-metals and selected drugs [J].Eur J Protistol, 25(1): 2-25.
Niu J, Azfer A, Kolattukudy PE. 2006. Monocyte-specific Bcl-2 expression attenuates inflammation and heart failure in monocyte chemoattractant protein-1 (MCP-1)-iduced cardiomyopathy [J].Cardiovasc Res, 71(1): 139-148.
Ostrakhovitch EA, Olsson PE, Jiang S, Cherian MG. 2006. Interaction of metallothionein with tumor suppressor P53 protein [J].FEBS Lett, 580(5): 1235-1238.
Pfaffl MW, Horgan GW, Dempfle L. 2002. Relative expression software tool (Rest (C)) for group-wise comparison and statistical analysis of relative expression results in real-time PCR [J].Nucleic Acids Res, 30(9): e36.
Piccinni E, Bertaggia D, Santovito G, Miceli C, Kraev A. 1999. Cadmium metallothionein gene ofTetrahymena pyriformis[J].Gene, 234(1): 51-59.
Piccinni E, Staudenmann W, Albergoni V, Degabrieli R, James P. 1994. Purification and primary structure of metallothioneins induced by cadmium in the protistsTetrahymena pigmentosaandTetrahymena pyriformis[J].Eur J Biochem, 226(3): 853-859.
Santovito G, Formigari A, Boldrin F, Piccinni E. 2007. Molecular and functional evolution of tetrahymena metallothioneins: New insights into the gene family ofTetrahymena thermophila[J].Comp Biochem Phys C, 144(4): 391-397.
Santovito G, Irato P, Palermo S, Boldrin F, Hunziker P, Piccinni E. 2001. Identification, cloning and characterisation of a novel copper-metallothionein inTetrahymena pigmentosa. Sequencing of cDNA and expression [J].Protist, 152(3): 219-229.
Shang YH, Song XY, Bowen J, Corstanje R, Gao Y, Gaertig J, Gorovsky MA. 2002. A robust inducible-repressible promoter greatly facilitates gene knockouts, conditional expression, and overexpression of homologous and heterologous genes inTetrahymena thermophila[J].Proc Natl Acad Sci USA, 99(6): 3734-3739.
Shaulian E, Karin M. 2002. AP-1 as a regulator of cell life and death [J].Nat Cell Biol, 4(5): e131-e136.
Stuart GW, Searle PF, Palmiter RD. 1985. Identification of multiple metal regulatory elements in mouse metallothionein-I promoter by assaying synthetic sequences [J].Nature, 317(6040): 828-831.
Syring RA, Brouwer TH, Brouwer M. 2000. Cloning and sequencing of cdnas encoding for a novel copper-specific metallothionein and two cadmium-inducible metallothioneins from the blue crabCallinectes Sapidus[J].Comp Biochem Physiol C: Pharm Toxic Endocrin, 125(3): 325-332.
Thiele DJ. 1992. Metal-regulated transcription in eukaryotes [J].Nucleic Acids Res, 20(6): 1183-1191.
Wu AL, Wemmie JA, Edgington NP, Goebl M, Guevara JL, Moyerowley WS. 1993. Yeast bZip proteins mediate pleiotropic drug and metal resistance [J].J Biol Chem, 268(25): 18850-18858.
Xiong J, Lu X, Lu Y, Zeng H, Yuan D, Feng L, Chang Y, Bowen J, Gorovsky M, Fu C, Miao W. 2011.Tetrahymenagene expression database (TGED): A resource of microarray data and co-expression analyses forTetrahymena[J].Sci Chn: Life Sci, 54(1): 65-67.
Yang ZH. 2007. Paml 4: Phylogenetic analysis by maximum likelihood [J].Mol Biol Evol, 24(8): 1586-1591.
Zhou L, Wang Y, Gui JF. 2006. Fish-specific genome duplication [J].Zool Res, 27(5): 525-532. [周莉, 汪洋, 桂建芳. 2006. 鱼类特异的基因组复制. 动物学研究, 27(5): 525-532.]
Function comparison and evolution analysis of metallothionein geneMTT2andMTT4inTetrahymena thermophila
CHANG Yue1,3, FENG Li-Fang1,2, XIONG Jie1,3, MIAO Wei1,*
(1. State Key Laboratory of Freshwater Ecology and Biotechnology,Institute of Hydrobiology,the Chinese Academy of Sciences,Wuhan430072,China; 2. College of Food Science and Biotechnology,Zhejiang Gongshang University,Hangzhou310035,China;3. Graduate School of the Chinese Academy of Sciences,Beijing100049,China)
Tetrahymenahas a high genetic polymorphism of metallothionein proteins. These protein isoforms can be divided into subfamilies 7a and 7b. We used real-time quantitative PCR to test the expression levels ofTetrahymena thermophilametallothionein genesMTT2andMTT4after exposure to different inducers, including Hg, Cu, Cd, Zn and H2O2. Both genes were most efficiently induced by Cu and secondly by Hg. Their expression was slightly up-regulated after exposure to Cd and Zn, but down-regulated by H2O2. The expression pattern differed from those reported in the 7a subfamily, but was consistent with 7b subfamily members. However, the induced expression level ofMTT4was much higher than that ofMTT2, which might be due to differences in their upstream regulatory elements (AP-1, MRE). The high similarities in gene structures and functions indicate thatMTT2andMTT4were generated by recent gene duplication following the dosage balance model.
Tetrahymena thermophila; Metallothionein gene; Real-time quantitative PCR; Expression analysis; Gene duplication
Q959.117; Q513
A
0254-5853-(2011)05-0476-09
10.3724/SP.J.1141.2011.05476
2011-03-01;接受日期:2011-07-13
武汉市学科带头人项目(201051730561)
∗通讯作者(Corresponding author),E-mail: miaowei@ihb.ac.cn
