温度和食物密度对两种形态型裂足臂尾轮虫(Brachionus diversicornis)生活史特征和后代形态型的影响*
2011-12-11席贻龙许丹丹葛雅丽
马 杰,席贻龙,许丹丹,葛雅丽
(安徽师范大学生命科学学院,安徽省高校生物环境与生态安全省级重点实验室,芜湖241000)
温度和食物密度对两种形态型裂足臂尾轮虫(Brachionus diversicornis)生活史特征和后代形态型的影响*
马 杰,席贻龙**,许丹丹,葛雅丽
(安徽师范大学生命科学学院,安徽省高校生物环境与生态安全省级重点实验室,芜湖241000)
运用单个体培养方法研究了温度(15℃、20℃、25℃和30℃)和斜生栅藻(Scenedesmus obliquus)密度(0.75×106、1.5 ×106、3.0 ×106和6.0 ×106cells/ml)对等棘刺型和不等棘刺型裂足臂尾轮虫(Brachionus diversicornis)的净生殖率、种群内禀增长率、世代时间、生命期望和后代混交率等生活史参数和后代形态型的影响.结果表明:各温度下,两种形态型轮虫的存活率无显著差异;除20℃外,其余三个温度下,等棘刺型轮虫的繁殖率显著高于不等棘刺型;除30℃下等棘刺型轮虫的世代时间长于不等棘刺型轮虫外,各温度下两种形态型轮虫的各生活史参数均无显著差异.各食物密度下,两种形态型轮虫的存活率、繁殖率、各生活史参数也均无显著差异.两种形态型轮虫的种群内禀增长率、世代时间和生命期望对升高的温度反应不同,但食物密度仅对等棘刺型轮虫的净生殖率和内禀增长率有显著影响.等棘刺型轮虫的净生殖率在6.0×106cells/ml食物密度下显著低于0.75×106和3.0×106cells/ml食物密度下,1.5×106cells/ml食物密度下与上述三食物密度间均无显著差异;内禀增长率在6.0×106cells/ml食物密度下显著低于3.0×106cells/ml食物密度下,但两者均与0.75×106和1.5×106cells/ml食物密度下无显著差异.在各温度和食物密度下,两种形态型轮虫都能产生等棘刺型和不等棘刺型的后代.25℃下等棘刺型轮虫所产后代中等棘刺率明显高于不等棘刺型轮虫,但各食物密度下两种形态型轮虫所产后代中等棘刺率无显著的差异.温度对等棘刺型轮虫所产后代中等棘刺率有显著的影响,但食物密度对两种形态型轮虫所产后代中等棘刺率均无显著的影响.等棘刺型轮虫所产后代中等棘刺率在15℃和25℃、20℃和30℃间分别无显著差异,但前两者显著高于后两者.
裂足臂尾轮虫;形态型;温度;食物密度;生活史特征
表型可塑性是生物有机体适应环境变化而改变其表型的能力[1],可塑性的程度和发生时机揭示了生物种群对一系列环境变化的适应性[2-5].多态性在浮游性轮虫特别是臂尾轮虫(Brachionus)和龟甲轮虫(Keratella)中广泛存在[6-8].自然水体中,萼花臂尾轮虫(B.calyciflorus)存在几种形态型[9-10],其中,由晶囊轮虫(Asplanchna)诱导产生的单一短棘刺型、两个短棘刺型和两个长棘刺型的萼花臂尾轮虫较为常见[7].野外和实验室内,龟甲轮虫的多态性也有较多的报道[6,11-12].
温度、营养状况和捕食者等环境因子均可以诱导多态性轮虫的形态发生变化,并改变其生理、生活史和行为等特征[13-15].温度对短棘刺的尾突臂尾轮虫(B.caudatus f.apsteini)的后代棘刺长短有显著的影响,而对长棘刺型的后代影响不显著;低温可诱导尾突臂尾轮虫形成后棘刺[8],或延长一些种类轮虫的后棘刺[6,16-17].捕食者的存在和低的食物密度均能够诱导臂尾轮虫和龟甲轮虫的后侧棘刺和后棘刺的延伸[7,11,18-20].在较高的食物密度下,无棘刺型的龟形龟甲轮虫(K.testudo)的种群内禀增长率大于有棘刺型的龟形龟甲轮虫,且前者在培养开始后的3-4d有较高的繁殖率和存活率[21];无棘刺型的萼花臂尾轮虫比有棘刺型的萼花臂尾轮虫有较高的种群内禀增长率[22];温度对两种形态型萼花臂尾轮虫的生活史特征和后代形态型有显著的影响[23].
裂足臂尾轮虫是典型的、栖息于浅水池塘中的浮游性轮虫;根据背甲后端左右两根棘刺长度的不同,可以把裂足臂尾轮虫分为后端棘刺不等长的不等棘刺型和后端棘刺等长的等棘刺型[24].迄今为止,有关这两种形态型间的生活史特征和后代形态型差异研究尚未见报道.因此,本文运用单个体培养方法,比较研究不同温度(15℃、20℃、25℃和30℃)和食物密度(0.75 ×106、1.5 ×106、3.0 ×106和 6.0 ×106cells/ml)下两种形态型裂足臂尾轮虫的生活史特征和后代形态型,为不同形态型轮虫的生活史对策研究积累资料.
1 材料与方法
1.1 实验材料
实验所用裂足臂尾轮虫于2009年4月中旬采自芜湖市镜湖.采样后,随机挑取等棘刺型和不等棘刺型非混交雌体,于(22±1)℃、自然光照(光照强度约130 lx)条件下进行克隆培养.轮虫培养液采用Gilbert配方[25](pH 为7.3),所用的饵料为 HB-4 培养基[26]培养的、处于指数增长期的斜生栅藻(Scenedesmus obliquus).
1.2 轮虫的预培养
实验前,将两种形态型轮虫分别进行预培养.不同温度下的预培养是将两种形态型轮虫分别置于温度为15℃、20℃、25℃和30℃,斜生栅藻密度为1.5×106cells/ml的条件下进行1周的预培养;不同食物密度下的预培养是用密度分别为0.75 ×106、1.5 ×106、3.0 ×106和6.0 ×106cells/ml的斜生栅藻作为两种形态型轮虫的食物,在22℃下进行1周的预培养.预培养过程中,每12h悬浮沉积于试管底部的藻类食物;每24h更换轮虫培养液并投喂饵料1次,同时通过去除一部分个体使得轮虫种群始终处于指数增长期.
1.3 单个体培养实验
将携带非混交卵的轮虫单个培养于带凹穴的塑料板中,培养液体积为0.5ml.每间隔4h在解剖镜下检查轮虫卵的孵化情况,取刚孵化出的幼体开始实验.实验过程中,每间隔12h观察1次(30℃下每8h观察一次),记录轮虫所产的幼体数及母体的存活情况;并移出所产幼体,在相同的条件下继续培养待其产卵后确定雌体类型和后代形态型;每间隔24h更换1次培养液并投喂藻类食物.四种温度下,各形态型轮虫的克隆数为4个(重复),轮虫克隆均使用15个龄长小于4h的个体;每种食物密度下,各形态型轮虫的克隆数为3个(重复),轮虫克隆也均使用15个个体.实验条件分别与预培养时相同,实验至全部母体死亡为止.
1.4 生活史参数及其计算方法
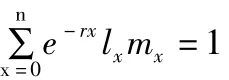
1.5 数据的处理和分析
采用SPSS统计分析软件对上述数据进行统计分析.对所得的各生活史参数进行正态分布检验后,对符合正态分布的数据进行方差分析和多重比较以揭示两种形态型轮虫各生命表统计学参数在不同温度、不同食物密度间的差异.对同一温度或同一食物密度下两种形态型轮虫的各生活史参数的差异显著性进行两独立样本t检验.运用生存分析中的Kaplan-Meier分析不同温度和食物密度下两种形态型轮虫的生存时间的差异显著性.
2 结果与分析
2.1 温度对两种形态型轮虫生活史特征和后代形态型的影响
两种形态型轮虫的存活率均随着温度的升高而显著降低(P<0.05);各温度下,两种形态型轮虫的存活率无显著差异(P>0.05)(图1).
等棘刺型轮虫的繁殖率随着温度的升高而显著升高(P<0.05),不等棘刺型轮虫的繁殖率在20℃、25℃和30℃下无显著的差异,但均显著高于15℃下(P<0.05).除20℃外,其余三个温度下,等棘刺型轮虫的繁殖率显著高于不等棘刺型(P<0.05)(图1).
两种形态型轮虫各生命表统计学参数以及后代等棘刺率之间的差异因温度的不同而异.15℃和20℃下,两种形态型轮虫的各生命表统计学参数和后代等棘刺率均无显著差异.25℃下,等棘刺型轮虫所产后代中等棘刺率明显高于不等棘刺型轮虫(P<0.05),但两种形态型轮虫的各生命表统计学参数均无显著差异.30℃下,等棘刺型轮虫的世代时间长于不等棘刺型轮虫(P<0.05),其余各生命表统计学参数和后代等棘刺率均无显著差异(表1).
温度对两种形态型轮虫的内禀增长率、世代时间和生命期望均有极显著的影响(P<0.01),对等棘刺型轮虫的后代等棘刺率影响也极显著(P<0.01).两种形态型轮虫的内禀增长率总体上均随温度的升高而增大,但等棘刺型轮虫的内禀增长率在15℃和20℃、25℃和30℃下分别无显著的差异(P>0.05),但后两者显著高于前两者;不等棘刺型轮虫的内禀增长率在15℃下显著低于25℃和30℃下,但三者均与20℃下的内禀增长率差异不显著(P>0.05).两种形态型轮虫的世代时间均随温度的升高而显著缩短,但缩短的速率也存在着差异.等棘刺型轮虫的生命期望在15℃下最长,20℃下显著长于30℃下,而25℃下与20℃和30℃下均无显著的差异;不等棘刺型轮虫的生命期望在15℃下最长,30℃下最短,20℃和25℃下居中且两者无显著差异.等棘刺型轮虫的后代等棘刺率在15℃和25℃、20℃和30℃下分别无显著的差异,但前两者显著高于后两者(表1).
双因素方差分析结果表明,温度对轮虫的内禀增长率、世代时间、生命期望和后代等棘刺率均有显著影响(P<0.05),形态型对轮虫的所有生活史参数及后代等棘刺率均无显著影响(P>0.05),温度和形态型的交互作用对轮虫的后代等棘刺率有显著影响(P<0.05).四个温度下,25℃和30℃下轮虫的内禀增长率较高,而15℃和20℃下较低;15℃下轮虫的世代时间和生命期望最长,30℃下最短;15℃下轮虫的后代等棘刺率较高,20℃和30℃下较低.
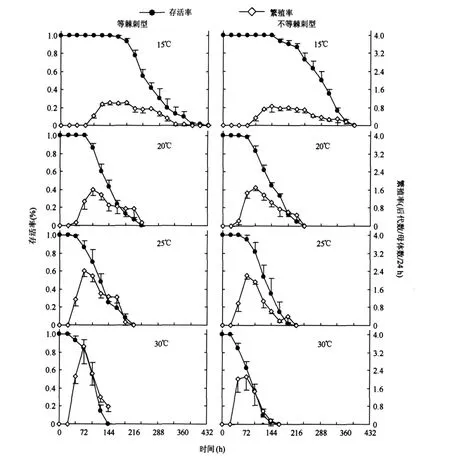
图1 四种温度下两种形态型裂足臂尾轮虫的存活率和繁殖率Fig.1 Survivorship and fecundity of two B.diversicornis morphotypes at four temperatures
2.2 食物密度对两种形态型轮虫的生活史特征和后代形态型的影响
四种食物密度处理间,0.75×106cells/ml食物密度下两种形态型轮虫的存活率均较高,3.0×106和6.0×106cells/ml的食物密度下两种形态型轮虫的存活率均较低.各食物密度下,两种形态型轮虫的存活率均无显著差异(P>0.05)(图2).
食物密度对等棘刺型轮虫的繁殖率有极显著影响(P<0.01),对不等棘刺型轮虫的繁殖率无显著影响(P >0.05).等棘刺型轮虫的繁殖率在0.75 ×106和3.0 ×106cells/ml食物密度下显著高于 1.5 ×106和 6.0×106cells/ml食物密度下.各食物密度下,两种形态型轮虫的繁殖率均无显著的差异(P>0.05)(图2).

表1 四种温度下两种形态型裂足臂尾轮虫的生活史参数和后代等棘刺率*Tab.1 Life history parameters and proportion of equal-spined offspring produced by two B.diversicornis morphotypes at four temperatures
四种食物密度下,两种形态型轮虫间的生活史参数和后代等棘刺率均无显著的差异(表2).

表2 四种食物密度下两种形态型裂足臂尾轮虫的生活史参数和后代等棘刺率*Tab.2 Life history parameters and proportion of equal-spined offspring produced by two B.diversicornis morphotypes cultured at four food densities
食物密度仅对等棘刺型轮虫的净生殖率和内禀增长率有显著影响(P<0.05).等棘刺型轮虫的净生殖率在6.0 ×106cells/ml食物密度下显著小于0.75 ×106和3.0 ×106cells/ml食物密度下,1.5 ×106cells/ml食物密度下与上述三食物密度间均无显著差异;内禀增长率在6.0×106cells/ml食物密度下显著小于3.0×106cells/ml食物密度下,但两者均与0.75×106和1.5×106cells/ml食物密度下无显著差异.

图2 四种食物密度下两种形态型裂足臂尾轮虫的存活率和繁殖率Fig.2 Survivorship and fecundity of two B.diversicornis morphotypes cultured at four food densities
双因素方差分析结果表明,食物密度对轮虫的内禀增长率有显著的影响(P<0.05),形态型对轮虫的后代等棘刺率有显著的影响(P<0.05),食物密度和形态型间的交互作用对轮虫的生活史参数和后代等棘刺率均无显著的影响.在四个食物密度下,6.0×106cells/ml食物密度下轮虫的内禀增长率较高,其它三个食物密度下较低;等棘刺型轮虫所产的后代中等棘刺率显著高于不等棘刺型.
3 讨论
3.1 不同形态型轮虫的生活史特征
作为防御捕食的器官,后(侧)棘刺的形成和生长需要消耗能量.因此,在较高的食物密度下,无棘刺型的龟形龟甲轮虫比有棘刺型的龟形龟甲轮虫在培养开始后的3-4d有较高的繁殖率和存活率[21].与其相似的是,本研究中,在3.0×106cells/ml食物密度下,等棘刺型裂足臂尾轮虫的繁殖率高于不等棘刺型.
在较高的温度(20℃-30℃)或较低的食物密度下,当萼花臂尾轮虫或龟形龟甲轮虫通过摄食所获取的能量有限或被较多地用于代谢需求时,投入生殖以及后(侧)棘刺的形成和生长的能量相对较少,因此它们的种群内禀增长率没有显著的差异;但在较低的温度(15℃)或较高的食物密度下,当上述两种轮虫通过摄食所获取的能量除了满足代谢需求外,尚有较多的能量可用于生殖以及后(侧)棘刺的形成和生长,此时后(侧)棘刺的形成和生长消耗了部分能量,由此导致无棘刺型萼花臂尾轮虫和龟形龟甲轮虫的种群内禀增长率高于双棘刺型萼花臂尾轮虫和具棘刺型龟形龟甲轮虫的种群内禀增长率[21-23].本研究中,在各温度和食物密度下,两种形态型裂足臂尾轮虫的种群内禀增长率等生活史参数均无显著差异;这可能与它们在等棘刺和不等棘刺的形成和生长过程中所消耗的能量相似有关.
已有研究结果表明,不同形态型轮虫的生活史参数对升温的响应存在着差异.当温度从20℃升高至30℃时,无后侧棘刺型萼花臂尾轮虫的平均寿命缩短的速率高于双后侧棘刺型;双后侧棘刺型萼花臂尾轮虫的净生殖率在30℃下最高,无后侧棘刺型萼花臂尾轮虫的净生殖率受温度影响不显著;当温度从15℃升高至20℃时,无后侧棘刺型萼花臂尾轮虫的种群内禀增长率下降的速率大于双后侧棘刺型[23].与上述研究结果相似,本研究发现,两种形态型裂足臂尾轮虫的内禀增长率、世代时间和生命期望对升高的温度的反应存在着差异.此外,本研究还首次发现,裂足臂尾轮虫的净生殖率和内禀增长率对升高的食物密度的反应也因形态型的不同而异;食物密度仅对等棘刺型轮虫的净生殖率和内禀增长率有显著影响.
3.2 不同形态型轮虫所产后代的形态型
不同形态型轮虫所产后代的形态型与晶囊轮虫的捕食、轮虫母体的年龄、孤雌生殖世代数和温度等有关.在没有晶囊轮虫诱导的情况下,具棘刺型龟形龟甲轮虫和螺形龟甲轮虫通常产出无后棘刺型后代;有些情况下,一些具后棘刺型的龟形龟甲轮虫也可产出短后棘刺型后代[12,21].然而,一些品系的萼花臂尾轮虫即使在没有晶囊轮虫和其他环境刺激的情况下也形成长后棘刺,后棘刺的长度取决于母体的年龄[28].由休眠卵孵出的萼花臂尾轮虫和方形臂尾轮虫(B.quadridentatus)干雌体(stem female)不形成后侧棘刺,但随着孤雌生殖世代数的增加而形成后侧棘刺[18,29-30].温度对短后棘刺型尾突臂尾轮虫的后代形态型具有显著影响,而对长后棘刺型的后代形态型无显著影响;低温可诱导短后棘刺型尾突臂尾轮虫产生后棘刺型后代[8].在15℃、20℃、25℃和30℃下,无后棘刺型和双后棘刺型的萼花臂尾轮虫均可产生无后棘刺型和双后棘刺型的后代;15℃下,双后棘刺型的萼花臂尾轮虫也可产生单后棘刺型的后代.温度对双后棘刺型萼花臂尾轮虫后代后侧棘刺的形成无显著影响,但无后棘刺型萼花臂尾轮虫在15℃下产生的具后侧棘刺后代的比例高于20℃下[37].与萼花臂尾轮虫相似,本研究中,在各温度和食物密度下,两种形态型裂足臂尾轮虫都可以产生等棘刺型和不等棘刺型后代;25℃下,等棘刺型裂足臂尾轮虫所产后代中等棘刺率明显高于不等棘刺型轮虫,但在15℃、20℃和30℃下两种形态型轮虫所产后代中等棘刺率均无显著性差异.温度对等棘刺型裂足臂尾轮虫的后代形态型有显著影响,对不等棘刺型轮虫的后代形态型无显著影响;等棘刺型轮虫的后代等棘刺率在15℃和25℃、20℃和30℃间分别无显著差异,但前两者显著高于后两者.此外,本研究还首次发现,食物密度对两种形态型裂足臂尾轮虫的后代形态型均无显著的影响.
[1]West-Eberhard MJ.Developmental Plasticity and Evolution.Oxford:Oxford University Press,2003.
[2]Hjelm J,Svanbäck R,Byström P et al.Diet-dependent body morphology and ontogenetic reaction norms in Eurasian perch.Oikos,2001,95(2):311-323.
[3]Dahl J,Peckarsky BL.Induced morphological defenses in the wild:predator effects on a mayfly,Drunella coloradensis.Ecology,2002,83(6):1620-1634.
[4]Trussell GC,Nicklin MO.Cue sensitivity,inducible defense,and trade-offs in a marine snail.Ecology,2002,83(6):1635-1647.
[5]Michimae H.Differentiated phenotypic plasticity in larvae of the cannibalistic salamander Hynobius retardatus.Behavioral Ecology and Sociobiology,2006,60(2):205-211.
[6]Xi YL,Jin HJ,Xie P et al.Morphological variation of Keratella cochlearis(Rotatoria)in a shallow,eutrophic subtropic Chinese lake.Journal of Freshwater Ecology,2002,17(3):447-454.
[7]Yin XW,Niu CJ.Polymorphism and morphotype transformations in the rotifer(Brachionus calyciflorus).Zoological Re-search,2007,28(1):68-72.
[8]Athibai S,Sanoamuang LO.Effect of temperature on fecundity,life span and morphology of long-and short-spined clones of Brachionus caudatus f.apsteini(Rotifera).International Review of Hydrobiology,2008,93(6):690-699.
[9]Koste W.Rotatoria.Die Rädertiere Mitteleuropas.(Überordnung monogononta),Bestimmungswerk begründet von Max Voigt.2 vols.Berlin:Gebrüder Borntraeger,1978.
[10]李化炳,席贻龙,程新峰等.轮虫同域性物种形成:来自萼花臂尾轮虫克隆间的分子系统发育关系和生殖隔离证据.动物学报,2008,54(2):256-264.
[11]Gilbert JJ,Stemberger RS.Asplanchna-induced polymorphism in the rotifer Keratella slacki.Limnology and Oceanography,1984,29(6):1309-1316.
[12]Stemberger RS,Gilbert JJ.Multiple-species induction of morphological defenses in the rotifer Keratella testudo.Ecology,1987,68(2):370-378.
[13]Saksena DN,Kulkarni N.Polymorphosis in a brachionid rotifer,Brachionus quadridentatus Hermann from Morar channel,Gwalior(India).Proceedings:Animal Sciences,1986,95(3):365-369.
[14]Sanoamuang LO.The effect of temperature on morphology,life history and growth rate of Filinia terminalis(Plate)and Filinia cf.pejleri Hutchinson in culture.Freshwater Biology,1993,30(2):257-267.
[15]Green J.Morphological variation of Keratella cochlearis(Gosse)in Myanmar(Burma)in relation to zooplankton community structure.Hydrobiologia,2007,593(1):5-12.
[16]Bielanñska-Grajner I.Influence of temperature on morphological variation in populations of Keratella cochlearis(Gosse)in Rybnik Reservoir.Hydrobiologia,1995,313/314(1):139-146.
[17]Diéguez M,Modenutti B,Queimaliños C.Influence of abiotic and biotic factors on morphological variation of Keratella cochlearis(Gosse)in a small Andean lake.Hydrobiologia,1998,387/388:289-294.
[18]Gilbert JJ.Spine development in Brachionus quadridentatus from an Australian billabong:genetic variation and induction by Asplanchna.Hydrobiologia,2001,446/447(1):19-28.
[19]Pavón-Meza EL,Sarma SSS,Nandini S.Combined effects of temperature,food(Chlorella vulgaris)concentration and predation(Asplanchna girodi)on the morphology of Brachionus havanaensis(Rotifera).Hydrobiologia,2007,593(1):95-101.
[20]Sarma SSS,Nandini S.Small prey size offers immunity to predation:a case study on two species of Asplanchna and three brachionid prey(Rotifera).Hydrobiologia,2007,593(1):67-76.
[21]Stemberger RS.Reproduction costs and hydrodynamic benefits of chemically induced defenses in Keratella testudo.Limnology and Oceanography,1988,33(4):593-606.
[22]Gilbert JJ.Females from resting eggs and parthenogenetic eggs in the rotifer Brachionus calyciflorus:lipid droplets,starvation resistance and reproduction.Freshwater Biology,2004,49(11):1505-1505.
[23]Xiang XL,Xi YL,Zhang JY et al.Effect of temperature on survival,reproduction and morphotype in offspring of two Brachionus calyciflorus(Rotifera)morphotypes.Journal of Freshwater Ecology,2010,25(1):9-18.
[24]王家楫.中国淡水轮虫志.北京:科学出版社,1961:77-78.
[25]Gilbert JJ.Mictic female production in rotifer Brachionus calyciflorus.Journal of Experimental Zoology,1963,153(2):113-124.
[26]章宗涉,黄祥飞.淡水浮游生物研究方法.北京:科学出版社,1991.
[27]胡 柯,席贻龙,王金霞.不同地理区域湖泊中萼花臂尾轮虫的生活史特征.湖泊科学,2010,22(4):585-590.
[28]Schröder T,Gilbert JJ.Maternal age and spine development in the rotifer Brachionus calyciflorus:increase of spine length with birth orders.Freshwater Biology,2009,54(5):1054-1065.
[29]Yin XW,Niu CJ.Polymorphism in stem females and successive parthenogenetic generations in Brachionus calyciflorus Pallas.Aquatic Ecology,2008,42(3):415-420.
[30]Gilbert JJ,Schröder T.Rotifers from diapausing,fertilized eggs:unique features and emergence.Limnology and Oceanography,2004,49(4):1341-1354.
Effects of temperature and algal density on life history characteristics and morphotype in offspring of two Brachionus diversicornis morphotypes
MA Jie,XI Yilong,XU Dandan&GE Yali
(College of Life Sciences,Anhui Normal University,Provincial Key Laboratory of Biotic Environment and Ecological Safety,Wuhu 241000,P.R.China)
Effects of temperature(15℃,20℃,25℃ and 30℃)and Scenedesmus obliquus density(0.75 ×106,1.5×106,3.0×106and 6.0 ×106cells/ml)on life history parameters including net reproductive rate,intrinsic rate of population increase,generation time,life expectancy at hatching and proportion of mictic offspring,and morphotype in offspring of two Brachionus diversicornis morphotypes were studied by means of individual culture.The results showed that at the four temperatures,the survivorship between the two B.diversicornis morphotypes was similar.The fecundities of the equal-spined rotifers at 15℃,25℃ and 30℃ were significantly higher than those of the unequal-spined rotifer.Each of the life history parameters between the two B.diversicornis morphotypes was similar,except that the generation time of the equal-spined rotifers was longer than that of the unequal-spined rotifers at 30℃.The survivorship,the fecundity and each of all the life history parameters between the two B.diversicornis morphotypes were also similar at the four food densities.All the intrinsic rate of population increased,the generation time and the life ex-pectancy at hatching of the two B.diversicornis morphotypes responded differently to increasing temperature,but food density only affected the net reproductive rate and the intrinsic rate of population increase of the equal-spined rotifers significantly.The net reproductive rate of the equal-spined rotifers at algal density of 6.0 ×106cells/ml was lower than that at both 0.75 ×106and 3.0 ×106cells/ml,and the net reproductive rate at 1.5 × 106cells/ml was similar with that at each of all the above-stated three food densities.The intrinsic rate of population increase of the equal-spined rotifers at 6.0 ×106cells/ml was lower than that at 3.0 ×106cells/ml,but both of them were similar with those at 0.75 ×106and 1.5 ×106cells/ml.At each of the four temperatures and food densities,the two B.diversicornis morphotypes produced both equal-and unequal-spined offspring.Only at 25℃,the proportion of equal-spined offspring produced by the equal-spined mothers was higher than that produced by the unequal-spined mothers.However,at each of all the four food densities,the proportion of equal-spined offspring produced by the two B.diversicornis morphotypes was similar.Temperature affected the proportion of equal-spined offspring produced by the equal-spined mothers significantly,but food density did not affect the proportion of equal-spined offspring produced by both the equal-and unequal-spined mothers.The proportions of equal-spined offspring produced by the equal-spined mothers at 15℃ and 25℃,and 20℃ and 30℃ were similar,respectively,but the former two were higher than the latter two.
Brachionus diversicornis;morphotype;temperature;algal density;life history characteristics
* 国家自然科学基金项目(30870369,30499341)、安徽省优秀青年基金项目(08040106904)、安徽省高校生物环境与生态安全省级重点实验室专项基金项目(2004sys003)和安徽省重点实验室专项基金项目联合资助.2010-09-17收稿;2010-10-19收修改稿.马杰,女,1987年生,硕士研究生;E-mail:jiema_2008@126.com.
** 通讯作者;E-mail:ylxi1965@yahoo.com.cn.
