高铁酸钾氧化降解水中的苯酚
2011-12-08黄先锋冉治霖陈文明张永祥苑宝玲姜成春
黄先锋,冉治霖,陈文明,张永祥,苑宝玲,姜成春
(1.福建师范大学 闽南科技学院,福建 泉州 362332;2.深圳信息职业技术学院 计算机应用系,广东 深圳 518029;3.福州大学 土木工程学院,福建 福州 350108;4.深圳职业技术学院 建筑与环境工程系,广东 深圳 518055)
高铁酸钾氧化降解水中的苯酚
黄先锋1,冉治霖2,陈文明1,张永祥1,苑宝玲3,姜成春4
(1.福建师范大学 闽南科技学院,福建 泉州 362332;2.深圳信息职业技术学院 计算机应用系,广东 深圳 518029;3.福州大学 土木工程学院,福建 福州 350108;4.深圳职业技术学院 建筑与环境工程系,广东 深圳 518055)
以自制的固体K2FeO4作为氧化剂对水中的苯酚进行氧化降解。在苯酚初始浓度为0.10 mmol/L、溶液pH为9、反应时间为30 min、n(K2FeO4)∶n(苯酚)为15的条件下,苯酚去除率可达99.8%。反应过程中,K2FeO4的强氧化作用与其产物Fe(OH)3的絮凝作用产生协同效应,提高了苯酚的降解效果。表观反应动力学研究结果表明K2FeO4与苯酚的反应符合二级反应动力学原理。
高铁酸钾;苯酚;氧化;降解;二级反应动力学;废水处理
苯酚是工业废水中典型的难降解污染物,具有致癌、致畸、致突变等潜在危害,可通过空气或水进行长、短距离输送,参与地球各圈层的循环,对土壤、地表水、地下水、生物体等介质造成污染,进而危及生态系统和人体健康。美国环境保护署和中国环境保护部均将其列入优先控制污染物黑名单中。目前苯酚废水的处理方法主要有生物法[1]、吸附法[2]、光催化氧化法[3]、电催化氧化法[4]、Fenton试剂氧化法[5]和化学氧化法[6]等,其中化学氧化法因操作简单、成本低、效率高等特点应用最为广泛。K2FeO4是近年来备受关注的新型高效强氧化剂,与其他氧化剂相比,它具有氧化还原电位高、絮凝助凝作用强、反应产物无毒等优势,因而已被用于
As3+[7]、硫化氢[8]、氰化物[9]、氨[10]、胺[11]、硝基苯[12]、表面活性剂[13]、双酚 A[14]等无机和有机污染物的氧化降解研究。
本工作以K2FeO4为氧化剂对水中的苯酚进行降解实验,考察了反应时间、n(K2FeO4)∶n(苯酚)、溶液pH对苯酚降解效果的影响,并系统研究了K2FeO4与苯酚作用的表观动力学。
1 实验方法
1.1 试剂和仪器
实验用试剂均为分析纯。K2FeO4采用次氯酸盐氧化法制备[15],纯度大于95%。
PHS-3C型精密pH计:上海雷磁仪器厂;95-1型磁力搅拌器:上海轧艮仪器设备有限公司;T6型新世纪紫外-可见分光光度计:上海沪粤明科学仪器有限公司;Waters2695型高效液相色谱仪:流动相V(甲醇)∶V(水)为50 ∶50,流量1 mL/min,波长 269 nm,进样量 50 μL,Symmetry C18色谱柱(250 mm ×4 mm ×5 μm),美国 Waters公司。
1.2 实验方法
将一定量的苯酚溶液用稀盐酸和氢氧化钠溶液调节pH后,在磁力搅拌的条件下,加入一定量的K2FeO4固体,K2FeO4迅速溶解。反应一定时间后,用过量的亚硫酸钠溶液终止反应。反应液经0.22 μm滤膜过滤后,取样进行分析。
1.3 分析方法
采用高效液相色谱仪测定苯酚浓度。
2 结果与讨论
2.1 反应时间对苯酚去除率的影响
在苯酚初始浓度为0.10 mmol/L、溶液pH为9、n(K2FeO4)∶n(苯酚)为10的条件下,反应时间对苯酚去除率的影响见图1。
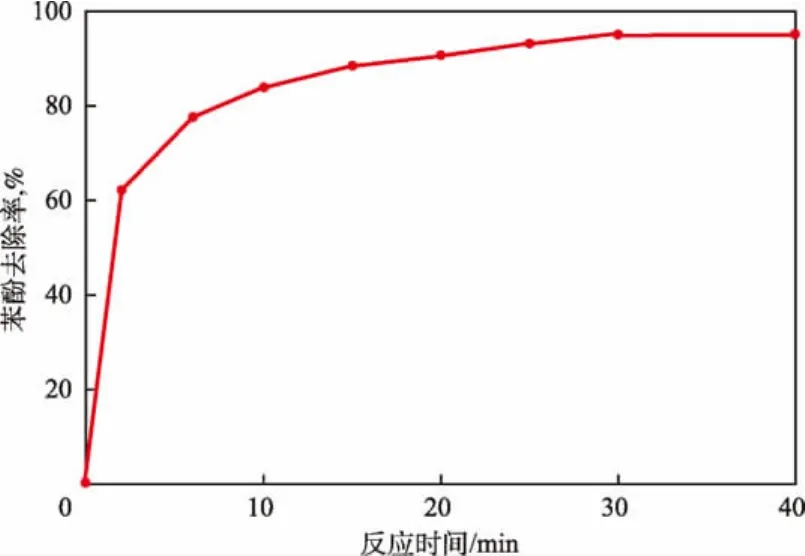
图1 反应时间对苯酚去除率的影响
由图1可见:随反应时间的延长,K2FeO4对苯酚的去除率先迅速增加后趋于平缓;当反应时间为10 min时,苯酚去除率为84.1%;当反应时间超过10 min后,苯酚去除率增加缓慢,30 min时苯酚去除率为94.9%;继续延长反应时间,苯酚去除率趋于稳定。这主要是因为在反应初始阶段,K2FeO4浓度较高,对苯酚的氧化速率较大,苯酚去除率迅速增加,同时反应产物Fe3+发生水解形成的Fe(OH)3对苯酚起到了絮凝作用。因此,在反应初始阶段K2FeO4对苯酚的迅速降解是氧化和絮凝协同作用的结果。随着反应的进行,K2FeO4不断被分解,反应10 min时反应液中的K2FeO4已基本分解完全,此后溶液中苯酚的降解主要依靠Fe(OH)3的絮凝作用。因此,反应10 min后,溶液中苯酚的降解渐缓。实验确定最佳反应时间为30 min。
2.2 溶液pH对苯酚去除率的影响
在苯酚初始浓度为0.10 mmol/L、反应时间为30 min、n(K2FeO4)∶n(苯酚)为 10 的条件下,溶液pH对苯酚去除率的影响见图2。由图2可见:随溶液pH的增加,苯酚去除率先增加后降低;当溶液pH小于9时,随溶液pH的升高,苯酚去除率明显上升;当溶液pH大于10时,苯酚去除率呈下降的趋势。溶液pH与K2FeO4的氧化能力和稳定性密切相关[16]。在酸性介质中,虽然 K2FeO4的氧化能力强,其氧化还原电位为2.20 V,但非常不稳定,迅速分解为Fe3+并放出O2。这主要是因为在酸性条件下,K2FeO4分子由于质子化作用而发生结构重整,在分子内发生氧化还原反应并在瞬间内完成[13];而在碱性条件下,虽然K2FeO4的氧化能力减弱,其氧化还原电位仅为0.72 V,但其稳定性增强,分解速率慢,从而延长了K2FeO4对苯酚的氧化时间,在一定程度上弥补了因氧化还原电位降低而造成的氧化能力削弱。另一方面,溶液pH决定了苯酚的解离程度,溶液pH的增加导致苯酚的解离程度增强。研究表明解离产物更容易被氧化[17]。综合上述,K2FeO4氧化降解苯酚的最佳溶液pH为9。

图2 溶液pH对苯酚去除率的影响
2.3 n(K2FeO4)∶n(苯酚)对苯酚去除率的影响
在苯酚初始浓度为0.10 mmol/L、溶液pH为9、反应时间为30 min的条件下,n(K2FeO4)∶n(苯酚)对苯酚去除率的影响见图3。由图3可见:随n(K2FeO4)∶n(苯酚)的增加,苯酚去除率逐渐增加;当n(K2FeO4)∶n(苯酚)为2时,苯酚去除率仅为36.5%;当 n(K2FeO4)∶n(苯酚)为 10 时,苯酚去除率可达94.8%;继续增加 n(K2FeO4)∶n(苯酚),苯酚去除率增势趋缓;当 n(K2FeO4)∶n(苯酚)为15时,苯酚去除率达99.8%。

图3 n(K2FeO4)∶n(苯酚)对苯酚去除率的影响
2.4 K2FeO4氧化降解水中苯酚的动力学
采用初始浓度法[18],在溶液pH为9的条件下,分别固定K2FeO4初始浓度(c0(K2FeO4),mmol/L)和苯酚初始浓度(c0(苯酚),mmol/L),测定不同反应时间下的苯酚浓度,计算初始反应速率(v0,mmol/(L·s))和反应级数。
假定K2FeO4氧化苯酚的基本动力学方程为:

式中:v为反应速率,mmol/(L·s);c(苯酚)为苯酚浓度,mmol/L;c(K2FeO4)为 K2FeO4浓度,mmol/L;m和n为反应级数;k为反应速率常数,mmol1-m-n/(Lm+n-1·s)。
固定K2FeO4浓度,方程(1)可表示为:

固定K2FeO4初始浓度为1 mmol/L,不同苯酚初始浓度条件下苯酚浓度随反应时间的变化见图4。利用多项回归得到与图中曲线对应的方程,在t=0时对各曲线方程求导,得出不同苯酚初始浓度条件下的初始反应速率v0。lgv0与lgc0(苯酚)的关系见图5。由图5得出直线斜率为1.071,近似等于1。因此可认为K2FeO4氧化去除苯酚的反应对于苯酚为一级反应,即反应级数m=1。因此,式(1)可表示为:

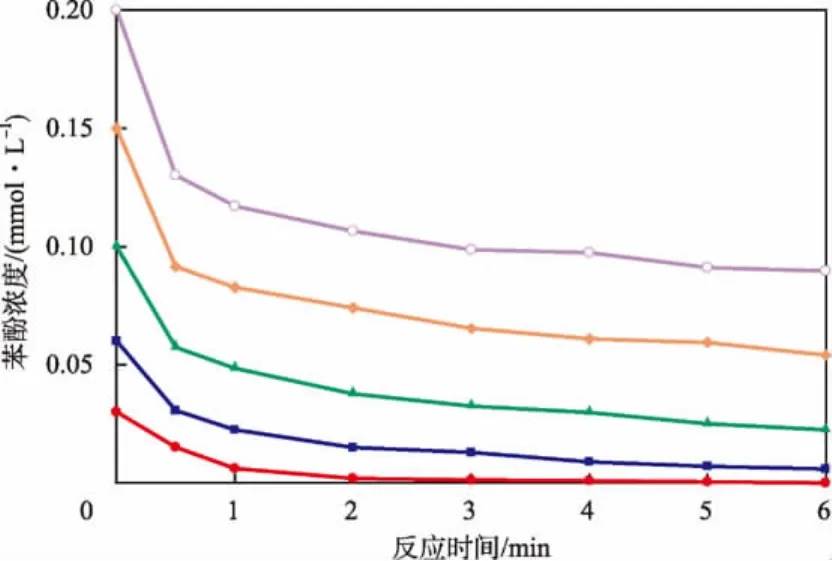
图4 不同苯酚初始浓度条件下苯酚浓度随反应时间的变化
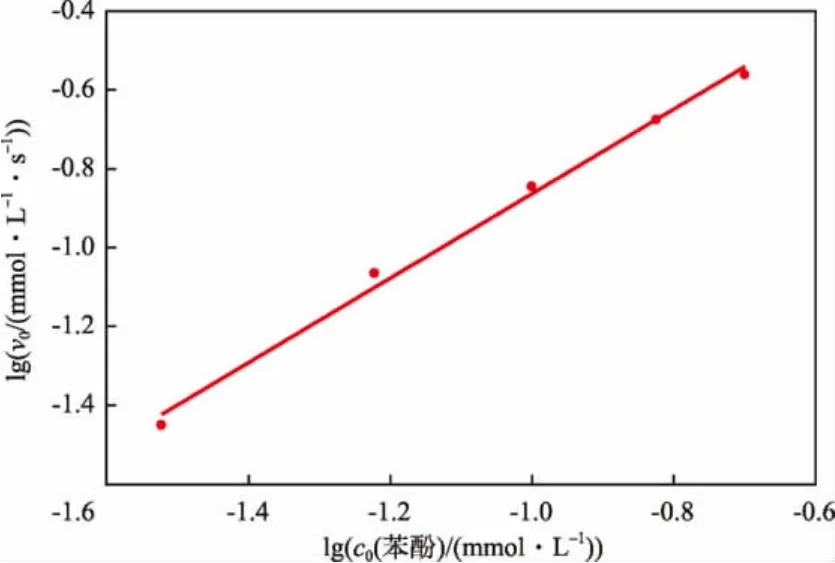
图5 lgv0与lg c0(苯酚)的关系
式(4)可变形为:
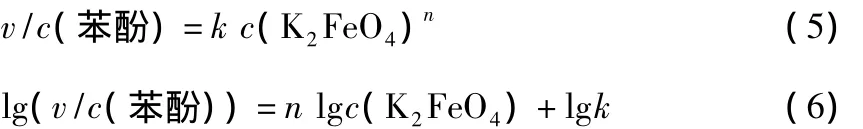
同理,固定苯酚的初始浓度为0.05 mmol/L,不同K2FeO4初始浓度条件下苯酚浓度随反应时间的变化见图6。

图6 不同K2FeO4初始浓度条件下苯酚浓度随反应时间的变化
由图6求出不同K2FeO4初始浓度条件下的苯酚初始反应速率 v0。lg(v0/c0(苯酚))与 lgc0(K2FeO4)的关系见图7。由图7求出直线斜率为1.087,近似等于1。因此可认为 K2FeO4氧化去除苯酚的反应对 K2FeO4为一级反应,即反应级数n=1。
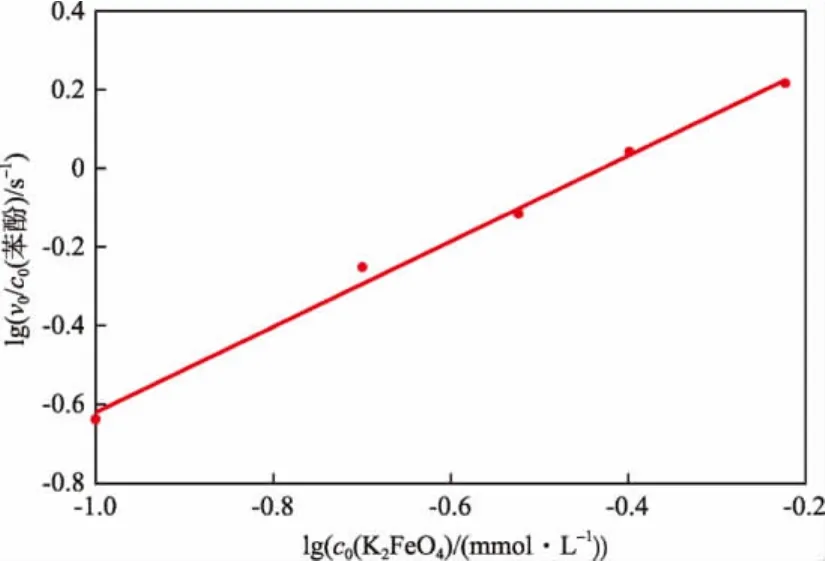
图7 lg(v0/c0(苯酚))与lgc0(K2FeO4)的关系
综上所述,K2FeO4氧化苯酚过程可近似为二级动力学反应,动力学反应方程式可表示为:

3 结论
a)以K2FeO4为氧化剂对苯酚溶液进行降解。在苯酚初始浓度为0.10 mmol/L、溶液pH为9、反应时间为30 min、n(K2FeO4)∶n(苯酚)为15的条件下,苯酚去除率可达99.8%。
b)K2FeO4对苯酚的氧化降解是K2FeO4的强氧化性与产物Fe(OH)3的絮凝性协同作用的结果。
c)采用初始浓度法,在溶液pH为9的条件下,分别固定K2FeO4和苯酚的浓度,测定初始反应速率v0与反应级数。实验结果表明:K2FeO4氧化去除苯酚的反应对苯酚和 K2FeO4均为一级反应;因此K2FeO4氧化苯酚的过程可近似为二级动力学反应,动力学反应方程式为v=k c(苯酚)c(K2FeO4)。
[1] 李华,刘永军,刘金光.固定化Acinetobacter sp.XA05和 Sphingom sp.FG03降解苯酚[J].化工环保,2010,30(1):12-15.
[2] 胡学伟,李爱民,范俊,等.选择性吸附-高效生物降解法处理含硝基苯与苯酚混合废水[J].化工环保,2007,27(6):497 -500.
[3] 武正簧,李民,徐彦龙.半导体光催化效应降解苯酚研究[J].太原理工大学学报,1999,30(6):655 -657.
[4] 李成天,朱审林.电催化氧化技术处理苯酚废水[J].电化学,2005,11(1):101 -103.
[5] 雷乐成,何锋.均相Fenton氧化降解苯酚废水的反应机理探讨[J].化工学报,2003,54(11):1592-1597.
[6] 张锦,李圭白,陈忠林,等.氯与高锰酸钾复合药剂对水中苯酚及氯酚的去除效果[J].环境化学,2002,21(1):73-77.
[7] 张海燕,张盼月,曾光明,等.高铁酸钾预氧化-三氯化铁混凝去除水中 As3+[J].化工环保,2008,28(6):495-499.
[8] Sharma V K,Smith J O,Milero F J.Ferrate(Ⅵ)oxidation of hydrogen sulfide[J].Environ Sci Technol,1997,31(9):2486-2491.
[9] Sharma V K,Rivera W,Smith J O,et al.Ferrate(Ⅵ)oxidation of aqueous cyanide[J].Environ Sci Technol,1998,32(17):2608 -2613.
[10] Jiang Jiaqian.Research progress in the use of ferrate(Ⅵ)for the environmental remediation[J].J Hazard Mater,2007,146(3):617 -623.
[11] Jiang Jiaqian,Lloyd B.Progress in the development and use of ferrate(Ⅵ)salt as an oxidant and coagulant for water and wastewater treatment[J].Water Res,2002,36(6):1397 -1408.
[12] 吴小情,董娟,汪永辉.高铁酸钾氧化降解硝基苯水溶液[J].环境化学,2009,28(6):8183 -8187.
[13] 杨卫华,王鸿辉,曾晓旭,等.高铁酸钾处理水中十六烷基三甲基溴化铵[J].环境科学,2009,30(8):2277-2281.
[14] Li Cong,Li Xiangzhong,Graham N,et al.The aqueous degradation of bisphenol A and steroid estrogens by ferrate[J].Water Res,2008,42(1 -2):109 -120.
[15] 黄先锋,王世超,陈文明,等.高铁酸钾制备过程中废碱液的回收利用[J].化工环保,2010,30(5):423-426.
[16] 罗志勇,郑泽根,张胜涛.高铁酸盐氧化降解水中苯酚的动力学及机理研究[J].环境工程学报,2009,3(8):1375-1378.
[17] Graham N,Jiang Chengchun,Li Xiangzhong,et al.The influence of pH on the degradation of phenol and chlorophenols by potassium ferrate[J].Chemosphere,2004,56(10):949-956.
[18] 曲久辉,林谡,田宝珍,等.高铁氧化去除饮用水中邻氯苯酚的研究[J].环境科学学报,2001,21(6):701-704.
Oxidative Degradation of Phenol in Water with Potassium Ferrate
Huang Xianfeng1,Ran Zhilin2,Chen Wenming1,Zhang Yongxiang1,Yuan Baoling3,Jiang Chengchun4
(1.Minnan School of Science and Technology,Fujian Normal University,Quanzhou Fujian 362332,China;
2.Department of Computer Application,Shenzhen Institute of Information Technology,Shenzhen Guangdong 518029,China;
3.College of Civil Engineering,Fuzhou University,Fuzhou Fujian 350108,China;
4.Department of Construction and Environmental Engineering,Shenzhen Polytechnic,Shenzhen Guangdong 518055,China)
Phenol in water was oxidized with self-made solid K2FeO4as oxidant.Under the conditions of initial phenol concentration 0.10 mmol/L,solution pH 9,reaction time 30 min,n(K2FeO4)∶n(phenol)=15,the phenol removal rate is 99.8%.In the reaction process,the strong oxidation by K2FeO4and the flocculation by the product Fe(OH)3have the synergistic effect on the degradation of phenol.The results of apparent reaction kinetics research show that the reaction between K2FeO4and phenol follows the second order kinetics law.
potassium ferrate;phenol;oxidation;degradation;second order kinetics;wastewater treatment
X703.1
A
1006-1878(2011)05-0389-04
2011-04-02;
2011-05-10。
黄先锋(1983—),男,福建省三明市人,硕士,讲师,主要从事水污染控制及废水资源化技术的研究。电话15259769065,电邮 xianfeng_huang@yahoo.com.cn。联系人:姜成春,电话13714322707,电邮 jiangcc_szpt@126.com。
国家自然科学基金资助项目(50978169);福建省教育厅科技研究项目(JB10213)。
(编辑 王 馨)
