新型可降解生物医用镁合金JDBM的研究进展
2011-11-24袁广银章晓波牛佳林陶海荣陈道运何耀华丁文江
袁广银,章晓波,牛佳林,陶海荣,陈道运,何耀华,蒋 垚,丁文江
(1. 上海交通大学 材料科学与工程学院 轻合金精密成型国家工程研究中心,上海 200240;2. 上海交通大学 附属第三人民医院骨科,上海 201900;3. 上海交通大学 附属第六人民医院骨科,上海 200233)
新型可降解生物医用镁合金JDBM的研究进展
袁广银1,章晓波1,牛佳林1,陶海荣2,陈道运3,何耀华3,蒋 垚3,丁文江1
(1. 上海交通大学 材料科学与工程学院 轻合金精密成型国家工程研究中心,上海 200240;2. 上海交通大学 附属第三人民医院骨科,上海 201900;3. 上海交通大学 附属第六人民医院骨科,上海 200233)
镁合金因具有与人体骨头接近的密度和弹性模量、高比强度和比刚度、生物可降解性以及生物相容性等优点,近10年来国内外研究人员对其应用于骨内植物、骨组织工程支架和心血管支架等领域进行了广泛的研究。然而,目前大多数研究均以现有商用镁合金为对象,如含Al元素的AZ31、AZ91以及含重稀土元素的WE43等,并未考虑到作为生物材料的安全性等问题。本文作者阐述镁合金作为生物医用材料的优势、面临的挑战以及应对策略;重点介绍上海交通大学轻合金精密成型国家工程研究中心近年来围绕自行研发的新型生物医用镁合金JDBM开展的研究工作;最后展望可降解生物医用镁合金的应用前景和发展方向。
可降解生物医用镁合金;骨内植物;心血管支架;生物相容性;生物降解性能
从21世纪初开始,以生物可降解镁合金为主要代表的具有生物可降解特性的新一代医用金属材料的研究发展迅速,受到了人们的特别关注[1-2]。这类新型医用金属材料改变人们通常将金属植入材料作为生物惰性材料使用的传统思想,巧妙地利用镁基金属材料在人体环境中易发生腐蚀(降解)的特性,来实现金属植入物在体内逐渐降解直至最终消失的医学临床目的。
与其他医用金属材料相比,镁合金具有如下的优势:
1) 可降解性。镁合金具有较低的腐蚀电位,在含有氯离子的体内环境下易发生腐蚀,并以缓慢腐蚀的方式在体内完全降解,可实现镁在人体中的降解吸收。
2) 生物安全性高。Mg作为人体必需的营养元素,在人体内含量仅次于Ca、K、Na,排第4位。目前,许多发达国家已将镁列为人体必需元素,补镁的重要性并不亚于补钙。世界卫生组织建议成人每天需要的摄镁量为280~300 mg,少年儿童为250 mg,婴幼儿为80 mg。Mg的生理功能主要体现在它能催化或激活机体325种酶系,参与体内所有能量代谢。对肌肉收缩、神经运动机能、生理机能及预防循环系统疾病和缺血性心脏病均具有重要作用[3-4]。镁的排泄主要通过泌尿系统,它在人体内吸收不会导致血清镁含量的明显升高。图1所示为人体内Mg的吸收和排泄动态平衡分布[5]。通常食物中所含镁的 30%~50%由肠胃吸收。另外,肾脏是Mg代谢调节的中心,血浆中自由Mg离子和 Mg盐每天由肾小球进行过滤,其中,95%~98%由肾小管进行再吸收。由于肾小管的再吸收将影响血浆中Mg的浓度,如果从肠胃吸收的Mg的吸收量增加,则肾小管的再吸收量就会减少,排泄量增加,使得血浆中的Mg浓度保持一定。因此,采用镁合金作为医用可降解生物材料具有良好的医学安全性基础[3]。
3) 生物力学相容性好。表1所列为几种常见植入材料及镁与人体骨物理机械性能的对比结果[6]。从表1可见,镁是目前所有金属材料中生物力学性能与人体骨最接近的金属材料,传统医用不锈钢的弹性模量E=200 GPa左右, 传统医用钛合金(Ti-6Al-4V)弹性模量也高达 110 GPa,而天然骨的弹性模量则为 3~20 GPa(不同部位,骨的弹性模量不同)。骨内固定修复材料的弹性模量如果与骨的弹性模量相差较大,就会导致“应力遮挡”[7],而影响骨的修复愈合。而镁的弹性模量E=45 GPa,最接近骨的弹性模量,可有效缓解“应力遮挡”。此外,镁合金的密度通常为 1.74~2.0 g/cm3,与自然骨密度1.8~2.1 g/cm3也最相近。由此可见,镁的物理机械性能比其他医用金属材料更接近于生物骨,是最理想骨内固定修复材料。
4) 成本低。镁是包括海洋在内地球表层最为丰富的金属元素,价格低廉。目前金属镁锭的市场价格在2万元(RMB)/t左右,而钛锭的价格在8万元(RMB)/t以上。
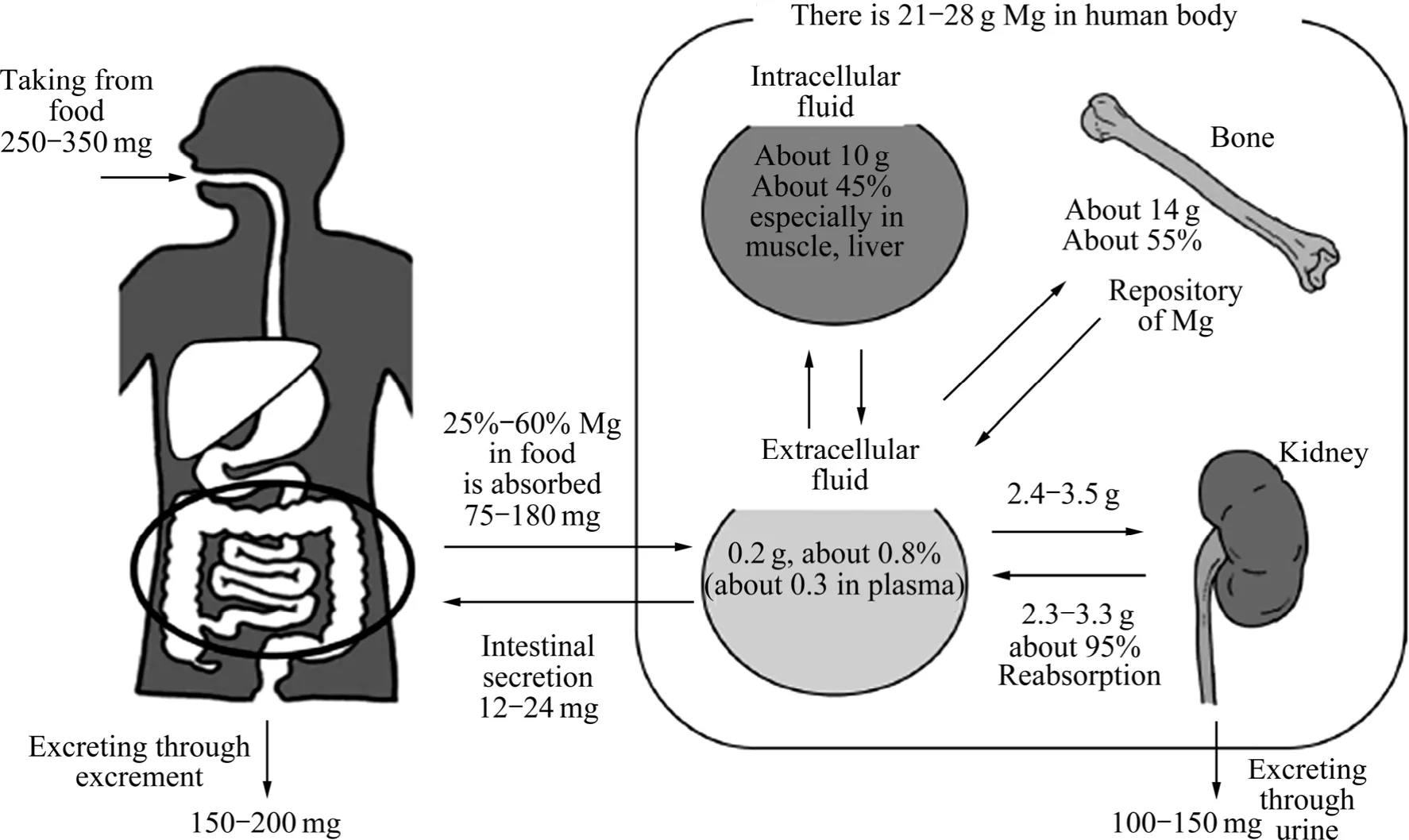
图1 人体内Mg的吸收和排泄动态平衡分布图[5]Fig.1 Distribution of dynamic absorption and excretion equilibrium of Mg in human body

表1 几种植入材料在物理力学性能方面同人骨的对比概括[6]Table1 Summary of physical and mechanical properties of various implant materials in comparison to natural bone
鉴于镁合金材料具有上述优势,可降解医用镁合金被誉为“革命性的金属生物材料”[8]而受到全世界的关注。最近几年成为美国、德国、日本等发达国家在生物材料领域竞相发展最重要的研究方向。其中,德国GKSS轻金属研究所自2007年始,每年获得500万欧元的滚动经费支持,研究开发新型可降解镁合金;美国国家自然科学基金会于 2008年在北卡莱罗纳农业大学投资1 800万美元建立“革命性医用金属材料”国家工程研究中心,用于以可降解镁合金为主的新型医用金属材料及植入器件研究[8]。此外,已有德国的Biotronik公司(血管支架)和 AAP公司(骨内植物产品)、美国的Boston Scientific公司(心血管支架)等跨国医疗器械生产企业均在致力于可降解镁合金植入器件产品的研发及临床应用试验。在我国,上海交通大学、北京大学、中国科学院金属研究所、重庆大学、郑州大学等高等学校及科研院所也开展了可降解生物医用镁合金的研究工作,并取得了可喜的研究成果。
1 可降解医用镁合金材料研究面临的主要挑战及其应对策略
目前,在医用镁合金材料研发方面,国内外研究人员主要集中在对现有商用镁合金如 Mg-Al[9]系、Mg-RE系[10-11]和Mg-Zn系[12]等进行生物医学评价,包括欧洲已经进入人体临床研究的心血管支架也都是采用商用稀土镁合金WE43制成。而常规商用镁合金直接作为生物材料使用存在风险,主要是因为商用镁合金是作为结构材料使用的,设计时没有考虑材料的生物相容性等问题。如AZ系列合金中含有的Al元素不属于人体的必需微量元素,被认为具有神经毒性,是导致早老性痴呆的因素。含Al的镁合金在体内试验时已观察到中度排异反应。国际生物镁合金研究领域著名学者WITTE等[2]曾指出“目前在研究含Al的镁合金的生物医学评价方面取得了许多体外和体内的试验数据,然而Mg-Al系等商用镁合金在尚无专门商用生物镁合金问世之际只能临时作为可降解镁合金的试验载体进行动物体内生物学评价和表面涂层等工艺验证实验,而不能植入人体内”。由此可见,虽然目前国外在采用传统商用镁合金进行医学评价研究方面取得了一些成果,显示了镁合金作为可降解医用材料的光明前景。但是,目前的商用镁合金还存在腐蚀降解速度过快,腐蚀模式为严重的局部腐蚀(点蚀),降解行为不可控,力学性能、生物相容性有待进一步提高的问题。而在开发新型高强韧、高耐蚀、降解行为可控、对人体安全的生物镁合金材料方面进展不大。这为我国生物材料工作者研发具有自主知识产权的新型高性能医用镁合金材料提供了可发挥的空间。
在设计高强韧医用镁合金时,需要考虑以下3方面:
1) 生物安全性。在合金设计时,必须选择生物安全性较高的合金化元素。
2) 高强韧(服役功能性)。虽然我们希望镁基生物材料可降解,但需要在完成它的功能之前具备必要的强度和塑性,以保证服役功能需求。ERINC等[13]提出了一套镁合金作为可降解骨科植入材料的性能指标:① 在37 ℃模拟体液中的腐蚀速率应小于0.5 mm/a,保证有效服役期在 90~180 d。② 室温屈服强度高于200 MPa,伸长率大于10%(骨板等内固定受力件);而对于心血管支架材料,则要求更高的塑性与中等强度匹配,如伸长率大于 20%,室温屈服强度高于 200 MPa。
3) 降解行为的可控性。目前报道的镁合金在模拟体液和动物体内的降解行为大多呈现严重的局部腐蚀(点蚀)。未来临床上需要的镁合金降解是均匀腐蚀,因为只有均匀腐蚀,才能预测镁合金在生物体内的服役寿命,才有可能通过内植物尺寸大小设计、涂层工艺改进等措施实现降解行为的可调控和服役寿命的可预测。笔者认为,上述3方面是相互关联、相互影响的,在设计医用镁合金时必须统筹考虑。生物安全性是前提,高强韧(服役功能性)是基础,降解的可控性是应用目标。
因此,如何选择生物相容性好的合金元素,设计高强韧(强度和塑韧性匹配)的医用镁合金,同时通过合金成分设计和组织结构调控实现医用镁合金降解行为的可控,成为新型医用镁合金研发过程中必须解决的问题。本文作者将主要介绍近年来上海交通大学轻合金精密成型国家工程研究中心在上述研究思想指导下在可降解医用镁合金材料研究领域的研究进展。
2 上海交通大学生物医用镁合金的研究进展
上海交通大学轻合金精密成型国家工程研究中心,作为我国重要的镁合金材料及精密成型工艺研究的国家级研究基地,近年来在可降解医用镁合金材料研究领域也取得了令国际同行瞩目的研究成果。该研究中心研究人员与医学研究人员合作,积极开展生物医用镁合金材料的临床应用基础研究。上海交通大学研究人员运用第一性原理计算与分子动力学模拟方法,并与实验相结合,从原子、分子水平深入系统地探索了镁的变形机制,定量评估了所优选的生物相容性好的合金元素对镁中层错能及位错滑移、孪生等变形倾向的影响,设计开发了生物相容性好、强度和塑韧性相匹配、腐蚀行为接近均匀腐蚀的新型高性能生物医用镁合金 Mg-Nd-Zn-Zr基合金系列(Jiao Da bio-magnesium series,简称JDBM),已经分别申请中国和国际专利保护。该合金体系中通过加入少量细胞毒性轻微(临床可接受)的轻稀土元素 Nd[14]作为低合金化元素,Nd的加入可以保证镁合金具有良好的时效析出强化和固溶强化效果,并可大幅度提高镁合金基体的电极电位,减小基体与第二相的电偶腐蚀电位差,从而提高镁合金的耐均匀腐蚀性能。同时加入 Zn和Zr进行微合金化,Zn是人体必需的微量营养元素,Zn的加入可提高合金的强度,同时有效促进室温下镁合金非基面滑移的发生,从而提高镁合金的塑性加工能力;Zr作为晶粒细化剂,可显著细化晶粒,提高合金的强韧性和耐蚀性,Zr在镁合金中的生物相容性也已经被证实[15]。
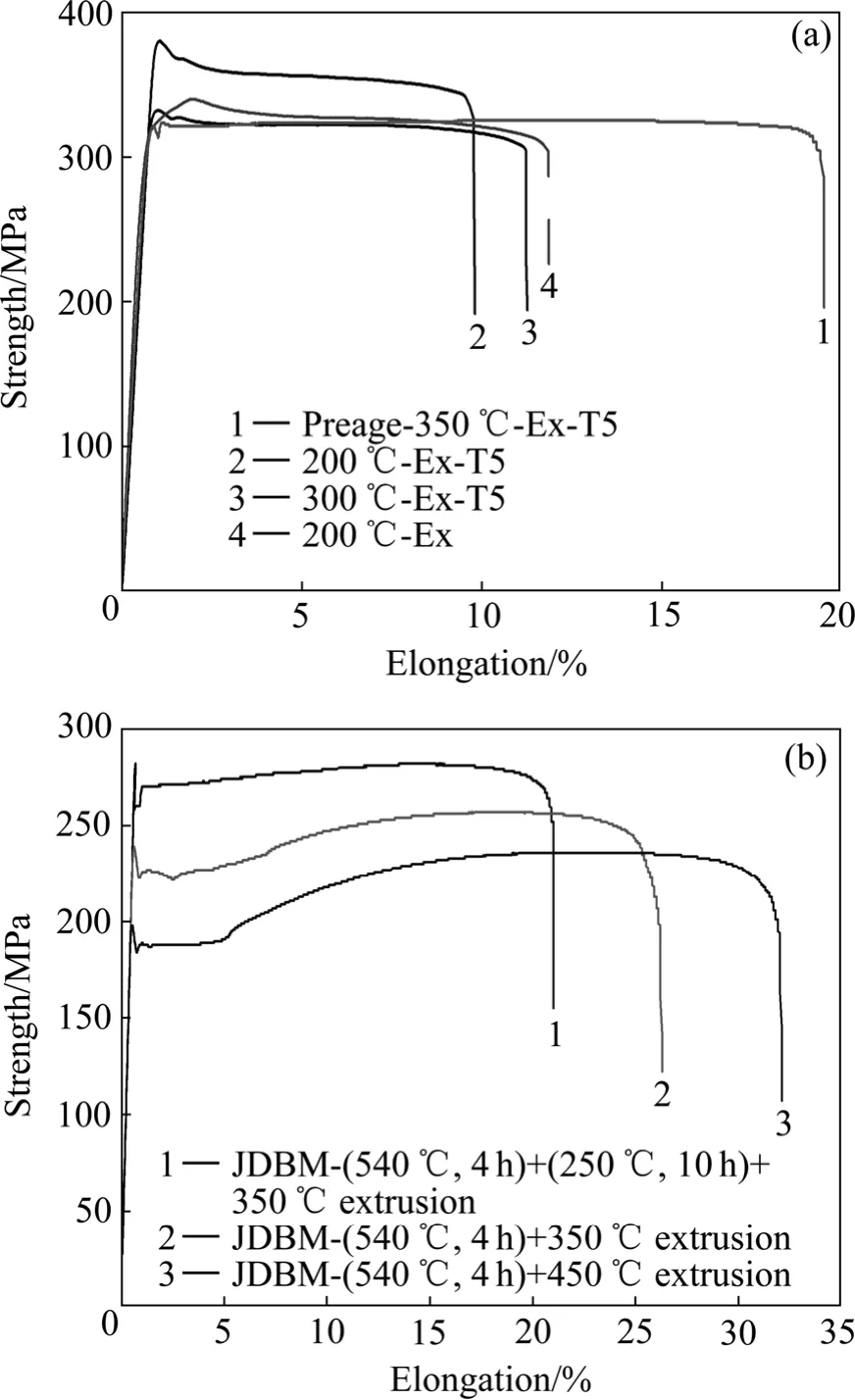
图2 上海交通大学研究开发的医用镁合金JDBM系列的力学性能拉伸曲线Fig.2 Mechanical properties tensile curves of biomedical JDBM magnesium alloy series developed by Shanghai Jiao Tong University: (a) JDBM-1 with high strength and moderate ductility for bone implants application; (b) JDBM-2 with high ductility and moderate strength for vascular stent application
2.1 JDBM的显微组织及力学性能
上海交通大学研究开发的可降解生物医用镁合金JDBM 系列共分为两大类:1) 针对医用骨内植物器械,研究开发了“高强度中等塑性”医用镁合金,简称 JDBM-1。其力学性能范围:拉伸屈服强度σ0.2=320~380 MPa,伸长率 δ=8%~18%(取决于变形加工工艺),如图2(a)。2) 针对可降解血管类支架等介入微创医疗器械,研究开发了“高塑性中等强度”医用镁合金,简称JDBM-2。其力学性能范围:拉伸屈服强度 σ0.2=180~280 MPa,伸长率 δ=20%~32%(取决于变形加工工艺),如图2(b)所示。图3所示为JDBM系列合金典型的铸态显微组织和挤压变形后的显微组织。可见,该类合金显微组织的特点是无论是铸态组织还是挤压变形态组织,均非常细小,普通金属型铸态组织二次枝晶臂尺寸约为30~50 μm,450 ℃挤压变形后(挤压比9)横截面晶粒尺寸约为3~5 μm,远低于商用镁合金AZ31、AZ91等镁合金同样制备条件下的80~100 μm(铸态)和 10~20 μm(挤压态)显微组织尺寸。JDBM合金系列强度、塑韧性、耐蚀性能和生物相容性全面超越目前欧洲已进入临床实验用的镁合金WE43,达到了国际先进水平。

图3 JDBM合金典型铸态和挤压变形态(450 ℃挤压,挤压比9)的显微组织Fig.3 Optical images showing typical microstructures of as-cast JDBM (a) and as-extruded JDBM extruded at 450 ℃with extrusion ratio of 9 (b)
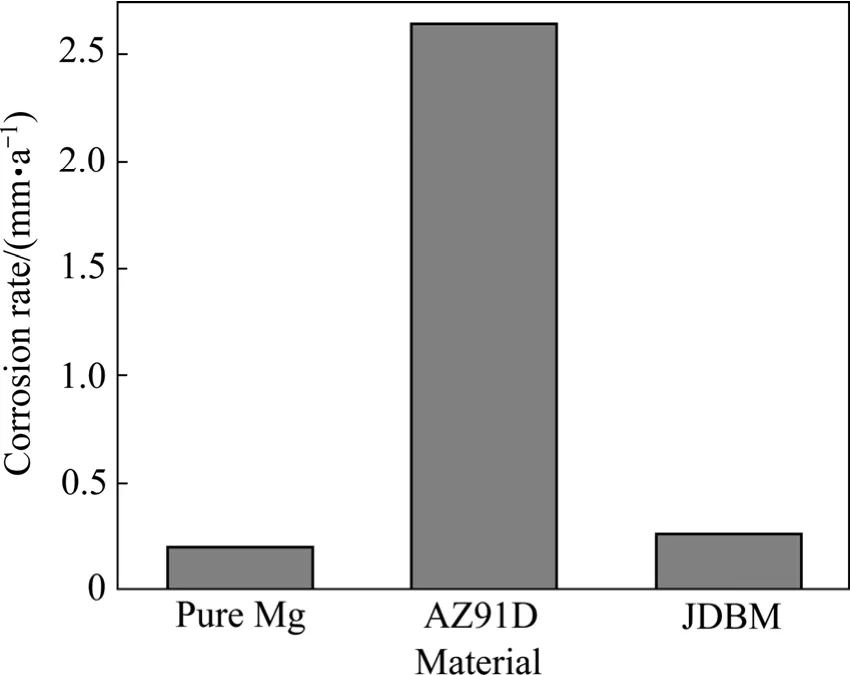
图4 高纯 Mg、AZ91D和 JDBM 在模拟体液中的腐蚀速率[16]Fig.4 Corrosion rate of high pure Mg, AZ91D and JDBM immersed in SBF[16]
2.2 JDBM的生物降解性能
JDBM合金在模拟体液中具有理想的耐蚀性能。张佳等[16]研究了高纯Mg、T4态AZ91D和T4态JDBM 3种材料在模拟体液(Simulated body fluid,SBF)中的生物腐蚀性能(见图4)。结果表明:JDBM在模拟体液中的腐蚀速率与高纯Mg接近,远低于AZ91D的,显示出理想的耐蚀性。此外,JDBM在模拟体液中浸泡10 d后的腐蚀形貌与高纯Mg的接近,近乎表现为均匀腐蚀,而 AZ91D表现为严重的局部腐蚀行为,如图5所示。
图6所示为AZ91D与JDBM在NaCl溶液中的腐蚀原理示意图[17]。而模拟体液中的主要成分也是NaCl,因此其机理相似:对于 AZ91D合金,在腐蚀的开始阶段,未腐蚀区域的电位在-1.52 V左右,而腐蚀区域的电位在-1.73 V左右,这样腐蚀区域的电位低于未腐蚀区域的,形成局部微电池,在微电池原理的作用下,在接下来的腐蚀阶段里,腐蚀区域充当阳极,继续遭到腐蚀,从而导致腐蚀方向继续往深入方向发展,形成严重的局部腐蚀;对于JDBM合金,在腐蚀的开始阶段,未腐蚀区域的电位在-1.75 V左右,而腐蚀区域的电位在-1.72 V左右,这样腐蚀区域的电位高于未腐蚀区域的,根据电偶腐蚀原理,腐蚀方向将朝四周方向发展,因此,呈现相对均匀的腐蚀方式。实现均匀腐蚀降解对于生物医用镁合金具有至关重要的意义,因为只有实现均匀腐蚀而不是一般商用镁合金的局部腐蚀(点腐蚀),医用镁合金的服役寿命才能预测,才具有临床应用的可靠性。
ZHANG 等[18]研究了不同挤压温度(250、350和450 ℃)下JDBM在模拟体液中浸泡10 d后的生物腐蚀性能。结果表明,JDBM经挤压后耐蚀性能显著提高。并且对挤压态JDBM时效处理(200 ℃,8 h)后耐蚀性能得到进一步提高,如图7所示。已有研究表明,晶粒细小有利于提高镁合金的抗腐蚀性能[19-20]。此外,SONG 等[21]指出,AZ91D 镁合金中第二相 Mg17Al12在腐蚀过程中具有双重作用:如果基体晶粒细小,而第二相的体积分数达到一定程度且近乎连续地分布在基体周围,第二相会起到阻碍合金腐蚀的作用;反之,则由于电偶腐蚀加剧合金的腐蚀。在JDBM镁合金中,Mg12Nd是耐蚀相,其腐蚀电位比基体Mg的腐蚀电位略微正一点[22],因此,第二相因电偶腐蚀带来的副作用很小,而细小的晶粒加之分布相对均匀的第二相在一定程度上起到阻碍合金腐蚀的作用。因此,挤压的JDBM的腐蚀速率明显降低。

图5 高纯Mg、AZ91D和JDBM在模拟体液中浸泡10 d洗去腐蚀产物后表面和截面的SEM像[16]Fig.5 SEM images of surfaces ((a), (b), (c)) and sections ((d), (e), (f)) of high pure Mg((a), (d)), AZ91D((b), (e)) and JDBM((c), (f))immersed in SBF for 10 d after cleaning corrosion products[16]

图6 AZ91D和JDBM合金腐蚀过程示意图[17]Fig.6 Schematic diagrams of corrosion evolution for AZ91D and JDBM alloys[17]: (a) Initial corrosion, AZ91D; (b) After corrosion for long time, AZ91D; (c) Initial corrosion, JDBM; (d) After corrosion for long time, JDBM
JDBM在模拟体液中浸泡10 d后表面生成一层致密的腐蚀层,如图8(a)和(c)所示,其主要腐蚀产物为Mg(OH)2和(Ca, Mg)3(PO4)2;在腐蚀层外表面形成白色颗粒状的羟基磷灰石(HA),HA是人骨的组成部分,HA在镁合金表面的生成可加速骨组织的愈合。洗去腐蚀产物后在SEM下观察到挤压态JDBM的腐蚀形貌比T4态的更加均匀,如图 8(b)和(d)所示。这种均匀腐蚀方式对可降解生物医用材料非常重要,因为可降解医用内植物材料(如骨固定物、心血管支架等)在服役期间如果发生严重的局部腐蚀,可造成内植物器械突然性过早断裂失效;而均匀腐蚀则可避免上述情况的发生。JDBM的均匀腐蚀方式比其他生物镁合金更有优势,有望成为生物医用镁合金的理想选择。

图7 不同状态下JDBM合金在模拟体液中浸泡10 d的腐蚀速率[18]Fig.7 Corrosion rate of JDBM alloy under different conditions after immersed in SBF for 10 d[18]

图8 不同状态JDBM合金在模拟体液中浸泡10 d腐蚀产物酸洗前、后的SEM像[18]Fig.8 SEM images of JDBM alloy under different conditions before ((a), (c)) and after ((b), (d)) removing corrosion products accordingly after immersed in SBF for 10 d[18]: (a), (b) T4; (c), (d) Extruded at 350 ℃
2.3 JDBM合金的表面改性
宗阳[23]采用脉冲电化学沉积法在JDBM合金表面制备了具有良好生物活性的 HA涂层。图 9所示为JDBM合金经电化学沉积后表面及侧面的SEM像。从图 9(a)可以看到,涂层表面呈花朵团簇状,团簇基本垂直于基体生长,团簇之间交互联结,形成致密的网状结构附着在基体表面,厚度约为10 μm(见图9(b))。分别将有、无涂层的JDBM合金在Hank’s溶液中浸泡8 d,采用析氢法测试其腐蚀性能,其结果如图10所示,在浸泡起始阶段析氢速率较快,但经过一段时间的浸泡后,析氢量稳定在一个较小的数值,说明脉冲电化学沉积生成的HA涂层对基体起到很好的保护作用,在局部涂层不够致密的地方也能通过试样在Hank’s液中自发的矿化生成腐蚀产物进行保护。总体来说,经过涂层的JDBM析氢量明显减少,表面涂层进一步提高了JDBM的耐蚀性能。
张佳[24]则采用阳极氧化的方法对JDBM合金进行了表面改性。试样表面形成了一层具有微孔结构的保护性陶瓷膜层,陶瓷层中主体相为MgO、Mg2SiO4等镁氧化物和含硅尖晶石型氧化物,该膜层有利于成骨细胞附着、骨组织长入的表面形貌,提高生物相容性,实现金属与陶瓷优点的有机结合。将阳极氧化处理后的JDBM合金在模拟体液中浸泡7 d,其7 d总析氢量不足0.1 mL/cm2。说明阳极氧化很好地改善了JDBM合金的腐蚀性能。

图9 JDBM合金电化学沉积后的表面和侧面形貌[23]Fig.9 Surface (a) and side (b) wall morphologies of JDBM alloy after electrochemical deposition[23]

图10 JDBM和HA-JDBM合金在Hank’s溶液中的析氢曲线[23]Fig.10 Hydrogen evolution curves of JDBM and HA-JDBM alloys as function of immersion time in Hank’s solution[23]

图11 JDBM 合金表面 Ca-P涂层宏观照片及能谱分析和SEM像Fig.11 Photo with EDS results (a) and SEM image (b) of JDBM alloy with Ca-P coating
课题组最近还相继开发了针对骨内植物用的具有生物活性的 Ca-P涂层技术和针对心血管支架用的氟化处理技术。处理后的Ca-P涂层,如图11所示。Ca-P涂层形貌呈细小磷石状晶体,由基体向外生长,与基体结合强度高(结合力大于10 MPa),这种形貌与骨磷灰石的晶体特征非常相似,从而有利于体内骨质的沉积,具有更好的生物相容性。利用氟化处理技术对JDBM合金进行表面处理,结果表明,表面氟化处理能有效提高JDBM在人工血浆中的耐蚀性能,并在一定程度上改善其生物相容性。相关结果将陆续报道。
2.4 JDBM的生物相容性
2.4.1 细胞毒性
图12所示为MTT法检测的小鼠MC3T3-E1成骨细胞培养于JDBM-1 Ca-P涂层、JDBM-1、WE43浸提液中1、3和5 d后相对于阴性对照组的活性百分比。可以看出,JDBM-1、JDBM-1 Ca-P涂层、WE43和AZ31 4种镁合金对 MC3T3-E1细胞都没有毒性。JDBM-1 Ca-P涂层组的细胞活性最高,JDBM-1组次之。JDBM-1组和JDBM-1涂层组的细胞活性大于阴性对照组,可以促进成骨细胞增殖。说明JDBM镁合金和Ca-P涂层具有良好的细胞相容性。同时,值得指出的是,图12结果也表明,相对于商用镁合金WE43和AZ31,JDBM合金具有更好的细胞相容性。经上海市生物研究测试中心检测,证实该材料的细胞毒性反应为0~1级,表明该材料生物的生物安全性完全满足临床使用要求。

图12 MC3T3-E1细胞在JDBM、JDBM涂层、WE43、AZ31浸提液中培养1、3和5 d后的细胞活性(MTT法)Fig.12 Viability of MC3T3-E1 cell cultured in leaching solution of JDBM, JDBM-coating, WE43 and AZ31 for 1, 3 and 5 d, respectively

图13 镁合金表面MC3T3-E1培养24 h的钙黄绿素染色情况Fig.13 Calcein staining of MC3T3-E1 cultured for 24 h on surfaces of magnesium alloys: (a) JDBM; (b) WE43; (c)Number of cells in 100 magnification
图13所示为将小鼠成骨细胞MC3T3-E1直接种植在JDBM镁合金和商用镁合金WE43试样表面24 h后的细胞存活情况。可以发现,JDBM合金试样表面具有更多的存活细胞数量,再次证实JDBM比WE43具有更低的细胞毒性。
2.4.2 溶血率
对Ca-P涂层前后JDBM合金的溶血率进行测试,纯镁和商用镁合金 AZ91D作为对比样品一同进行测试,结果(见表2)。可见,JDBM裸金属的溶血率明显低于纯镁和AZ91D的,经Ca-P涂层处理后JDBM的溶血率大幅度降低,完全满足医学上要求生物材料溶血率低于5% 的要求。
2.4.3 血小板黏附实验
当材料植入肌体血管内时,由于组织损伤及白细胞的激活会引发血液中及血管内皮细胞表面及血液中单核细胞表面组织因子活性的升高,从而导致血液中及内皮细胞表面的血小板聚集及血栓的形成。因此,血小板黏附实验是评价材料引发血栓形成的重要手段。将JDBM-2镁合金和商用镁合金AZ91D及医用钛合金Ti-6Al-4V进行了血小板黏附实验,结果见图14。可见,相对于医用钛合金,镁合金样品表面均具有较好的抗血小板黏附的能力。镁合金表现出的这种优异的抗血小板黏附性能是目前其他传统不可降解医用金属材料无法具备的。这与镁合金降解过程中释放出负电荷有关,因为释放的负电荷会吸附在样品表层,起到对同样带负电荷的血小板的排斥效应,从而表现出如图 14所示的血小板团聚成球附着在样品表面的现象。这预示着镁合金制备成血管支架,将有助于抑制血小板的黏附,进而抑制血栓形成,从而有利于降低支架植入后的血管再狭窄率。

表2 溶血率实验结果Table2 Results of hemolysis test
2.5 JDBM合金用于动物体内实验
采用挤压态JDBM-1裸金属植入新西兰大白兔体内,并与挤压态AZ31合金进行对比,其结果如图15所示。可以看出,AZ31在体内90 d时大部分降解,而180 d时完全消失;而JDBM在体内90 d时基本完好,180 d时降解量小于40%,动物体内实验证实了JDBM裸金属具有理想的耐蚀性能,可以在体内有效服役工作180 d以上。
3 上海交通大学生物医用镁合金体内植入器械的研制
3.1 骨内植物器械
以“高强度中等塑性”的JDBM-1为材料,经数控精密加工,制备用于治疗指骨骨折修复用的骨板和骨钉,如图16(a)。目前正在进行动物体内生物医学评价实验。图 16(b)所示为采用 JDBM-1制备的骨组织工程支架,可用以治疗骨质缺损和骨折缩松等。

图14 钛合金和镁合金样品的血小板黏附实验结果Fig.14 Platelet adhesion test results of Ti alloy and Mg alloys:(a) Ti6Al4V; (b) AZ91D; (c) JDBM-2
3.2 心血管支架
以“高塑性中等强度”的JDBM-2为材料,采用复合加工工艺制备心血管支架用微管(外径3 mm,壁厚 0.2 mm)。利用激光切割、酸洗及电化学抛光等手段制备心血管支架原型,如图17所示,该支架的径向支撑力测试结果显示,其支撑强度是正常人血管最大收缩压的4倍以上,可满足心血管支架支撑强度的要求。此外,在电化学抛光过程中,对比AZ31和JDBM-2支架在同种弱酸性抛光液中的抛光效果,结果在体视显微镜下观察到AZ31支架表面有许多小坑点,表明该合金在抛光液中发生点蚀,而JDBM-2支架表面光滑,进一步验证了JDBM合金腐蚀为均匀腐蚀方式,如图18所示。
综上所述,上海交通大学研究开发的新型可降解医用生物镁合金 JDBM 系列具有良好的生物相容性,优异的力学性能和耐腐蚀性能,特别是通过成分设计和组织调控,使该系列合金实现了在Cl-介质中的均匀腐蚀降解,这是目前国内外公开报道中首个能被证实具有均匀腐蚀降解特点的生物镁合金。初步的动物实验结果显示该合金具有广泛的临床应用前景。

图15 挤压态AZ31和JDBM-1裸金属的体内植入90 d和180 d的医学影像图Fig.15 Medical images of as-extruded AZ31 ((a), (b)) and JDBM-1 ((c), (d)) implanted in rabbit after 90 d ((a), (c)) and 180 d ((b), (d))

图16 上海交通大学研究开发的可降解镁合金骨板骨钉和骨组织工程支架原型Fig.16 Bone plates and screws (a) and bone tissue engineering scaffold (b) made of JDBM-1 with high strength and moderate ductility

图17 上海交通大学研究开发的JDBM-2镁合金微管和采用该微管加工而成的血管支架Fig.17 Images of tubes (a) and cardiovascular stent (b) made of JDBM-2

图18 AZ31和JDBM-2支架经相同电化学抛光工艺后的显微照片Fig.18 Micrographs of AZ31 (a) and JDBM-2 (b) stents after the same electrochemical polishing process
4 展望
可降解生物医用镁合金相对于传统金属医用材料来说,具有无可比拟的优越性,如作为骨内植物,可有效避免应力遮挡效应,并可避免骨折痊愈后二次手术给病人带来的痛苦和费用;作为心血管支架材料,可有效减少血管内膜增生、再狭窄、晚期血栓等问题。因此,被誉为“革命性的金属生物材料”而受到全球高度瞩目。
尽管目前已有动物体内及人体临床实验,然而绝大多数为商用镁合金,缺乏生物安全性。作为生物医用材料,在设计时必须考虑材料的生物安全性、强韧性、耐蚀性(特别是类似于均匀腐蚀降解方式)。因此,需要设计具有生物安全性、高强韧性、耐蚀性和腐蚀均匀性的新型生物医用镁合金;需要对其强韧性设计制备理论、在体内的降解代谢机制及体内降解产物的生物安全性、降解行为的可控性等方面进行系统深入的研究,进而为可降解生物医用镁合金的临床医学应用提供更加可靠的科学依据。此外,镁合金作为生物医用材料,还有更多潜在医用价值值得挖掘,如镁降解过程中释放的氢近年来研究表明,氢的适度吸收对人体是非常有益的;镁合金支架具有显著抑制血栓、降低血管再狭窄等功效。上海交通大学轻合金精密成型国家工程研究中心团队近年来在上述领域进行了一些有益的探索,并取得了令人鼓舞的进展。相信经过科研工作者的不断努力探索,可降解生物医用镁合金一定会有光明的应用前景,成为惠及人类健康的新型金属生物材料。
REFERENCES
[1] WITTE F, KAESE V, HAFERKAMP H, SWITZER E,MEYER-LINDENBERG A, WIRTH C J, WINDHAGEN H. In vivo corrosion of four magnesium alloys and the associated bone response[J]. Biomaterials, 2005, 26: 3557–3563.
[2] WITTE F, HORT N, VOGT C, COHEN S, KAINER K,WILLUEIT R, FEYERABEND F. Degradable biomaterials based on magnesium corrosion[J]. Current Opinion in Solid State and Materials Science, 2008, 12: 63-72.
[3] SARIS NE, MERVAALA E, KARPPANEN H, KHAWAJA J A,LEWENSTAM A. Magnesium: An update on physiological,clinical and analytical aspects[J]. Clinica Chimica Acta, 2000,294: 1-26.
[4] VORMANN J. Magnesium: nutrition and metabolism[J].Molecular Aspects of Medicine, 2003, 24: 27-37.
[5] AKIKO Y. Biomedical application of magnesium alloys[J].Journal of Japan Institute of Light Metals, 2008, 58: 570-576.
国外有研究认为大肠埃希菌菌株起源与系统发育群有关,同一个系统发育群的菌株可能存在共同的祖先,不同系统发育群致病力亦不相同[12,27]。Wang等[5]研究发现血流感染中大肠埃希菌主要是B2群,其次是D群、B1群和A群。本研究结果显示,引起血流感染的大肠埃希菌主要为B2群,而F群菌株数量仅次于B2群,与Wang等[5]报道并不一致,原因可能是本研究采用最新的分群方法[16],更加细分出F群,目前采用这种新方法进行血流感染大肠埃希菌分群的文献报道罕见,关于F群菌株的特征有待进一步研究。
[6] STAIGER M P, PIETAK A M, HUADMAI J, DIAS G.Magnesium and its alloys as orthopedic biomaterials: A review[J]. Biomaterials, 2006, 27: 1728-1734.
[7] KANNAN M B, RAMAN R K. In vitro degradation and mechanical integrity of calcium-containing magnesium alloy in modified-simulated body fluid[J]. Biomaterials, 2008, 29:2306-2314.
[8] SANKAR J. NSF engineering research center for revolutionizing metallic biomaterials[EB/OL]. http://erc.ncat.edu. 2011-07-04.
[9] DUYGULU O, KAYA R A, OKTAY G, KAYA A A. Investigation on the potential of magnesium alloy AZ31 as a bone implant[J].Mater Sci Forum, 2007, 546/549: 421-424.
[10] WITTE F, KAESE V, HaAFERKAMP H, MEYERLINDENBERG A, WIRTH C J, WINDHAGEN H. In vivo corrosion of four magnesium alloys and the associated bone response[J]. Biomaterials, 2005, 26: 3557-3563.
[11] HANZI A C, GUNDE P, SCHINHAMMER M, UGGOWITZER P J. On the biodegradation performance of an Mg-Y-RE alloy with various surface conditions in simulated body fluid[J]. Acta Biomaterialia, 2009, 5: 162-171.
[12] ZHANG S X, ZHANG X N, ZHAO CL, LI J N, SONG Y, XIE C Y, TAO H R, ZHANG Y, HE Y H, JIANG Y, BIAN Y J.Research on an Mg-Zn alloy as a degradable biomaterial[J]. Acta Biomaterialia, 2010, 6: 626-640.
[13] ERINC M, SILLEKENS W H, MANNENS G, WERKHOVEN R. Applicability of existing magnesium alloys as biomedical implant materials[C]//Magnesium Technology 2009. New York: TMS,2009: 209-214.
[14] FEYERABEND F, FISCHER J, HOLTZ J, WITTE F,WILLEMEIT R, DRUCHER H, VOGT C, HORT N. Evaluation of short-term effects of rare earth and other elements used in magnesium alloys on primary cells and cell lines[J]. Acta Biomaterialia, 2010, 6: 1834-1842.
[15] YE X Y, CHEN M F, YANG M, WEI J, LIU D B. In vitro corrosion resistance and cytocompatibility of nanohydroxyapatite reinforced Mg-Zn-Zr composites[J]. Journal of Materials Science: Materials in Medicine, 2010, 21: 1321-1328.
[16] 张 佳, 宗 阳, 袁广银, 常建卫, 付彭怀, 丁文江. 新型医用Mg-Nd-Zn-Zr镁合金在模拟体液中的降解行为[J]. 中国有色金属学报, 2010, 20(10): 1989-1997.
ZHANG Jia, ZONG Yang, YUAN Guang-yin, CHANG Jian-wei,FU Peng-huai, DING Wen-jiang. Degradable behavior of new-type medical Mg-Nd-Zn-Zr magnesium alloy in simulated body fluid[J]. The Chinese Journal of Nonferrous Metals, 2010,20(10): 1989-1997.
[17] 丁文江, 向亚贞, 常建卫, 彭颖红. Mg-Al系和Mg-RE系合金在 NaCl溶液中的腐蚀电化学行为[J]. 中国有色金属学报,2009, 19(10): 1713-1719.
DING Wen-jiang, XIANG Ya-zhen, CHANG Jian-wei, PENG Ying-hong. Corrosion and electrochemical behaviour of Mg-Al alloys and Mg-RE alloys in NaCl solution[J]. The Chinese Journal of Nonferrous Metals, 2009, 19(10): 1713-1719.
[18] ZAHNG X B, YUAN G Y, MAO L, NIU J L, FU P H, DING W J. Effects of extrusion and heat treatment on the mechanical properties and biocorrosion behaviors of a Mg-Nd-Zn-Zr alloy[J].Journal of the Mechanical Behavior of Biomedical Materials, In press, 10.1016/j.jmbbm.2011.05.026.
[19] RALSTON K D, BIRBILIS N. Effect of grain size on corrosion:A review[J]. Corrosion, 2010, 66: 075015.1-075015.13.
[20] HAMU G B, ELIEZER D, WAGNER L. The relation between severe plastic deformation microstructure and corrosion behavior of AZ31 magnesium alloy[J]. Journal of Alloys and Compounds,2009, 468: 222-229.
[21] SONG G L, ATRENS A, DAEGUSCH M. Influence of microstructure on the corrosion of diecast AZ91D[J]. Corrosion Science, 1999, 41: 249-273.
[22] CHANG J W, FU P H, GUO X W, PENG L M, DING W J. The effects of heat treatment and Zirconium on the corrosion behavior of Mg-3Nd-0.2Zn-0.4Zr (wt.%) alloy[J]. Corrosion Science, 2007, 49: 2612-2627.
[23] 宗 阳. 可降解骨内植入材料用镁合金 JDBM表面改性的研究[D]. 上海: 上海交通大学, 2011: 45-57.
ZONG Yang. Investigation of surface modification on degradable magnesium alloy JDBM used as bone implants[D].Shanghai: Shanghai Jiao Tong University, 2011: 45-57.
[24] 张 佳. 新型Mg-Nd-Zn-Zr合金在模拟体液中的降解行为研究[D]. 上海: 上海交通大学, 2010: 63-70.
ZHANG Jia. Research on the degradable behaviour of Mg-Nd-Zn-Zr magnesium alloy in SBF[D]. Shanghai: Shanghai Jiao Tong University, 2010: 63-70.
Research progress of new type of degradable biomedical magnesium alloys JDBM
YUAN Guang-yin1, ZHANG Xiao-bo1, NIU Jia-lin1, TAO Hai-rong2, CHEN Dao-yun3,HE Yao-hua3, JIANG Yao3, DING Wen-jiang1
(1. National Engineering Research Center of Light Alloy Net Forming, School of Materials Science and Engineering,Shanghai Jiao Tong University, Shanghai 200240, China;2. Department of Orthopedics, the Third People’s Hospital Affiliated to Medical College,Shanghai Jiao Tong University, Shanghai 201900, China;3. Department of Orthopedics, Shanghai Sixth People’s Hospital, Shanghai Jiao Tong University,Shanghai 200233, China)
Mg alloys have been extensively studied in the last decade in the fields of bone implants, bone tissue engineering scaffolds and cardiovascular stents due to their excellent properties, such as close density and elastic modulus to those of nature bone, high specific strength and rigidity, biodegradation and biocompatibility. However, most of the Mg alloys studied for biodegradable materials are aluminium-containing alloys, such as AZ31 and AZ91 and some heavy rare earth elements-containing alloys such as WE43. These alloys were originally developed for structural materials which did not consider the bio-safety as biomaterials. In this work, the advantages, challenges and strategies of the Mg alloys as biomedical materials are briefly introduced. The work on biomedical Mg alloys of the National Engineering Research Center of Light Alloy Net Forming, Shanghai Jiao Tong University, is highlighted. Finally, the application prospects and direction of the biodegradable biomedical Mg alloys are prospected.
degradable biomedical magnesium alloys; bone implants; cardiovascular stents; biocompatibility;biodegradation properties
R318.08
A
1004-0609(2011)10-2476-13
教育部博士点资助项目(20100073110004);中国博士后科学基金资助项目(20100470030);上海市科委资助项目(10JC1407400)
2011-06-16;
2011-07-28
袁广银,教授,博士;电话:021-34203051;传真:021-34202794;E-mail: gyyuan@sjtu.edu.cn
(编辑 陈卫萍)
