新型双腙基喹唑啉类衍生物的合成及其抑菌活性
2011-11-23熊启中高元磊韩菲菲鲍小平
安 锐, 熊启中, 高元磊, 韩菲菲, 鲍小平
(贵州大学 精细化工研究开发中心 教育部绿色农药与农业生物工程重点实验室,贵州 贵阳 550025)
喹唑啉类衍生物具有广泛的生物活性[1~4],目前已商品化的喹唑啉类药物有杀菌剂氟喹唑、杀螨剂喹螨醚、抗癌药物易瑞沙和治疗高血压药物哌唑嗪等。腙基官能团也是一类具有很好生物活性的药效团[5~8],如杀虫剂氰氟虫腙、杀菌剂嘧菌腙和除草剂氟吡草腙中都含有腙基单元。
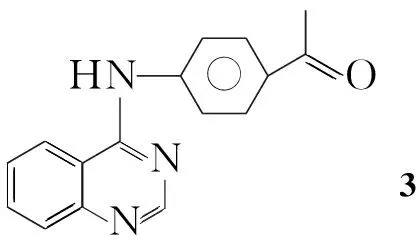
已有的研究表明由于活性叠加效应的影响,含双亚胺的化合物较相应的单亚胺化合物具有更强的生物活性[9]。为了寻找具有更高活性的杀菌剂,本文根据活性亚单元拼接原理将双腙基团引入到喹唑啉杂环中,设计并合成了17个新型的双腙基喹唑啉类化合物——对(喹唑啉-4-胺基)苯乙酮芳醛双腙(5a~5q, Scheme 1),其结构经1H NMR,13C NMR, IR, MS和元素分析表征。并初步测试了他们对小麦赤霉菌、辣椒枯萎菌和苹果腐烂菌的抑制活性。
1 实验部分
1.1 仪器与试剂
X-4型数字显示熔点仪(温度计未校正);JOEL ECX-500型核磁共振仪(DMSO-d6或CDCl3为溶剂,TMS为内标);Shimadzu Prestige-21型红外光谱仪(KBr压片);Agilent ESI-MSD Trap(VL)型质谱仪;Elementar Vario Ⅲ型元素分析仪。

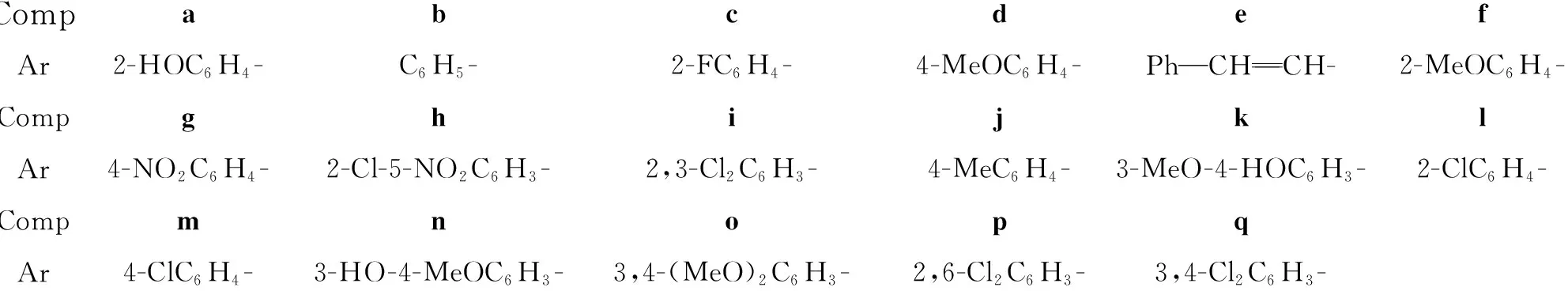
CompabcdefAr2-HOC6H4-C6H5-2-FC6H4-4-MeOC6H4-PhCHCH- 2-MeOC6H4-CompghijklAr4-NO2C6H4-2-Cl-5-NO2C6H3-2,3-Cl2C6H3-4-MeC6H4-3-MeO-4-HOC6H3-2-ClC6H4-CompmnopqAr4-ClC6H4-3-HO-4-MeOC6H3-3,4-(MeO)2C6H3-2,6-Cl2C6H3-3,4-Cl2C6H3-
Scheme1
喹唑啉-4-酮(1)[10]和4-氯喹唑啉(2)[11]参照文献方法合成;其余所用试剂均为分析纯或化学纯。
1.2 合成
(1) 4-(对乙酰基苯胺基)喹唑啉(3)的合成
在反应瓶中加入2 2.4 g(15 mmol),异丙醇40 mL和对氨基苯乙酮2.36 g(18 mmol),搅拌下回流反应2 h(有大量固体生成),冷却至室温,抽滤,滤饼干燥得黄色固体3 3.8 g,收率96.3%, m.p.>250 ℃;1H NMR(DMSO-d6)δ: 2.62(s, 3H), 7.90(t,J=7.7 Hz, 1H), 7.98(d,J=8.6 Hz, 3H), 8.09(d,J=8.6 Hz, 2H), 8.13(t,J=7.7 Hz, 1H), 8.91(d,J=8.1 Hz, 1H), 9.01(s, 1H), 11.61(s, 1H); IRν: 3 421(N-H), 1 678(C=O) cm-1。
(2) 4-(对苯乙酮腙基胺基)喹唑啉(4)的合成
在反应瓶中加入31.03 g(4 mmol),甲苯45 mL和80%水合肼1.9 mL(31 mmol),搅拌下回流反应8 h。减压除去大部分甲苯,有大量黄色固体析出;加入适量的水,抽滤,滤饼用水反复洗涤,干燥得黄色固体4 0.76 g,收率 70.4%, m.p.197 ℃~199 ℃;1H NMR(DMSO-d6)δ: 2.05(s, 3H), 6.32(s, 2H), 7.67(d,J=8.1 Hz, 3H), 7.80(d,J=7.5 Hz, 1H), 7.86(d,J=8.6 Hz, 3H), 8.58(d,J=8.6 Hz, 1H), 8.62(s, 1H), 9.82(s, 1H); IRν: 3 361, 3 298, 3 199(N-H), 1 624 (C=N) cm-1。
(3)5的合成(以5a为例)
在反应瓶中加入4140 mg(0.5 mmol),无水乙醇30 mL及水杨醛0.063 mL(0.6 mmol),搅拌下回流反应至终点(TLC跟踪)。减压浓缩,残余物经硅胶柱层析[洗脱剂:V(乙酸乙酯) ∶V(石油醚)=1 ∶2]分离得5a。用类似的方法合成5b~5q。
1.3 抑菌活性测试
采用菌丝生长速率法[12]测试了5a~5q对小麦赤霉菌,辣椒枯萎菌和苹果腐烂菌的抑菌活性,并以等量的二甲基亚砜为空白对照,恶霉灵为药剂对照,每个浓度重复3次。用下式计算抑菌率。

2 结果与讨论
5的实验结果和元素分析数据见表1,光谱数据见表2和表3,抑菌活性数据见表4。从表2和表3可见,5a~5b的N-H的伸缩振动峰在3 440 cm-1左右,亚胺C=N伸缩振动峰在1 620 cm-1左右。在1H NMR谱图中,部分目标化合物的CH3信号峰未出现,这是与DMSO-d6中残余溶剂峰重合所致。在13C NMR谱图中,所有目标化合物在15左右均出现CH3信号峰。
在已报道的肼解反应中多以乙醇为溶剂[13,14],但本文在合成4时若以乙醇为溶剂则反应副产物较多,后处理繁琐;改用甲苯作溶剂后,副产物减少,收率由文献的28%提高至70%。
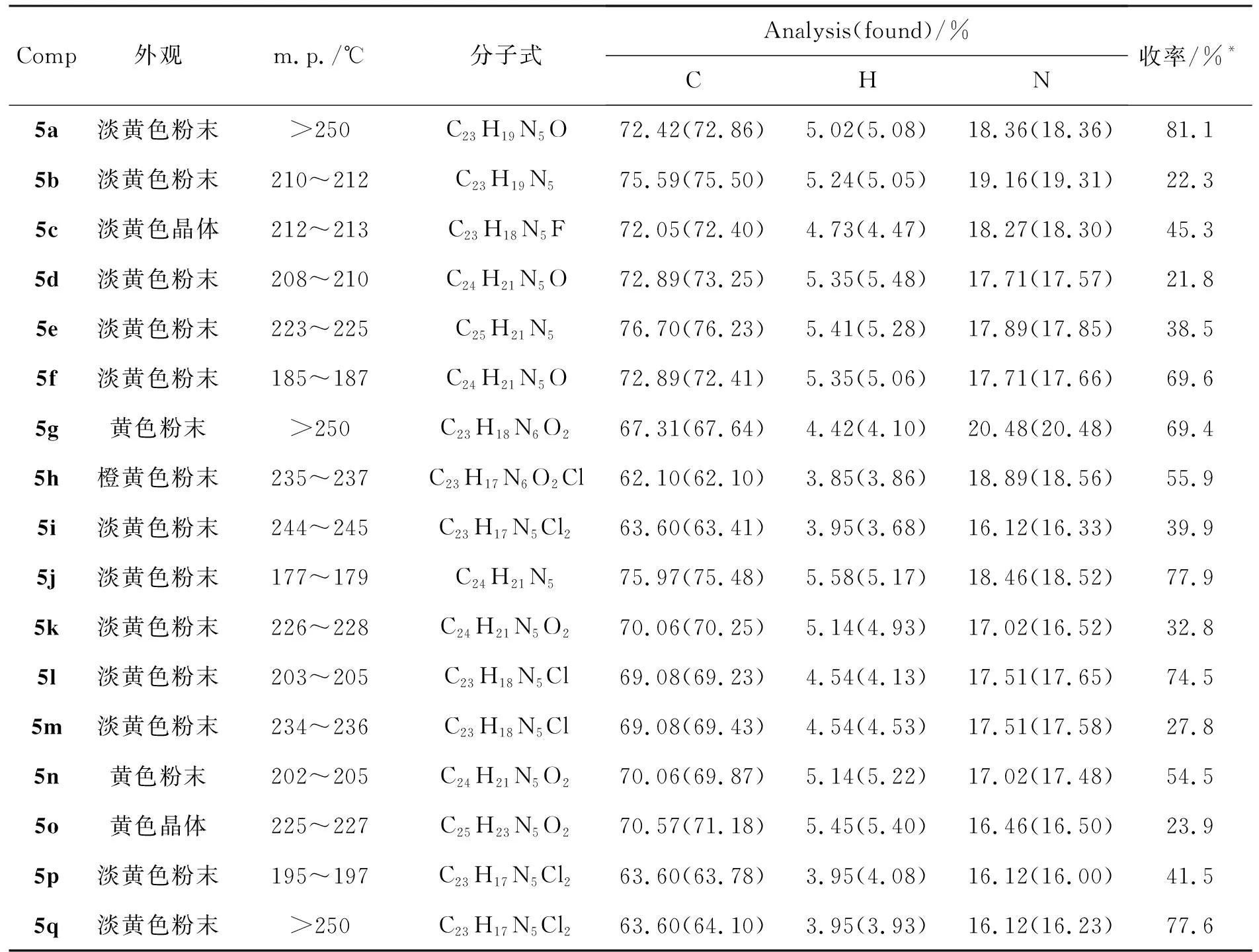
表1 5的实验结果与元素分析数据Table 1 Experimental results and elemental analysis data of 5
*5a,5d,5e,5f,5i~5l,5n和5p用硅胶柱层析纯化;5b,5c,5g,5h,5m,5o和5q用乙醇重结晶纯化

表2 5的NMR数据*Table 2 NMR data of 5
续表2

Comp1H NMR δ(J/Hz)13C NMR δ5d2.56(s, 3H), 3.87(s, 3H), 6.97(d, J=8.1, 2H), 7.60(t, J=7.5, 2H), 7.82(t, J=8.9, 3H), 7.87(d, J=8.6, 2H), 7.92^7.96(m, 2H), 8.00(d, J=8.6, 2H), 8.44(s, 1H), 8.84(s, 1H)15.2, 55.5, 114.3, 115.3, 120.3, 121.0, 126.9, 127.7, 127.9, 129.2, 130.1, 133.2, 134.4, 139.9, 150.2, 154.9, 157.3, 158.1, 161.9, 163.95e2.46(s, 3H), 7.25(t, J=9.2, 2H), 7.38(d, J=7.5, 1H), 7.43(t, J=7.5, 2H), 7.68(d, J=7.5, 3H), 7.83(d, J=8.1, 1H), 7.90(t, J=7.5, 1H), 7.99(d, J=8.6, 2H), 8.06(d, J=9.2, 2H), 8.33(d, J=8.6, 1H), 8.62(d, J=8.0, 1H), 8.68(s, 1H), 9.98(s, 1H)15.1, 115.8, 121.9, 123.6, 126.4, 126.9, 127.7, 128.0, 128.4, 129.5, 129.9, 132.9, 133.7, 136.3, 141.8, 142.8, 150.3, 154.8, 158.1, 160.9, 163.75f3.90(s, 3H), 7.07(t, J=7.5, 1H), 7.16(d, J=8.0, 1H), 7.50(t, J=7.7, 1H), 7.69(t, J=7.5, 1H), 7.83(d, J=8.6, 1H), 7.90(t, J=7.7, 1H), 8.01(d, J=9.2, 2H), 8.06(d, J=7.5, 3H), 8.62(d, J=8.1, 1H), 8.69(s, 1H), 8.78(s, 1H), 9.98(s, 1H)14.7, 55.9, 112.5, 115.6, 121.3, 121.9, 122.8, 123.6, 127.0, 127.1, 127.7, 128.4, 133.0, 133.1, 133.7, 141.8, 150.3, 153.6, 154.9, 158.1, 159.1, 164.05g7.69(t, J=7.7, 1H), 7.83(d, J=8.0, 1H), 7.90(t, J=7.8, 1H), 8.03(d, J=8.6, 2H), 8.09(d, J=8.1, 2H), 8.16(d, J=7.4, 2H), 8.35(d, J=7.5, 2H), 8.62(d, J=8.1, 1H), 8.64(s, 1H), 8.70(s, 1H), 9.99(s, 1H)15.4, 115.8, 121.8, 123.6, 124.6, 127.0, 127.9, 128.5, 129.6, 132.5, 133.7, 141.0, 142.2, 148.9, 150.3, 154.8, 156.0, 158.0, 164.85h2.54(s, 3H), 7.69(t, J=7.4, 1H), 7.83(d, J=8.1, 1H), 7.90(d, J=8.7, 2H), 8.05(d, J=9.2, 2H), 8.10(d, J=8.6, 2H), 8.32(d, J=9.2, 1H), 8.62(d, J=8.6, 1H), 8.70(s, 1H), 8.77(s, 1H), 8.84(s, 1H), 10.00(s, 1H)15.5, 115.8, 121.8, 122.9, 123.6, 126.7, 127.0, 128.1, 128.4, 132.2, 132.3, 133.3, 133.7, 140.6, 142.4, 147.2, 150.3, 152.4, 154.8, 158.0, 165.75i2.52(s, 3H), 7.51(t, J=8.0, 1H), 7.69(t, J=7.4, 1H), 7.80^7.84(m, 2H), 7.90(t, J=7.7, 1H), 8.03(d, J=8.6, 2H), 8.09(d, J=8.6, 2H), 8.15(d, J=8.1, 1H), 8.62(d, J=8.1, 1H), 8.70(s, 1H), 8.78(s, 1H), 9.99(s, 1H)15.4, 108.0, 115.8, 121.8, 123.6, 127.0, 127.3, 128.0, 128.4, 129.1, 132.4, 133.0, 133.1, 133.7, 134.4, 142.2, 150.3, 153.9, 154.9, 158.0, 165.35j2.38(s, 3H), 7.29(d, J=7.5, 1H), 7.32(d, J=8.0, 2H), 7.66^7.70(m, 1H), 7.79(d, J=7.5, 2H), 7.84(s, 1H), 8.00(d, J=8.6 Hz, 2H), 8.06(d, J=8.6, 2H), 8.50(s, 1H), 8.62(d, J=8.0, 1H), 8.69(s, 1H), 9.98(s, 1H)15.2, 21.7, 115.8, 121.9, 123.6, 127.0, 127.6, 128.6, 128.7, 129.7, 130.0, 132.3, 133.0, 133.7, 141.4, 150.3, 154.9, 158.1, 158.3, 163.95k2.52(s, 3H), 3.86(s, 3H), 6.89(d, J=8.0, 1H), 7.30(d, J=8.0, 1H), 7.50(s, 1H), 7.68(t, J=7.4, 1H), 7.83(d, J=8.0, 1H), 7.90(t, J=7.5, 1H), 7.99(d, J=9.2, 2H), 8.05(d, J=9.2, 2H), 8.43(s, 1H), 8.62(d, J=8.0, 1H), 8.68(s, 1H), 9.70(s,1H), 9.98(s, 1H)15.1, 56.1, 111.0, 115.7, 116.1, 121.9, 123.6, 123.7, 126.5, 127.0, 127.5, 128.5, 133.2, 133.7, 141.6, 142.9, 148.4, 150.3, 154.9, 158.1, 158.1, 163.35l2.53(s, 3H), 7.49(t, J=7.5, 1H), 7.54(t, J=6.9, 1H), 7.60(d, J=8.0, 1H), 7.69(t, J=6.9, 1H), 7.83(d, J=8.6, 1H), 7.90(t, J=7.7, 1H), 8.03(d, J=9.2, 2H), 8.08(d, J=9.2, 2H), 8.18(d, J=8.0, 1H), 8.62(d, J=8.0, 1H), 8.69(s, 1H), 8.77(s, 1H), 9.99(s, 1H)15.4, 115.8, 121.8, 123.6, 127.0, 127.9, 128.2, 128.4, 128.6, 130.6, 131.9, 132.6, 132.9, 133.7, 134.6, 142.1, 150.2, 154.0, 154.9, 158.1, 165.0
续表2

Comp1H NMR δ(J/Hz)13C NMR δ5m7.58(d, J=8.6, 2H), 7.68(t, J=7.7, 1H), 7.83(d, J=8.6, 1H), 7.89(d, J=6.9, 1H), 7.92(d, J=8.6, 2H), 8.00(d, J=9.2, 2H), 8.07(d, J=9.2, 2H), 8.54(s, 1H), 8.62(d, J=8.1, 1H), 8.69(s, 1H), 9.98(s, 1H)15.2, 115.8, 121.9, 123.6, 127.0, 127.7, 128.4, 129.5, 130.3, 130.6, 132.8, 133.7, 133.9, 135.9, 141.9, 150.3, 154.9, 158.1, 164.35n3.84(s, 3H), 7.03(d, J=8.6, 1H), 7.26(d, J=8.6, 1H), 7.43(s, 1H), 7.68(t, J=8.3, 1H), 7.83(d, J=8.2, 1H), 7.90(t, J=7.2, 1H), 7.99(d, J=8.6, 2H), 8.05(d, J=9.2, 2H), 8.41(s, 1H), 8.62(d, J=8.0, 1H), 8.69(s, 1H), 9.34(s, 1H), 9.97(s, 1H)15.1, 56.2, 112.3, 114.8, 115.8, 121.9, 122.2, 123.6, 126.9, 127.5, 127.9, 128.4, 133.2, 133.7, 141.6, 147.3, 150.3, 151.0, 154.9, 158.1, 158.5, 163.45o2.46(s, 3H), 3.79(s, 3H), 3.80(s, 3H), 7.04(d, J=8.6, 1H), 7.36(d, J=6.9, 1H), 7.49(s, 1H), 7.64(t, J=7.2, 1H), 7.79(d, J=8.1, 1H), 7.85(t, J=6.8, 1H), 7.95(d, J=8.6, 2H), 8.01(d, J=8.6, 2H), 8.42(s, 1H), 8.58(d, J=8.0, 1H), 8.64(s, 1H), 9.93(s, 1H) 15.2, 55.9, 56.2, 109.9, 112.0, 115.7, 121.9, 123.5, 123.6, 126.9, 127.6, 127.8, 128.4, 133.3, 133.9, 141.8, 149.5, 150.3, 151.9, 154.9, 158.0, 158.4, 163.65p2.48(s, 3H), 7.51(t, J=8.0, 1H), 7.63(d, J=8.0, 2H), 7.69(t, J=7.5, 1H), 7.84(d, J=8.6, 1H), 7.90(t, J=7.5, 1H), 8.02(d, J=8.1, 2H), 8.09(d, J=8.0, 2H), 8.59(s, 1H), 8.63(d, J=8.6, 1H), 8.70(s, 1H), 10.01(s, 1H)15.7, 115.9, 121.9, 123.6, 126.8, 127.9, 128.3, 129.8, 130.9, 132.3, 132.3, 133.7, 134.7, 142.2, 150.2, 152.8, 154.9, 158.1, 164.55q7.64(t, J=7.4, 1H), 7.74(d, J=8.6, 1H), 7.79(d, J=7.5, 1H), 7.86(t, J=6.0, 2H), 7.96(d, J=8.6, 2H), 8.03(d, J=8.2, 2H), 8.08(s, 1H), 8.48(s, 1H), 8.57(d, J=8.0, 1H), 8.64(s, 1H), 9.95(s, 1H)15.3, 115.8, 121.8, 123.6, 127.0, 127.8, 128.3, 128.4, 130.2, 131.7, 132.3, 132.6, 133.7, 133.8, 135.8, 142.0, 150.3, 154.9, 155.8, 158.1, 164.7
*5d以CDCl3为溶剂,其余以DMSO-d6为溶剂
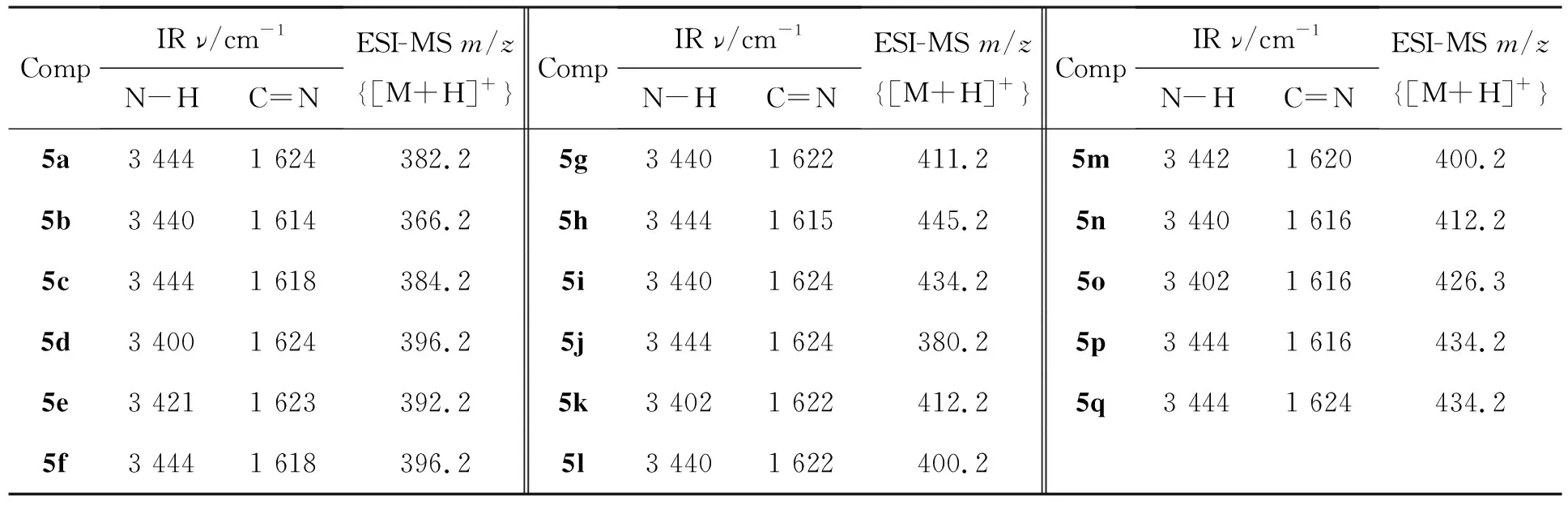
表3 5的IR和ESI-MS数据Table 3 IR and ESI-MS data of 5
从表4可知,部分目标化合物对所测真菌有一定的抑制活性。其中,5f对辣椒枯萎菌的抑制率为36%,5e对小麦赤霉菌的抑制率为38%。5e,5f,5k和5p对小麦赤霉菌的抑制率在28%~38%,但所有化合物对苹果腐烂菌的抑制活性都很差(除5f外)。初步的构效关系研究表明,芳环上取代基的推拉电子效应对目标化合物的抗菌活性没有规律性的影响。

表4 5的抑菌活性*Table 4 Fungicidal activities of 5
*c=50 μg·mL-1
3 结论
以邻氨基苯甲酸为起始原料,设计并合成了17个新型的双腙基喹唑啉类衍生物。初步抗菌活性测试结果表明,部分化合物对小麦赤霉菌、辣椒枯萎菌和苹果腐烂菌有一定的抑制活性。
[1] 马耀,刘芳,宋宝安,等. 6-溴-4-烃硫基喹唑啉类化合物的合成及抑菌活性研究[J].有机化学,2008,28(7):1268-1272.
[2] Chen Z, Venkatesan A M, Dehnhardt C M,etal. 2,4-Diamino-quinazolines as inhibitors ofβ-catenin/Tcf-4 pathway:Potential treatment for colorectal cancer[J].Bioorg Med Chem Lett,2009,19:4980-4983.
[3] Dimauro E F, Newcomb J, Nunes J J,etal. Discovery of aminoquinazolines as potent,orally bioavailable inhibitors of Lck:Synthesis,SAR,and in vivo anti-inflammatory activity[J].J Med Chem,2006,49:5671-5686.
[4] Madapa S, Tusi Z, Batra S,etal. Search for new pharmacophores for antimalarial activity.part II:synthesis and antimalarial activity of new 6-ureido-4-anilinoquinazolines[J].Bioorg Med Chem,2009,17:222-234.
[5] 汪飞,曹瑾,袁莉萍,等. 新型腙类衍生物的合成及其生物活性[J].农药学学报,2006,8(2):176-179.
[6] 王道林,徐姣,韩珊,等. 新型薁类-1-酰腙化合物的合成及抗菌活性研究[J].有机化学,2008,28(11):2016-2019.
[7] Seitzberg J G, Knapp A E, Olsson R,etal. Discovery of potent and selective small-molecule PAR-2 agonists[J].J Med Chem,2008,51(18):5490-5493.
[8] Morgan L R, Thangaraj K, Leblanc B,etal. Design,synthesis,and anticancer properties of 4,4′-dihydroxybenzophenone-2,4-dinitrophenylhydrazone and analogues[J].J Med Chem,2003,46(21):4552-4563.
[9] 孙亚栋,解正峰,刘方明,等. 新型双缩硫代对称二氨基脲类衍生物的合成和生物活性测试[J].有机化学,2008,28(5):889-893.
[10] 刘刚,宋宝安,桑维军,等.N-取代芳环-4-氨基喹唑啉类化合物的合成及生物活性研究[J].有机化学,2004,24(10):1296-1299.
[11] 陈惠,姜茹,孙晓莉. 合成五种喹唑啉类EGFR-TK抑制剂的新方法[J].第四军医大学学报,2004,25(7):613-615.
[12] 孔凡彬,高扬帆,陈锡岭,等. 9种药剂对玉米小斑病菌的室内抑菌试验[J].广西农业科学,2006,37(2):148-149.
[13] 刘成荡,夏旭建,郁林军,等.N′-取代-4-卤代-N-甲基-4′-甲烷磺酰氨基二苯甲酮腙衍生物的合成与生物活性[J].农药,2007,46(2):97-102.
[14] 马文,张胜义,金葆康,等. 芴酮-芳香醛-双腙的合成、晶体结构及光限幅性能[J].化学试剂,2009,31(8):591-594.
