高致病性猪繁殖与呼吸综合征病毒分离株HLJ-09感染仔猪的组织病理学和电镜观察
2011-11-22姜晓晨刘业兵王晶钰宁宜宝
姜晓晨,刘业兵,王晶钰,张 磊,宁宜宝
(1.西北农林科技大学动物医学院,陕西杨凌712100;2.中国兽医药品监察所,北京海淀100081)
猪繁殖与呼吸综合征(PRRS)是由猪繁殖与呼吸综合征病毒(PRRSV)引起的一种猪的高度接触性传染病,不同年龄、品种和性别的猪均能感染,但以妊娠母猪和1月龄以内的仔猪最易感。该病以母猪流产、死胎、弱胎、木乃伊以及仔猪呼吸困难、败血症、高死亡率等为主要特征。该病1987年在美国北卡罗来纳州首先被发现[1],然后迅速向世界各地蔓延,给养殖业带来了巨大的经济损失。到目前为止,世界上仅有少数几个国家没有该病的发生与流行,如瑞典[3]、新西兰[3]、澳大利亚[4]等国家。
自2006年以来,以猪体温升高、皮肤发红和呼吸急促等主要临床症状,剖检变化以弥散性、间质性肺炎为突出特征的传染病,最主要的病原为高致病性变异的猪繁殖与呼吸综合征病毒[5-6]。2009年在河南某发病猪场采集病料,实验室病原检测后确诊为猪繁殖与呼吸综合征病毒。为了研究分离的HLJ-09的致病力,进行人工攻毒试验,观察攻毒后的猪临床症状变化,再从微观角度深入的观察分析该毒株引起试验猪各器官组织病理变化,同时在电子显微镜下观察该毒株的形态及大小,并与马国文、欧德渊、马春霞等人报道的病理学变化进行比较。
1 材料与方法
1.1 试验动物 7只60日龄的SPF猪,经血清学检测和分子生物学检测,猪瘟、圆环病毒、细小病毒、猪繁殖与呼吸综合征、伪狂犬病等病原和抗体均为阴性。
1.2 毒株 PRRSV HLJ-09株,本实验室2009年利用MARC-145细胞自猪高热综合征发病猪分离、鉴定(另文报道)。
1.3 动物接种与观察 随机选取其中的5头猪,每头猪接种PRRSV H LJ-09株病毒液3 mL(F4病毒含量为:10-6.4 TCID50/0.1 mL),其中滴鼻2 mL,肌肉注射1 mL,其余两头作为对照。
接种后,每天测定体温,并观察其临床症状,剖检发病猪或频死期的猪,观察病变及采取组织样品。
1.4 组织切片的制备 剖检接毒后的发病猪或频死期的猪 ,采取心脏、肝脏、脾脏、肺脏、肾脏、脑、小肠、肠系膜淋巴结等,放入戊二醛固定液中固定48 h,常规包埋、切片(5μm),H.E.染色,OLYMPUS CX31光学显微镜下观察。
1.5 电镜标本的制备 濒死期猪剖杀后立即取出部分肺组织修切为1 mm3大小的组织块,经0.1 mol/L磷酸缓冲液配制的4%戊二醛和1%锇酸双重固定,梯度丙酮脱水,环氧树胶包埋。超薄切片,厚约为 50 nm,醋酸双氧铀、柠檬酸铅双重染色,GEOL-1230透射电镜观察。
2 结果
2.1 临床及剖检病理变化 临床表现:攻毒后,猪体温升高,于攻毒后4 d体温高于40℃,6 d后体温高于 41℃,分别于攻毒后 6、8、9、11、12 d 死亡 ;攻毒后,猪开始出现扎窝,眼角有脓性分泌物,食欲减退或废绝,拉稀,呼吸困难,身上有出血斑,耳朵发绀,猪体消瘦,死亡前有划水样神经症状。对照组正常。
剖检:肺脏有肉变,肠道有出血,淋巴结肿大,脾脏有出血点、梗死,心包有积液,肾脏有出血点。对照组正常。
2.2 组织病理学观察 在显微镜的检查发现,心、肝、脾、肺、肾、脑、淋巴结、肠等发生程度不同的组织病理学变化,而对照组一切正常。具体如下:
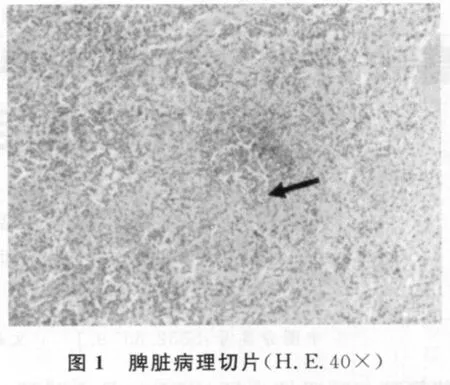
脾脏(图1):大量淋巴细胞坏死后残留大片细胞碎片,局部白髓基本消失,出血,含铁血黄素沉着(实心箭头)。
淋巴结(图2):大量淋巴细胞坏死排空,呈星空样变(实心箭头),可见多量细胞碎片。
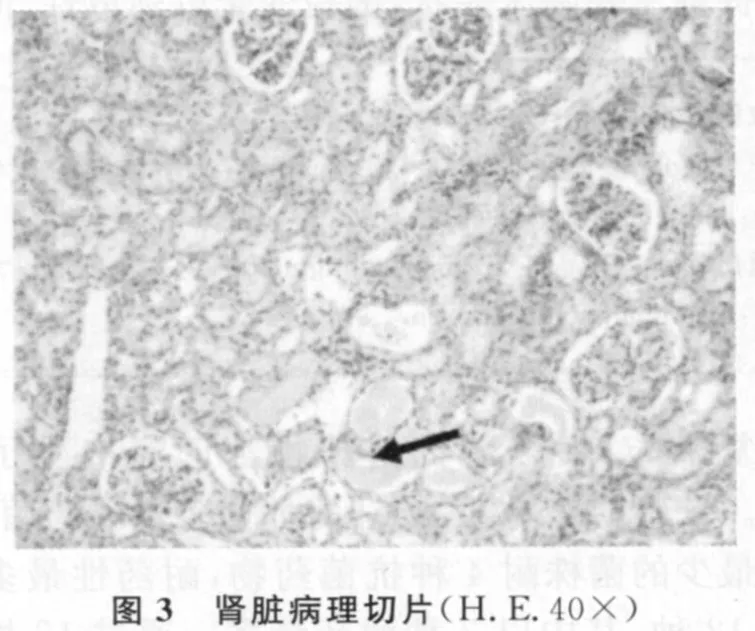
肾脏(图3):肾小管上皮细胞变性坏死、脱落,有些肾小管中可见蛋白管型(实心箭头)。
心肌(图4):心肌纤维可见出血(实心箭头)。
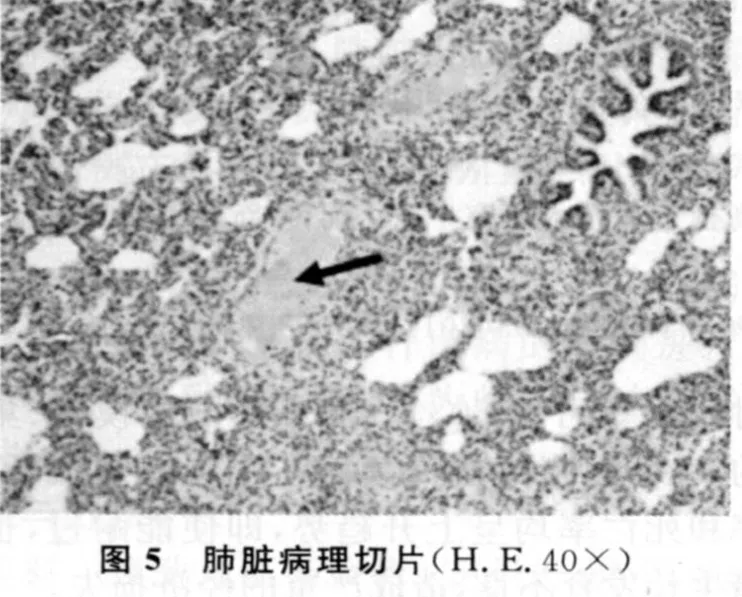
肺脏(图5):肺泡壁极度增厚,间质及肺泡中可见大量炎性细胞浸润,严重充血、淤血。具有猪繁殖与呼吸综合征的典型病理变化特征,如肺脏的间质性肺炎(实心箭头)。
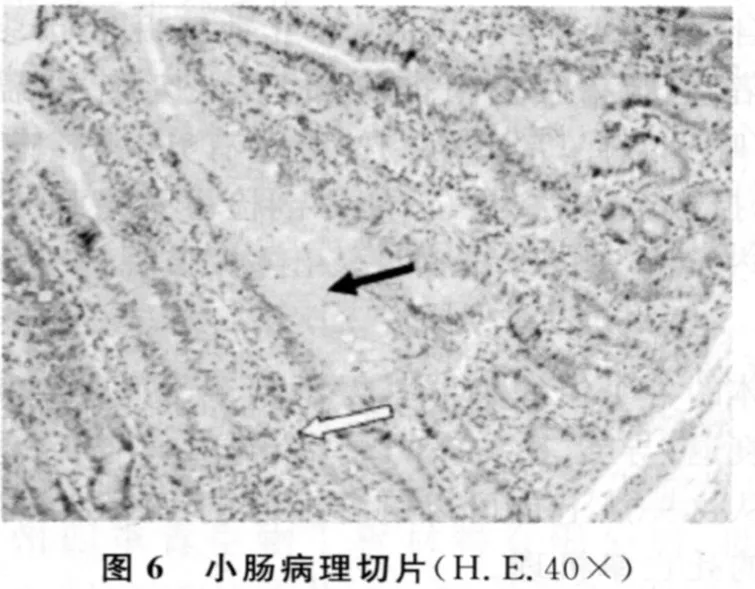
小肠(图6):绒毛之间充满大量浆液性分泌物,杯状细胞增多(实心箭头),黏膜上皮细胞变性坏死,固有层有少量嗜酸性粒细胞浸润(空心箭头)。
肝(图7):大量肝细胞变性坏死,中央静脉淤血(空心箭头),汇管区可见淋巴细胞浸润(实心箭头)。
脑(图8):脑的小静脉、毛细血管等均充血、淤血,灰质弥散性受损,神经细胞空泡化,在较多的脑组织中能见“嗜神经”现象(实心箭头)。神经细胞水肿、坏死。有的有胶质性结节存在。


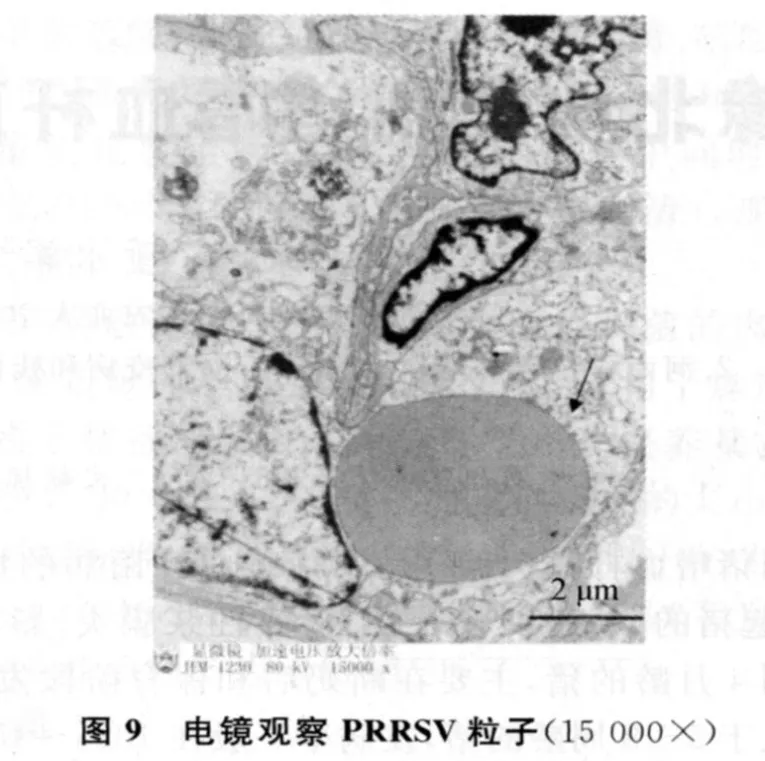
2.3 电镜观察 在电镜下观察到肺泡细胞胞浆内两个PRRSV粒子,椭圆形,大小为55 nm左右(见图 9、10)。


3 讨论
组织病理学损害是病原体直接导致宿主死亡的原因。那么变异的PRRSV引起被感染猪的高死亡率是否与其引起的病理学变化相关呢?

关于PRRSV引起的猪病理学变化已有相关报道。Joan Plana[7]、Polo[8]等分别对人工及自然感染PRRSV仔猪的组织样本经光学和电子显微镜检查发现,感染仔猪肺组织病变在大多数病例广泛存在且呈现该病的特征性病变,有时在心、肾、淋巴结、脑、肝等器官也发生程度不同的组织学病变。马国文[9]等则较为细致的报道猪感染PRRSV引起的多种组织的病理变化。组织病理学观察表明,PRRSV导致心脏血循环障碍和心肌细胞损害,进一步引起这些组织和细胞的变性,最终导致了心脏功能降低,心力衰竭。病毒随着血液循环透过血脑屏障侵入脑血管的内皮细胞引起广泛性的血管炎,致使静脉血管扩张、内皮细胞肿胀或毛细血管中形成血栓,可引起神经细胞变性、出血、坏死及胶质细胞增生;对全身淋巴结和脾的损伤.也因其含有丰富的血管和巨噬细胞而比较严重,病毒在巨噬细胞内复制并破坏其结构同时又引起广泛性的血管炎和造成其他组织的破坏,从而形成脾广泛性的坏死和淋巴结的严重破环,致使免疫系统遭受严重损伤,这些变化是相继发生的,机体最终因为心脏、肺脏、脑等各个器官的衰竭、免疫功能的丧失而造成死亡。
本试验中,我们利用分离到的变异PRRSV感染SPF猪,并对感染猪进行剖检,对病变组织进行了免疫组化分析及电镜观察。电镜结果显示:病毒粒子的大小55nm,这一结果符合前人报道的50~64 nm,病毒粒子形态大小与前人一致。本试验中发现变异的PRRSV引起的各个组织的病理变化除具有典型的PRRS的症状外,与以前的报道[10-11]相比,各个组织和器官的病理变化要严重得多,如最不容易受到侵害的脑组织出现了病毒性脑炎的数个典型性病变,如出血、血栓形成和袖套现象等典型的病理变化。另外,在试验中心肌的变化也较为典型,心肌出血和淋巴细胞浸润在组织切片中随处可见,这可能与变异的PRRSV引起的高热有关系(体温高达41℃)。
在本次的试验结果看,PRRSV感染后对肺组织的损伤最为严重,肺泡毛细血管充血,肺泡内充满浆液性渗出物,以及数量不等的炎性细胞;肺泡中隔被弥散性的炎性细胞浸润,有的挤压肺泡,造成肺泡体积减少;有的肺泡扩张,肺泡壁断裂;血管中有血栓形成。小叶间质水肿、坏死,以及存在炎性细胞浸润。呼吸性细支气管上皮细胞脱落。这些损伤导致了肺脏呼吸功能的减弱并逐步丧失呼吸功能,导致猪只呼吸困难,最后因呼吸困难而死亡;肺脏的毛细血管内微血栓和血栓的形成,导致对肺脏供血出现障碍,肺脏得不到氧和营养物质的供应,进一步引起肺脏呼吸功能的衰竭;同时肺脏的毛细血管内微血栓和血栓的形成,引起氧和二氧化碳的交换障碍,导致机体的各个组织和器官得不到氧气而引起机体功能的衰退,导致多系统的衰竭,进一步导致猪的死亡。从这一点上也可以解释变异的PRRSV引起这么高的死亡率机理。
[1] Keffaber K K.Reproductive failure of unknown etiolog[J].ASSP Newslett,1989(1):1-9.
[2] Elvander M L.Nationwide surveys of TGE/PRCV,CSF,PRRS,SDV,L.Pomona and B.suis in pigs in Sweden[J].Epidemiol Sante Anim,1997,39(7b):31-32.
[3] Motha J S.New Zealand is freefrom PRRS,TGE and PRRSV[J].Surveillance,1997(24):10-11.
[4] Garner M G,Gleeson L J,Holyoake PK,etal.A national serological survey to verify Australia's freedom from porcine reproductive and respiratory syndrome[J].Aust Vet J,1997,75(8):596-600.
[5] Kegong Tian,Xiuling Yu,Tiezhu Zhao,et al.Emergence of Fatal PRRSV Variants:Unparalleled Outbreaks of Atypical PRRSin China and Molecular Dissection of the Unique Hallmark[J].PLoS ONE,2007(6):1-10.
[6] 张青娴,王克领,张立宪,等.高致病性蓝耳病的研究进展[J].中国畜牧兽医,2008(9):105-107.
[7] Collins JE,Benfield D A,Christianson W T,et al.Isolation of swine infertility and respiratory syndrome virus(isolate ATCC V R-2332)in North America and experimental rep roduction of the disease in gnotobiotic pigs[J].J Vet Diagn Invest,1992(4):117-126.
[8] Pol J M,van Dijk J E,Wensvoort G,et al.Pathological,ultrastructural,and immunohistochemical changes caused by Lelystad virus in experimentally induced infections of mystery swine disease(synonym:p orcine epidemic abortion and respiratory syndrome(PEARS)[J].The Vet Quarterly,1991.(3):13137-13143.
[9] 马国文,霍晓伟,马德惠,等.猪生殖和呼吸综合征病理学观察[J].中国兽医科技,1999,29(5):42-43.
[10]欧德渊,李诗举,王群辉,等.高致病性猪蓝耳病的病理学观察[J].贵州畜牧兽医,2008(6):3-4.
[11]马春霞,陈泽祥,许力干,等.高致病性猪蓝耳病自然病例病理学变化[J].当代畜牧,2009(9):12-13.
