小鼠神经元中CCK8与EGF协同作用的初步研究*
2011-11-20刘晓燕梅志强
李 娟, 王 丽, 陈 熔, 刘晓燕, 梅志强, 何 涛
(泸州医学院医学分子生物学实验室,四川 泸州 646000)
小鼠神经元中CCK8与EGF协同作用的初步研究*
李 娟, 王 丽, 陈 熔, 刘晓燕, 梅志强, 何 涛△
(泸州医学院医学分子生物学实验室,四川 泸州 646000)
目的探讨八肽胆囊收缩素(CCK8)与表皮生长因子(EGF)在神经元信号转导中的交叉对话(cross-talk)及可能存在机制,并对CCK8与EGF的协同作用进行初步研究。方法CCK8刺激表皮生长因子受体(EGFR)磷酸化的受体类型分析:培养的乳小鼠神经元随机分为对照组(等量的DMEM培养基)、CCK8刺激组(10-7mol/L)、CCKA受体拮抗剂L364 718组、CCKB受体拮抗剂L365 260组以及L364 718+L365 260联合组(浓度均为10-8mol/L),拮抗剂加入10 min后再给予CCK8,作用5 min后收集细胞提取蛋白,Western blotting检测磷酸化表皮生长因子受体(p-EGFR)蛋白表达量的变化;CCK8与EGF对神经元EGFR磷酸化状态的影响和CCK8与EGF协同作用功效分析:培养的乳小鼠神经元随机分为对照组、CCK8(10-7mol/L)组、EGF(40 μg/L)组以及CCK8+EGF组,药物作用5 min后终止反应,处理和分析方法同前,同时通过MTT法检测各组神经元培养不同时间(24、48、72、96 h)后细胞的生长活性。结果(1)2种CCK受体拮抗剂均可降低EGFR蛋白的磷酸化水平,其中A型受体拮抗剂的作用明显强于B型,2种拮抗剂同时作用对EGFR蛋白磷酸化水平的降低作用更为明显;(2)CCK8和EGF分别刺激神经元后,EGFR的磷酸化水平均增强,但CCK8+EGF刺激后表现更为显著;(3)CCK8与EGF联用对增强神经元生长活性和延长其存活时间的作用较两药单独作用效果更为明显(Plt;0.05)。结论(1)CCKA和CCKB受体均介导了CCK8激活EGFR磷酸化的信号转导途径,但A型受体发挥了更为重要的作用;(2)CCK8与EGF信号转导途径之间存在着cross-talk;(3)CCK8与EGF可能通过信号转导的cross-talk协同促进小鼠神经元的生长与存活。
胆囊收缩素; 神经元; 受体, 表皮生长因子
胆囊收缩素 (cholecystokinin, CCK)作为一种典型的脑肠肽,在神经系统功能调节中起着重要的作用,其在神经元中的信号转导将对了解脑的结构与功能、阐明某些中枢神经系统疾病的发病机理具有重要意义,因而近年来已成为备受关注的领域。目前研究表明,CCK具有神经保护作用,是一种内源性的神经保护因子,但有关CCK在神经系统的作用机制还不明了。本研究组前期研究结果显示, 八肽胆囊收缩素(cholecystokinin octapeptide,CCK8)刺激神经元后,表皮生长因子受体(epidermal growth factor receptor,EGFR)底物15磷酸化水平增高,进一步的分析表明,CCK8能促进EGFR磷酸化水平显著升高,提示CCK与表皮生长因子(epidermal growth factor,EGF)之间可能存在着复杂的“信息相互交谈”(cross-talk)[1]。本研究在此基础上拟通过CCK受体抑制实验分析培养的小鼠神经元中介导EGFR磷酸化水平改变的受体类型,初步探讨CCK8与EGF在神经元信号转导中的相互作用,并观察CCK8与EGF协同作用的功能效应,为阐明CCK在中枢神经系统中的作用提供重要线索。
材 料 和 方 法
1材料
1.1动物 昆明种封闭群乳小鼠(SPF级),由泸州医学院实验动物中心提供。
1.2主要实验试剂 Neurobasal-A medium+B27 supplement购自Gibco;CCK8购自Sigma;EGF购自Peprotech EC;磷酸化EGFR(phospho-EGFR,p-EGFR)抗体购自CST;抗β-actin抗体、彩色预染蛋白质分子量标准和Western封闭液均购自碧云天生物技术研究所;HRP标记羊抗兔IgG购自北京中杉;SuperSignal® West Pico Chemiluminescent Substrate购自Millipore;CCK受体抑制剂L364 718和L365 260由第三军医大学西南肝胆研究中心马宽生教授馈赠;其它所用试剂为国产或进口分析纯。
2方法
2.1神经元的培养 取出生1-2 d的小鼠脑组织消化得到单细胞,加入DMEM/F12培养基(含10%胎牛血清)以2×106细胞接种于培养瓶内,置于5% CO2、37 ℃培养,24 h后更换为含Neurobasal-A medium和B27supplement的培养液,以后每 2-3 d换液1次。
2.2CCK受体拮抗剂处理神经元 将培养神经元随机分为对照组、实验组以及受体拮抗剂组。对照组给予等量DMEM培养基,实验组给予CCK8(10-7mol/L)。受体拮抗剂组又分为3组,先分别加入CCKA受体拮抗剂L-364 718、CCKB受体拮抗剂L365 260以及L-364 718+ L365 260,拮抗剂浓度均为10-8mol/L,孵育10 min后,再加入10-7mol/L CCK8孵育5 min,液氮终止反应。
2.3CCK8及EGF处理神经元 培养至第7 d的乳小鼠神经元随机分为对照组、CCK8(10-7mol/L)组、EGF(40 μg/L)组以及CCK8+EGF组,加入对应的药物作用5 min后,倾去培养基,液氮终止反应。
2.4Western blotting检测EGFR磷酸化水平 提取神经元蛋白,Bradford法测蛋白含量,SDS-PAGE电泳后将凝胶上的蛋白转移至PVDF膜上, Western封闭液作用1 h,按Western blotting常规操作进行p-EGFR蛋白的检测,最后SuperSignal化学发光检测试剂进行显影,凝胶化学发光仪器内采集发光图像,同时检测β-actin的表达作为内参照。Gel-Pro Analyzer 4.0凝胶成像软件进行图像分析,结果以累积吸光度比值(IAp-EGFR/IAβ-actin)表示。
2.5细胞形态学观察及MTT法测定细胞活性 培养24 h的神经元分组情况同方法2.3,各组细胞每天在倒置显微镜下做形态学观察。同时96孔培养板内的各组细胞在加入对应药物分别作用24、48、72、96 h后,每孔加入MTT(1.5 g/L)液20 μL,37 ℃孵育4 h,吸去培养液,每孔加入100 μL DMSO,室温振荡10 min,酶联免疫检测仪上于490 nm处测量各孔的吸光度值(A)。实验重复3次,每组实验设3复孔。
3统计学处理
结 果
1不同CCK受体拮抗剂对CCK8刺激EGFR磷酸化的影响
比较对照组、实验组以及CCK受体拮抗剂组的印迹图谱(图1)可见,CCK8刺激后神经元EGFR蛋白磷酸化状态发生明显改变。软件分析结果显示,对照组有p-EGFR蛋白条带的出现(1.153±0.012),说明神经元具有p-EGFR的基础活性;CCK8刺激神经元后 p-EGFR蛋白条带明显加深(1.761±0.046),说明CCK8可使EGFR磷酸化水平明显升高,激活其活性;加入CCKA受体特异拮抗剂L364 718后,EGFR的磷酸化水平明显降低(0.345±0.023),加入CCKB受体特异拮抗剂L365 260后,EGFR的磷酸化水平也出现降低,但是作用较L364 718弱些(0.577±0.037);而同时使用2种抑制剂可导致EGFR蛋白磷酸化水平降低更为明显(0.192±0.013)。以上各组与对照组相比,差异均显著(Plt;0.05)。

Figure 1. Detection of phosphorylated EGFR in neurons with different treatments by Western blotting. ±s.n=3. *Plt;0.05 vs control group.
2CCK8、EGF、CCK8+EGF刺激后EGFR磷酸化的变化
由图2可见,药物作用组EGFR磷酸化水平与对照组比均有明显增高,其中p-EGFR与内参照β-actin的累积吸光度比值在CCK8+EGF组表达量最高(在对照组、CCK8组、EGF组以及CCK8+EGF组比值分别为0.161±0.015、0.210±0.020、0.356±0.021和0.394±0.010),组间比较有显著差异(Plt;0.05)。

Figure 2. Detection of phosphorylated EGFR with different stimuli by Western blotting. ±s.n=3. *Plt;0.05 vs control group.
3CCK8与EGF的协同作用对神经元生长及活性的影响
3.1神经元形态观察 对照组神经元培养至7 d时,生长达到顶峰状态,具有典型的神经元特性,胞体周围有明亮的光晕,突起明显并交织成网络状结构;培养至第9 d,神经元贴壁数量相对减少,部分神经元胞体变大变圆,突起断裂,立体感消失,细胞呈现老化趋势,见图3A;培养至第13 d,神经元贴壁数量明显减少,培养液中可见悬浮细胞,而仍然贴壁的神经元胞体肿胀,细胞突起消失,神经元之间的网络松散,瓶底铺满大量胶原,细胞已老化死亡。药物组在加入CCK8和EGF刺激剂后培养至第9 d时,细胞生长依然旺盛,胞体丰满,折光性强,表现出较好的生长状态,见图3B;培养至第13 d,神经元才开始出现部分神经元胞体变大变圆、突起消失,细胞开始老化。
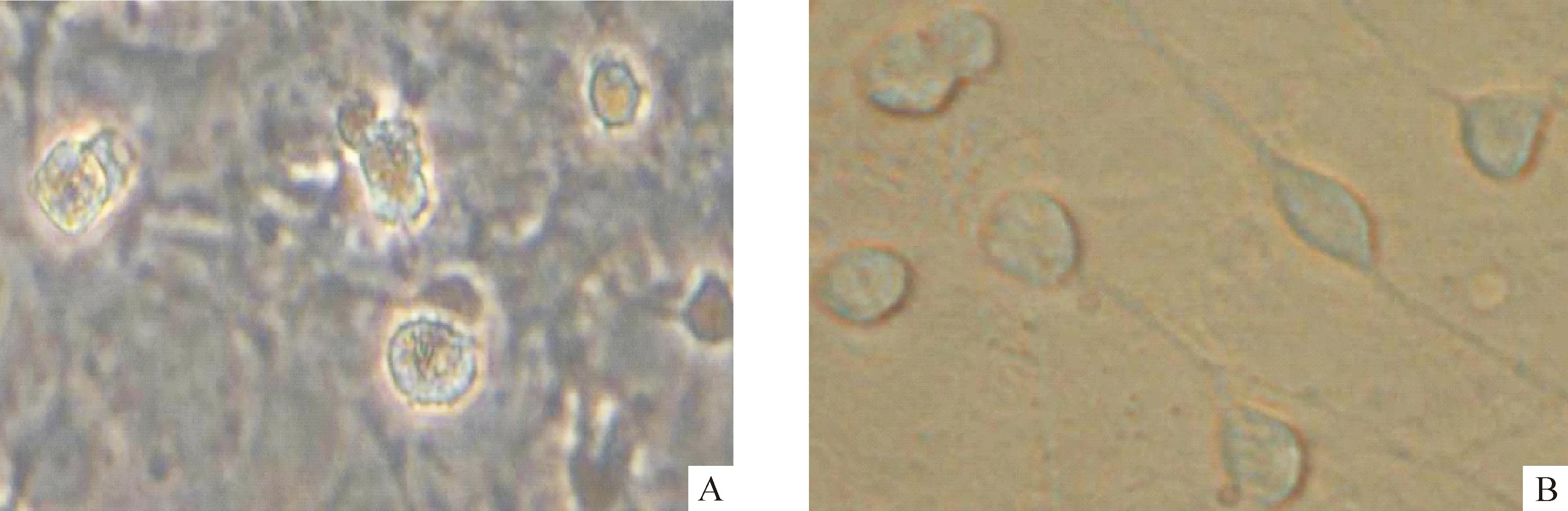
Figure 3. Neurons in control group(A) and CCK8+EGF stimulation group(B) after 9-day culture(×400).
3.2MTT法检测细胞活性 神经元培养24-96 h后,MTT测定结果显示,对照组细胞活性基本一致;3组加药组的神经元在加入刺激剂培养24 h后,细胞活性开始增强,并随着时间的延长,活性增强越来越明显,至96 h时,细胞活性达最高峰,呈现时间依赖性。与对照组比,CCK8+EGF组的神经元活性增强最为显著,见图4。

Figure 4. The growth curves of the neurons treated with CCK8, EGF and CCK8+EGF. ±s.n=9. *Plt;0.05 vs control;△Plt;0.05 vs CCK8 or EGF.
讨 论
CCK发挥生理作用首先需要与靶细胞膜上的特异受体结合,在中枢神经系统CCK受体主要有2种亚型,即CCKA和CCKB受体,两者的分布和介导的功能各有不同,可能是通过不同信号转导机制。国外有研究报道,在胃上皮细胞中,胃泌素通过CCKB/胃泌素受体介导的信号途径激活EGFR酪氨酸磷酸化[2];Piiper等[3]也在AR42J细胞中发现CCK可激活EGFR的活性,引起酪氨酸磷酸化,具体机制不明,可能与ERK1/2的活化有关,提示CCK可能是通过CCKB受体介导的MAPK信号转导途径激活EGFR磷酸化。上述结果显示在胃肠细胞中,CCK与EGF信号系统之间存在着相互作用,且CCKB受体介导的信号转导途径可能参与其中,但在神经系统中二者是否具有信号转导的交叉作用还未见相关报道。
本实验通过CCK特异性受体拮抗剂抑制实验,分析CCK8刺激EGFR磷酸化的受体类型,结果表明神经元中CCK的2种类型受体都介导了CCK8激活EGFR磷酸化的信号转导途径,但CCKA受体介导的信号通路占主导作用。这一结果与已报道的胃肠细胞中的研究结果不一致,其原因可能与神经系统与胃肠道系统的组织特异性有关。
神经元作为一种终末分化细胞,无增殖能力,一旦损伤或破坏,将会永久消失,因此如何增强神经元细胞活性,延长其存活时间一直是脑神经科学的研究热点。近年来,CCK在延缓机体老化进程中所起的作用引起了广泛关注。Sun等[4]应用NBA2细胞无血清培养老化模型,观察应用一定浓度的CCK8后,细胞突起和微突起数量、脂褐素荧光值有明显的改变,推测一定浓度的CCK8在适当作用时间下可以延缓老化的进展。Voits等[5]研究提示CCK在延缓神经细胞老化的过程中发挥了一定的作用。而EGF作为一种神经营养因子,在神经系统中具有重要功能,可促进神经系统的生长发育、神经干细胞的增殖与分化,并参与神经元的氧化性损伤等。Wagner等[6]发现皮质神经元的存活可能依赖EGFR介导的信号转导途径。本研究通过用免疫印迹法检测到在神经元中CCK8可促进EGFR磷酸化,且CCK8与EGF联用可产生一定的协同作用,表明CCK8与EGF在神经元中的信号转导确实存在cross-talk。随后我们用CCK8、EGF分别及协同刺激神经元,通过观察神经元的形态及细胞活性的变化而进一步了解两者间这种信号转导的cross-talk是否具有功能效应。研究结果表明,CCK8和EGF单独作用均可增强神经元活性,延长神经元的存活时间,但CCK8与EGF协同作用更为显著地增强神经元的活性。对于CCK8如何促进EGFR磷酸化的机制有待进一步深入研究,但CCK与神经营养因子EGF之间通过信号转导的交叉对话,协同发挥对神经元的保护作用为神经系统退行性疾病的治疗、干细胞分化后神经元活性的维持等提供了重要的实验依据。
[1] 何 涛,李 娟,王 丽,等. CCKB受体诱发的小鼠神经元蛋白质磷酸化的研究[J]. 中国病理生理杂志, 2008, 24(1):47-50.
[2] Miyazaki Y, Shionmura Y, Tsutsui S, et al. Gastrin induces heparin-binding epidermal growth factor-like growth factor in rat gastric epithelial cells transfected with gastrin receptor[J]. Gastroenterology, 1999, 116(1):78-89.
[3] Piiper A, Elez R, You SJ, et al. Cholecystokinin stimulates extracellular signal-regulated kinase through activation of the epidermal growth factor receptor, Yes, and protein kinase C.Signal amplification at the level of Raf by activation of protein kinase Cε[J].J Biol Chem, 2003, 278(9): 7065-7072.
[4] Sun XJ, Lu QC, Cai Y. Effect of cholecystokinin on experimental neuronal aging[J]. World J Gastroenterol, 2005, 11 (4): 551-556.
[5] Voits M, Hasenöhrl RU, Huston JP,et al. Repeated treatment with cholecystokinin octapeptide improves maze perfomance in aged Fischer 344 rats[J]. Peptides,2001, 22(8):1325-1330.
[6] Wagner B, Natarajan A, Grünaug S, et al. Neuronal survival depends on EGFR signaling in cortical but not midbrain astrocytes[J]. EMBO J, 2006, 25(4): 752-762.
CrosstalkofCCK8andEGFinmouseneurons
LI Juan, WANG Li, CHEN Rong, LIU Xiao-yan, MEI Zhi-qiang, HE Tao
(MolecularBiologyLaboratory,LuzhouMedicalCollege,Luzhou646000,China.E-mail:Hetao198@163.com)
AIM: To explore the mechanism of signaling transduction and cross talk between cholecystokinin octapeptide (CCK8) and epidermal growth factor (EGF) in mouse neurons and to observe the effect of CCK8in coordination with EGF on neuron growth and cell viability.METHODSFor determining which kind of CCK receptor mediated the phosphorylation of EGF receptor, the cultured neurons were randomly divided into control group, CCK8stimulation group, CCKAreceptor antagonist group, CCKBreceptor antagonist group, and CCKA+CCKBreceptor antagonist group. Control and stimulation groups were stimulated with DMEM and CCK8(10-7mol/L) for 5 min, respectively, while antagonist groups were pre-incubated with different types of receptor antagonists (10-8mol/L) for 10 min and followed by stimulating the neurons with CCK8. For observing the effect of CCK8and EGF on the phosphorylation of EGFR in neurons and on neuron growth and cell viability, the cultured neurons were randomly divided into control group, CCK8stimulation group, EGF stimulation group and CCK8+EGF stimulation group, which were stimulated with DMEM, CCK8(10-7mol/L), EGF (40 μg/L) and CCK8+EGF for 5 min, respectively. Reactions were terminated by freezing the neurons in liquid nitrogen and the phosphorylated EGFR was detected by Western blotting. Meanwhile, the viability of the neurons was observed by MTT method after stimulated for 24 h, 48 h, 72 h and 96 h.RESULTSThe phosphorylation levels of EGFR were decreased in the neurons treated with either of the two CCK receptor antagonists, and more obvious decrease was observed when the two CCK receptor antagonists were used in combination. Compared with control group, the phosphorylation levels of EGFR in the neurons were significantly increased(Plt;0.05) after stimulated with CCK8or EGF, and the increase was more remarkable in CCK8+EGF stimulation group. CCK8or EGF improved the viability and prolonged the life span of the neuron, and synergism of these two reagents was observed.CONCLUSIONBoth CCKAand CCKBreceptors are involved in the phosphorylation of EGFR in the neurons stimulated by CCK8, and the type A receptor may play a more important role. There is cross-talk between CCK8and EGF signaling pathways in neurons. The signaling cross-talk between CCK8and EGF may be the underlying molecular mechanism responsible for the synergistic effect on the neuron growth and viabilityinvitro.
Cholecystokinin; Neurons; Receptors, epidermal growth factor
1000-4718(2011)04-0779-04
R322.81
A
10.3969/j.issn.1000-4718.2011.04.030
2010-08-03
2010-12-27
四川省教育厅资助项目(No.2006A053)
△通讯作者 Tel: 0830-3161283;E-mail: Hetao198@163.com
