siRNA下调astrocyte elevated gene-1对神经母细胞瘤细胞增殖和凋亡影响的体外研究
2011-11-20刘海燕姜玉杰孙若鹏
刘海燕, 姜玉杰, 孙若鹏
(山东大学附属省立医院 1儿科,2血液科,山东 济南 250021;3山东大学齐鲁医院儿科,山东 济南 250012)
siRNA下调astrocyte elevated gene-1对神经母细胞瘤细胞增殖和凋亡影响的体外研究
刘海燕1△, 姜玉杰2, 孙若鹏3
(山东大学附属省立医院1儿科,2血液科,山东 济南 250021;3山东大学齐鲁医院儿科,山东 济南 250012)
目的探讨siRNA下调astrocyte elevated gene-1(AEG-1)表达对神经母细胞瘤细胞增殖、凋亡和细胞周期的影响。方法用设计合成的AEG-1 siRNA转染神经母细胞瘤细胞株M17和SK-N-SH,采用荧光定量RT - PCR技术观察AEG-1 siRNA对AEG-1基因表达的影响;用MTT法和克隆形成实验观察AEG-1 siRNA对神经母细胞瘤细胞的增殖抑制作用;用流式细胞术检测下调AEG-1表达对神经母细胞瘤细胞凋亡及细胞周期的影响。结果用AEG-1 siRNA转染人神经母细胞瘤细胞,RT - PCR结果证实AEG-1 siRNA能显著基因下调AEG-1表达,与对照组相比有显著差异(Plt;0.01);MTT法和克隆形成实验结果证明下调AEG-1表达可显著抑制神经母细胞瘤细胞的增殖;流式细胞术检测结果表明下调AEG-1表达可促进神经母细胞瘤细胞凋亡,并将细胞周期阻滞在G0/G1期。结论AEG-1 siRNA可下调基因在神经母细胞瘤细胞中表达,并抑制神经母细胞瘤细胞增殖,促进细胞凋亡。
基因,AEG-1; RNA干扰; 神经母细胞瘤; 细胞凋亡
神经母细胞瘤(neuroblastoma)是起源于神经外胚层的原始神经嵴细胞的原始肿瘤,是继白血病、脑瘤和恶性淋巴瘤之后居于儿童第4位的肿瘤,占所有儿童恶性肿瘤的8%-10%[1]。此病的临床特点多变,可以发展为威胁生命的疾病,也可以自行消退,常常被描述为“神秘莫测”。随着科技的发展,多种检测手段证实某些生物学变量与儿童神经母细胞瘤有关,如:Shimada组织学分级、肿瘤DNA倍性、肿瘤组织内N-myc基因扩增、神经生长因子受体高亲和力基因编码表达酪氨酸激酶(tyrosine kinase ,TRK-A)等。尽管如此,神经母细胞瘤的发生、发展和转移的确切机制还不清楚,更多的关于影响肿瘤发生、发展的基因或生物学标记仍待明确。
Astrocyte elevated gene-1(AEG-1)是Su等[2]在2002年首次克隆出来的新基因,由12个外显子和11个内含子组成,位于8q22,该区域也是人类胶质瘤的高度相关地带。AEG-1 cDNA的全长为3 611bp,包括多聚A尾,开放阅读框架从220到1 986碱基,编码的蛋白由582个氨基酸组成,分子量为64 kD,等电点为9.33[3-5]。
近年来对AEG-1的深入研究发现,它不仅能促进神经退行性变的发生,还能促进肿瘤的进展和转移[6]。最近的研究强烈支持AEG-1是肿瘤的发生发展过程中的一个关键基因,但其在神经母细胞瘤中的表达情况,对神经母细胞瘤的增殖及凋亡的影响还不明确。因此,本课题首次利用RNA干扰技术,研究AEG-1对神经母细胞瘤细胞增殖和凋亡的影响,为神经母细胞瘤的基因治疗提供理论依据。
材 料 和 方 法
1材料和试剂
1.1细胞 人神经母细胞瘤细胞系M17和SK-N-SH购自中国典型培养物保藏中心 (China Centre for Type Culture Collection, CCTCC),单层培养于37 ℃、5% CO2的饱和湿度培养箱中,培养液为含10%胎牛血清(FBS)的DMEM培养液(葡萄糖 4.5 g/L)。
1.2试剂与仪器 Lipofectamine 2000转染试剂盒、总RNA提取试剂Trizol、RT - PCR 试剂盒(大连TaKaRa)。CO2培养箱(NU-3500)、倒置荧光显微镜(Olympus)、荧光定量PCR仪(ABI7000)、流式细胞仪(Beckman Coulter)。
2方法
2.1siRNA设计 根据AEG-1的DNA序列(GenBank Accession No. NC_000008.9)设计出2个siRNA序列(siRNA1,siRNA2)及无关对照序列(上海吉玛制药技术有限公司合成),见表1。
2.2siRNA转染和分组 取人神经母细胞瘤细胞SK-N-SH和M17以1 ×106cells/well细胞接种于6孔培养板,待细胞长至80%汇合后,转染操作按Lipofectamine 2000 reagent说明书进行,siRNA与脂质体分别用适量不含血清和抗生素的DMEM培养基稀释,5 min后混合,室温静置20 min后加入细胞板孔中,置37 ℃、5% CO2培养箱培养6 h后,吸除含有Lipofectamine - siRNA的培养液,每孔加入2 mL新鲜细胞培养液继续培养。分组:实验分为空白对照组(parental cells,无特殊处理组)、阴性对照组(control-siRNA处理)和实验组(AEG-1 siRNA1、AEG-1 siRNA2处理)。

表1 合成的AEG-1 siRNA及无关对照siRNA序列
2.3荧光定量RT-PCR检测AEG-1 mRNA 收获转染后48 h细胞,细胞总RNA提取采用Trizol一步抽提法。逆转录成cDNA(TaKaRa RT kit)。AEG-1上游引物:5’-GGC AAT TGG GTA GAC GAA GA-3’,下游引物:5’-CCT GTT TTG GAC GGG TTT TA-3’。GAPDH(内参照)上游引物: 5’-GAG TCA ACG GAT TTG GTC GT-3’,下游引物 5’-TTG ATT TTG GAG GGA TCT CG-3’。寡核苷酸引物由上海生工生物工程技术服务有限公司合成。SYBR green system(TaKaRa)进行PCR扩增,方法依照说明书。冰浴条件下操作,彻底混合后放入荧光定量PCR仪(ABI7000型)。反应程序如下:95 ℃ 5 min后,95 ℃ 30 s,60℃ 30 s,40个循环。每份标本设3个复孔, 实验重复3次。用比较阈值法(即2-ΔΔCT方法)来测定目的基因的相对表达变化。
2.4细胞生长曲线检测 用0.25%胰蛋白酶消化转染48 h后的单层培养细胞,用含10%FBS的DMEM培养液配成单细胞悬液,以每孔2 000个细胞接种于96孔培养板中,每孔体积200 μL。将培养板移入培养箱中培养1 d,使细胞达到80%汇合。在不同时点(4 h、24 h、48 h、72 h)移弃细胞培养液,每孔加入含MTT溶液(5 g/L)10 μL的新鲜培养液100 μL,继续孵育4 h,终止培养,加入100 μL二甲基亚砜(DMSO),轻轻振荡10 min,使结晶物充分溶解。选择490 nm波长,在酶联免疫检测仪上调定各孔吸光度值(A),记录结果。以只加培养液、不加细胞的空白对照孔调零。实验重复3次。以时间为横轴,吸光度值为纵轴绘制细胞生长曲线。
2.5克隆形成 转染48 h后的单层培养细胞,消化脱壁后用含10%FBS的DMEM培养液制成细胞悬液,按每个10 cm平皿接种200个细胞的密度,加培养液10 mL,以十字方向轻轻晃动培养皿,使细胞分散均匀。每种细胞设3个复孔。静止培养14d。移弃培养液,PBS洗涤后,用醋酸甲醇(1∶4)溶液固定细胞,结晶紫染色。在显微镜下计数克隆,大于50个细胞的克隆计数在内。实验重复3次。
2.6细胞凋亡的流式细胞术检测 转染48 h后的单层培养细胞,消化液消化后,用4 ℃预冷的PBS洗细胞2次,用250 μL 1×binding buffer重悬细胞制备成单细胞悬液,调节其浓度为1×109cells/L。取100 μL细胞悬液于5 mL流式管中,设a、b、c、d 4管,a管加入5 μL Annexin-V-FITC,b管加入10 μL PI染液,c管加入5 μL Annexin-V-FITC和10 μL PI染液;d管作为分析的空白对照。混匀后室温避光孵育15 min。在反应管中加入400 μL PBS,上机检测。流式细胞仪分析:用Cell Quest软件获取细胞,先用d管作空白对照设定FSC、SSC、FITC和PI等参数,再用a、b管调整荧光1和荧光2的补偿,各参数设定好后,分析c管的数据。实验重复3次。
2.7细胞周期 转染48 h后的单层培养细胞,制备单细胞悬液。PBS洗涤2次(1 000 r/min离心5 min),用冷PBS悬浮细胞,浓度(1-2)×109cells/L。加入2-3 mL -20 ℃ 预冷70%乙醇固定细胞,4 ℃,1 h。PBS洗涤2次(1 000 r/min离心5 min)。细胞沉淀加1 mL PI染色液,混匀,4 ℃避光染色30 min,300目尼龙网过滤后上机检测。首先设定合适的获取条件,用CellQuest软件获取细胞10 000个,保存获取数据。再用Modifit软件分析细胞周期。实验重复3次。
3统计学处理
结 果
1siRNA下调AEG-1基因表达的效果
与空白对照组(parental cells)和阴性对照组(control siRNA)相比,针对2个不同序列的siRNA均能显著下调AEG-1基因表达,M17细胞的AEG-1 mRNA表达抑制率分别为41.8%和34.5%;SK-N-SH细胞的AEG-1 mRNA表达抑制率分别为61.8%和43.6%,见图1。2个细胞株中的实验结果表明AEG-1 siRNA1能更好地下调基因的表达,因此后面的实验均用AEG-1 siRNA1转染细胞。
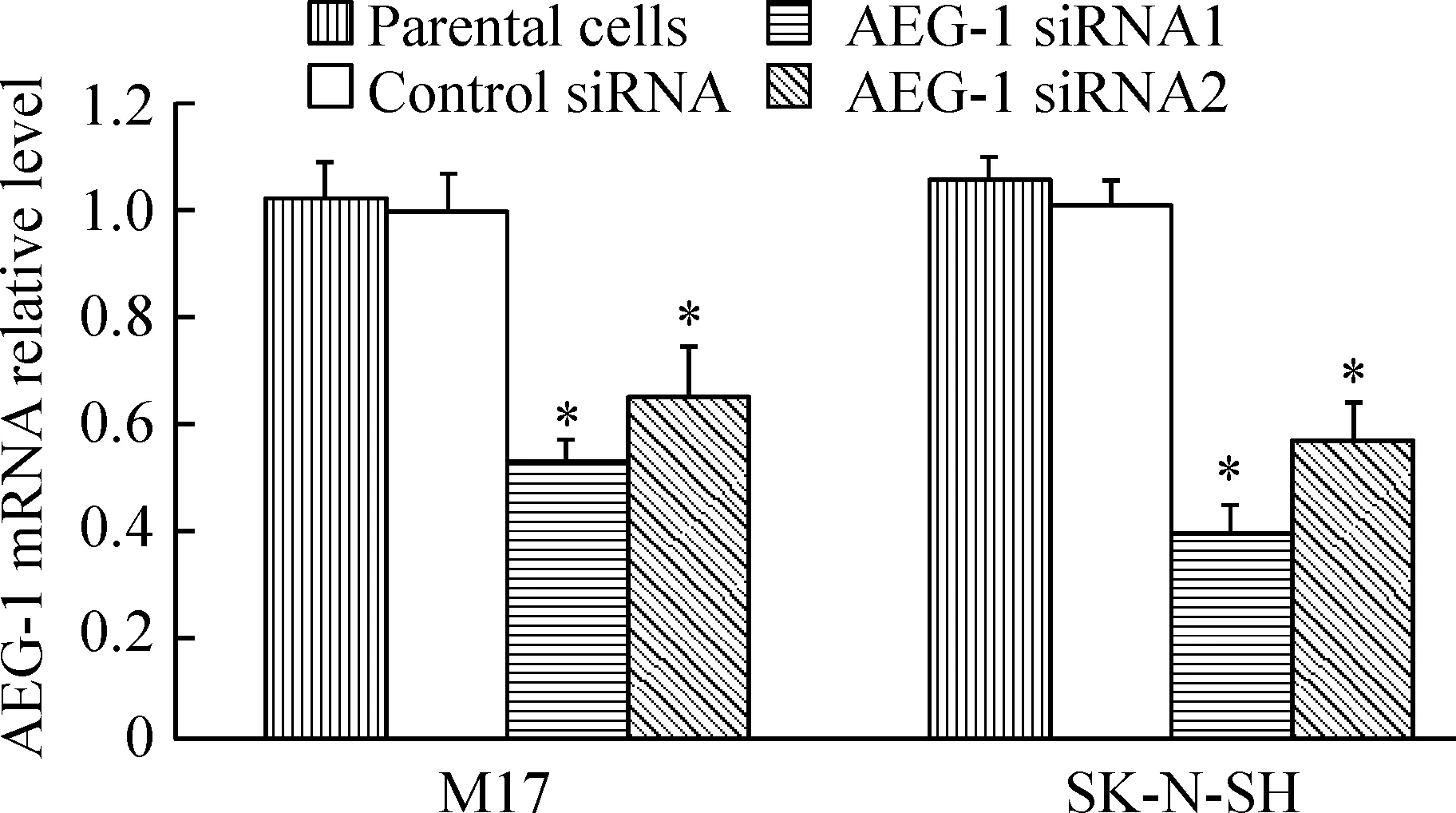
Figure 1. Knock-down of AEG-1 by specific siRNAs. Fourty-eight hours after transfection, cells were harvested. AEG-1 mRNA levels were quantified by real-time PCR analysis. Data were normalized using GAPDH as an internal standard. ±s.n=3.*Plt;0.05 vs parental cells.
2siRNA下调AEG-1表达抑制细胞的增殖
2.1MTT法检测细胞生长曲线 结果显示,AEG-1 siRNA组的细胞增殖较阴性对照组和空白对照组均明显减慢。72 h时M17细胞AEG-1 siRNA组吸光度值与空白对照组相比为42.9%,SK-N-SH细胞为49.5%,差异显著(Plt;0.05),见图2。
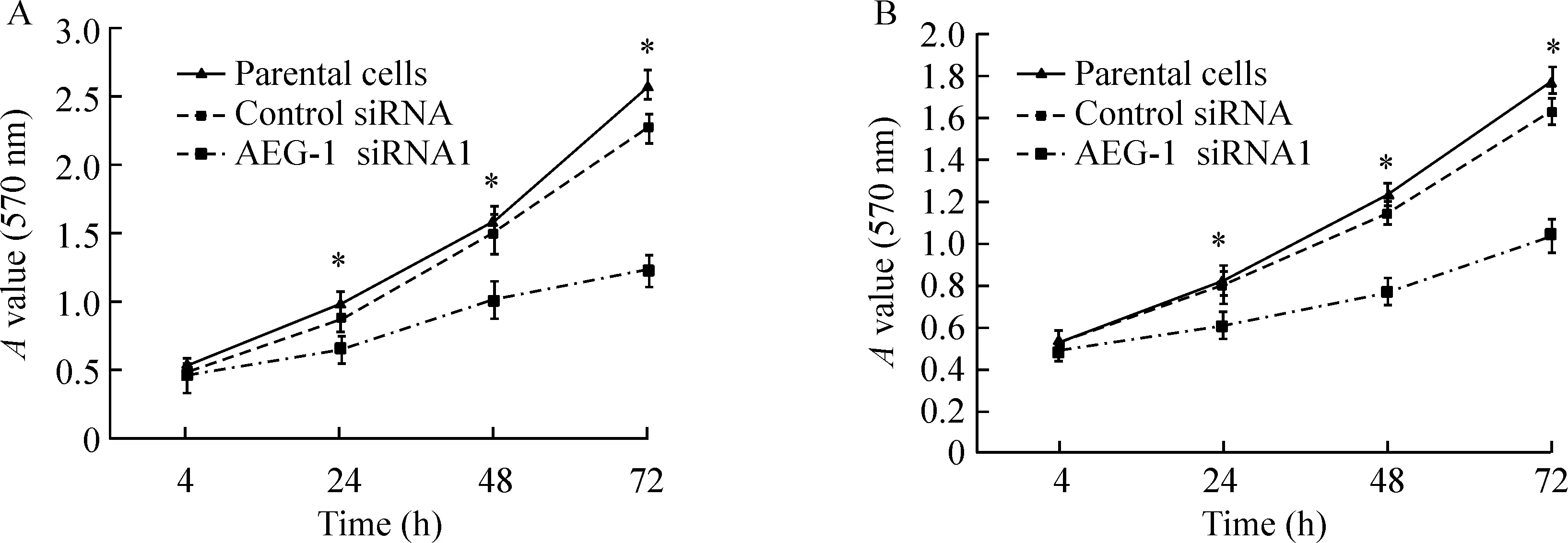
Figure 2. AEG-1 siRNA inhibits cell proliferation in neuroblastoma cells. Cell viability was evaluated by MTT assay. The results showed a significant decrease in the number of cells by 42.9% in M17 cells (A) and 49.5% in SK-N-SH cells (B) .±s.n=3.*Plt;0.05 vs AEG-1 siRNA1.
2.2克隆形成实验 结果显示,AEG-1 siRNA组细胞增殖减慢(Plt;0.05)。M17细胞的AEG-1 siRNA组、阴性对照组、空白对照组形成的克隆数分别为81.5±7.5、134.1±10.3、143.2±10.1,SK-N-SH细胞的AEG-1 siRNA组、阴性对照组、空白对照组形成的克隆数分别为62.3±7.4、116.3±10.8、121.2±9.8,见图3。
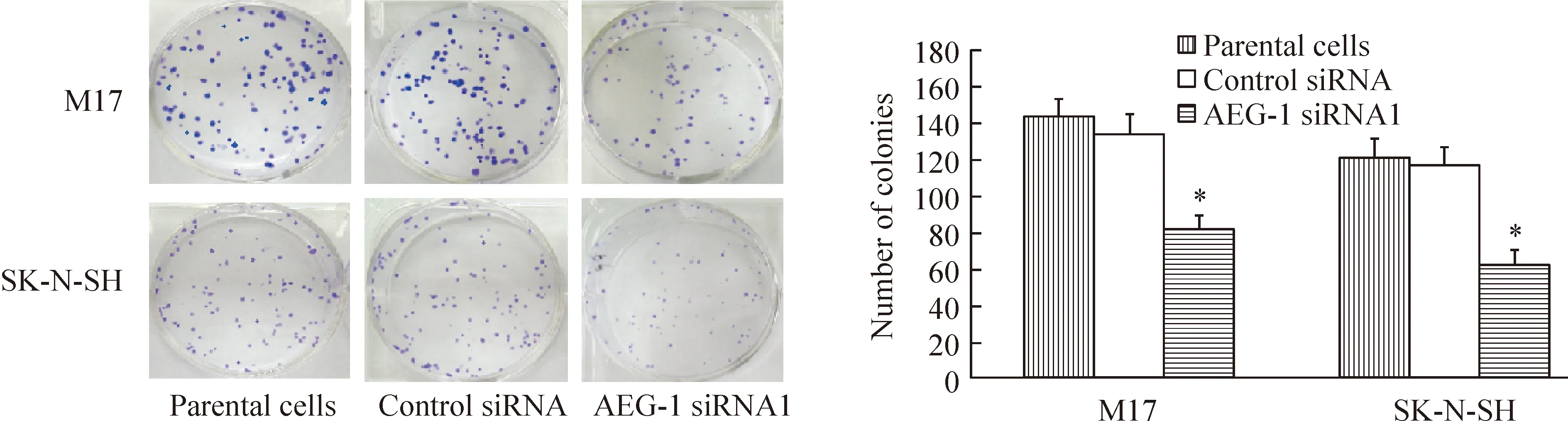
Figure 3. AEG-1 siRNA inhibits proliferation in neuroblastoma cells. Compared with the parental cells, the number of colonies was significantly reduced in AEG-1 siRNA1 group±s.n=3.*Plt;0.05 vs parental cells.
3siRNA下调AEG-1基因表达促进神经母细胞瘤细胞的凋亡
流式细胞仪检测可见, 细胞转染AEG-1 siRNA后,凋亡率明显增加。M17细胞实验组凋亡率为14.2%±2.4%,而阴性对照组和空白对照组凋亡率分别为3.9% ±1.4%和3.4% ±1.3%,实验组与阴性对照组、空白对照组相比差异显著(Plt;0.01) ;空白对照与阴性对照相比,凋亡率的差异不显著(Pgt;0.05) 。转染AEG-1 siRNA后,SK-N-SH细胞凋亡率达到12.9%±2.2%,而阴性对照组和空白对照组凋亡率分别为5.1%±1.5%和4.9%±1.6%,实验组与阴性对照组、空白对照组相比差异显著(Plt;0.01);空白对照与阴性对照相比,凋亡率无显著差异 (Pgt;0.05),见图4。
4下调AEG-1基因表达对神经母细胞瘤细胞的细胞周期的影响
应用流式细胞仪检测M17和SK-N-SH细胞转染AEG-1 siRNA后48 h细胞周期的变化,与阴性对照组比较,下调AEG-1后的DNA合成前期(G0/G1期)细胞比率显著增加,合成期(S)和DNA合成后期/分裂期(G2/M)细胞比率明显减少,见图5。
讨 论
神经母细胞瘤是婴儿最易发生的肿瘤,占1岁以内的患儿所有肿瘤的50%;是儿童第二大致死性原因,仅次于意外事故。神经母细胞瘤的不均一性是与其它肿瘤相比最与众不同的特性。尽管现有多种积极治疗手段,但其总生存率仅大约为40%。虽然神经母细胞瘤的一些亚型可能会自然消退或进展非常缓慢,但确诊时大约一半的病例为高危患者。在过去的30年里在诊断治疗等方面都取得了很大进展,可是神经母细胞瘤对临床和基础科学工作者来说仍是一个挑战。阐明其确切的分子通路可能会有助于研究人员和临床医师选择合适的治疗方案对待肿瘤的复发和进展。
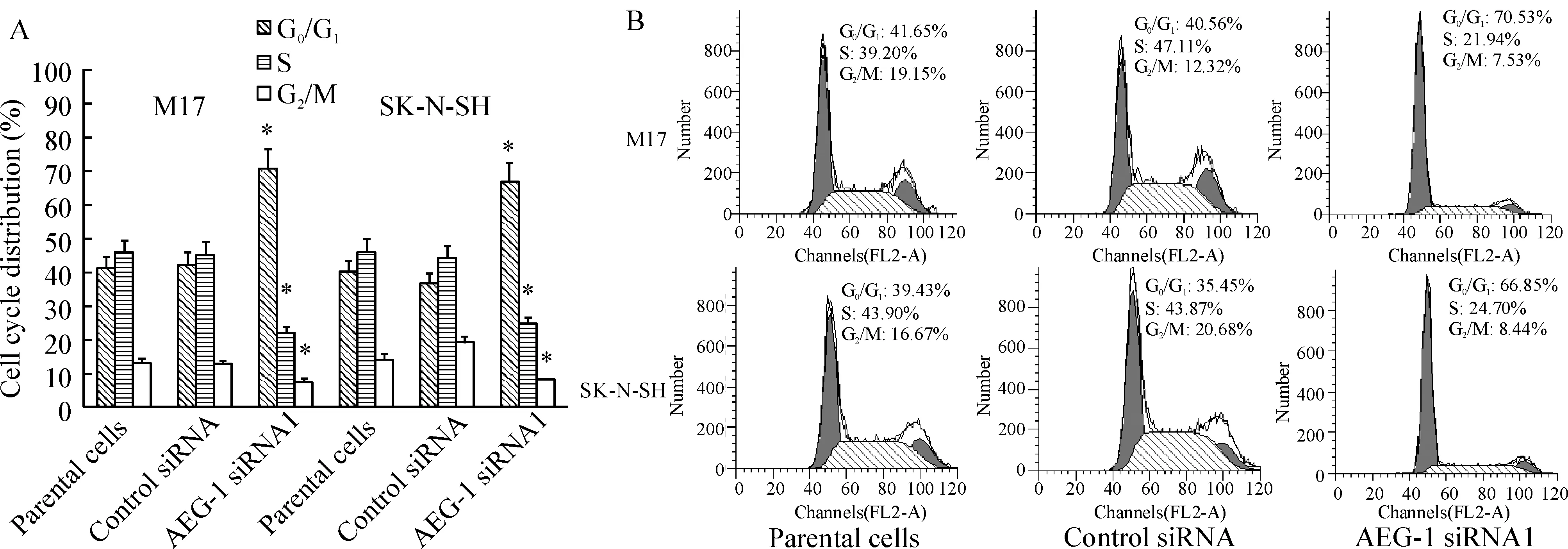
Figure 5. Knock-down of AEG-1 reduces S-and G2/M-phase cells. A:in both M17 and SK-N-SH cells 48 h after AEG-1 siRNA1 transfection, the population of G0/G1 phase was significantly increased and the population of S phase and G2/M phase was obviously decreased±s.n=3.*Plt;0.05 vs parental cells. B: representative results were shown.
AEG-1是近年发现的新基因[2,3, 5]。随着对AEG-1的深入研究,发现AEG-1不仅促进神经退行性变的发生,还促进肿瘤的进展和转移,是肿瘤的发生发展过程中的一个关键基因[7-9]。AEG-1在多种肿瘤组织和体外培养的细胞中高表达,如:乳腺癌[10]、多形性胶质细胞瘤[9]、前列腺癌[11]、黑色素瘤[12]、肝细胞癌[13]等。AEG-1参与了多种调控细胞增殖、凋亡和转移的信号通路的激活。AEG-1是NF-κB诱导基因表达的正性调节蛋白[14]。AEG-1还是Ha-ras的下游基因,Ha-ras调控AEG-1主要在转录水平而不是调节蛋白质的稳定性[15],它通过激活PI3K/GSK3β/c-Myc信号通路调控AEG-1的表达[12]。Kikuno等[14]的研究表明在前列腺癌细胞中AEG-1的过表达作为AKT正反馈的激活物和FOXO3a的抑制因子起着重要的作用;Yoo等[16]通过对肝细胞癌的研究还发现AEG-1通过激活ERK42/44和上调Wnt信号通路最后的效应器-淋巴增强因子1(LEF1/TCF1)来激活对肝细胞癌的发生起重要作用的Wnt/beta-catenin信号通路。以上的信号通路对肿瘤的发生、发展和转移起着重要作用。国外的多项研究结果证实AEG-1作为其参与者,是在肿瘤细胞的增殖、凋亡、侵袭、转移等方面起重要作用的基因。
本实验用siRNA下调人神经母细胞瘤细胞株中AEG-1基因的表达,通过检测AEG-1基因下调对细胞增殖、凋亡和细胞周期等生物学特性的影响研究探讨AEG-1在肿瘤发生、发展中所起的作用。采用MTT法和克隆形成实验检测神经母细胞瘤细胞的增殖能力,2种方法所得到的结果是一致的,即下调AEG-1能够显著降低神经母细胞瘤细胞的增殖能力。同时,下调AEG-1能增加细胞的凋亡率,说明AEG-1在细胞凋亡的过程中起了重要作用。细胞周期结果也表明下调AEG-1能够使更多的细胞阻滞在G0/G1期,减少处于增殖旺盛的细胞的比例。而空白对照组与阴性对照组之间没有显著差异。研究结果初步显示利用RNA干扰技术能阻断AEG-1的异常高表达,下调AEG-1的表达,在一定程度上抑制了神经母细胞瘤细胞的增殖,促进细胞凋亡。表明AEG-1在神经母细胞瘤发生、发展中起了重要作用,可能是神经母细胞瘤的基因治疗中有前景的新靶点。
[1] Castel V, Grau E, Noguera R, et al. Molecular biology of neuroblastoma[J]. Clin Transl Oncol, 2007, 9(8):478-483.
[2] 孙 莹,于 浩, 张 灵,等. STAT3 - siRNA对胃癌细胞株SGC - 7901增殖与凋亡的影响[J]. 中国病理生理杂志, 2010, 26(2):393-395.
[3] Su ZZ, Kang DC, Chen Y, et al. Identification and cloning of human astrocyte genes displaying elevated expression after infection with HIV-1 or exposure to HIV-1 envelope glycoprotein by rapid subtraction hybridization, RaSH[J]. Oncogene, 2002, 21(22):3592-3602.
[4] Su ZZ, Chen Y, Kang DC, et al. Customized rapid subtraction hybridization (RaSH) gene microarrays identify overlapping expression changes in human fetal astrocytes resulting from human immunodeficiency virus-1 infection or tumor necrosis factor-α treatment[J]. Gene, 2003, 306:67-78.
[5] Kang DC, Fisher PB. Complete open reading frame (C-ORF) technology: simple and efficient technique for cloning full-length protein-coding sequences[J]. Gene, 2005, 353(1):1-7.
[6] Kang DC, Su ZZ, Sarkar D, et al. Cloning and characterization of HIV-1-inducible astrocyte elevated gene-1, AEG-1[J]. Gene, 2005, 353(1):8-15.
[7] 刘海燕,宋现让,郑爱青,等. Astrocyte elevated gene - 1的研究进展[J]. 中国病理生理杂志, 2010, 26(1):188-192.
[8] 文飞球,刘智屏, 陈亦欣, 等. 整合素α2对神经母细胞瘤细胞粘附于胶原蛋白的调节作用[J]. 中国病理生理杂志, 2006, 22(6):1174-1176.
[9] 张宏卫,刘丽华,王承忠. RUNX3小干扰RNA对SH-SY5Y细胞生长和药物敏感性的作用[J]. 中国病理生理杂志, 2008, 24(3):504-508.
[10]Brown DM, Ruoslahti E. Metadherin, a cell surface protein in breast tumors that mediates lung metastasis[J]. Cancer Cell, 2004, 5(4):365-374.
[11]Sutherland HG, Lam YW, Briers S, et al. 3D3/lyric: a novel transmembrane protein of the endoplasmic reticulum and nuclear envelope, which is also present in the nucleolus[J]. Exp Cell Res, 2004, 294(1):94-105.
[12]Emdad L, Sarkar D, Su ZZ, et al. Astrocyte elevated gene-1: recent insights into a novel gene involved in tumor progression, metastasis and neurodegeneration[J]. Pharmacol Ther, 2007, 114(2):155-170.
[13]Li J, Zhang N, Song LB, et al. Astrocyte elevated gene-1 is a novel prognostic marker for breast cancer progression and overall patient survival[J]. Clin Cancer Res, 2008, 14(11):3319-3326.
[14]Kikuno N, Shiina H, Urakami S, et al. Knockdown of astrocyte-elevated gene-1 inhibits prostate cancer progression through upregulation of FOXO3a activity[J]. Oncogene, 2007, 26(55):7647-7655.
[15]Lee SG, Su ZZ, Emdad L, et al. Astrocyte elevated gene-1 activates cell survival pathways through PI3K-Akt signaling[J]. Oncogene, 2008, 27(8):1114-1121.
[16]Yoo BK, Emdad L, Su ZZ, et al. Astrocyte elevated gene-1 regulates hepatocellular carcinoma development and progression[J]. J Clin Invest, 2009, 119(3):465-477.
Knockdownofastrocyteelevatedgene-1bysiRNAinhibitscellproliferationandinducesapoptosisinhumanneuroblastomacellline
LIU Hai-yan1, JIANG Yu-jie2, SUN Ruo-peng3
(1DepartmentofPediatrics,2DepartmentofHematology,ProvincialHospitalAffiliatedtoShandongUniversity,Jinan250021,China;3DepartmentofPediatrics,QiluHospital,ShandongUniversity,Jinan250012,China.E-mail:liuhaiyan26@yahoo.com.cn)
AIM: To investigate the effect of siRNA-induced astrocyte elevated gene-1 (AEG-1) down-regulation on the proliferation, apoptosis and cell cycle of neuroblastoma cells.METHODSAn siRNA targeting to AEG-1 mRNA (AEG-1 siRNA) was constructed and transfected into neuroblastoma cells with Lipofectamine 2000. A non-specific siRNA (control siRNA) and non-treatment were used as negative control and blank control,respectively . The cell proliferation was detected by MTT method and colony formation assay. The apoptosis and cell cycle were analyzed by flow cytometry.RESULTSCompared with control groups, the expression of AEG-1 mRNA was evidently declined in the cells transfected with AEG-1 siRNAs (Plt;0.05). AEG-1 siRNA significantly decreased the cell proliferation. After treated with AEG-1 siRNA for 48 h, the percentage of apoptotic cells was significant increased and the cell cycle was arrested in G0/G1phase compared with the control cells (Plt;0.05).CONCLUSIONThe mRNA expression ofAEG-1 is down-regulated by AEG-1 siRNA in neuroblastoma cells. Knockdown ofAEG-1 expression in human neuroblastoma cells significantly inhibits cell proliferation and apoptosis, and induces cell arrest in G0/G1phase of the cell cycle.
Genes,AEG-1; RNA interference; Neuroblastoma; Apoptosis
1000-4718(2011)04-0705-06
R363
A
10.3969/j.issn.1000-4718.2011.04.016
2010-08-13
2010-12-09
△通讯作者 Tel:0531-85186335;E-mail:liuhaiyan26@yahoo.com.cn
